扩展功能
文章信息
- 古小云, 张舒岩, 袁羽帆, 杨立彬, 李艳超, 李树蕾
- GU Xiaoyun, ZHANG Shuyan, YUAN Yufan, YANG Libin, LI Yanchao, LI Shulei
- 匹鲁卡品致小鼠癫痫神经元模型的建立及其F-actin、Calponin 3和ROCK2的表达
- Establishment of mouse epileptic neuron model induced by pilocarpine and expressions of F-actin, Calponin 3 and ROCK2
- 吉林大学学报(医学版), 2017, 43(01): 47-51
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 47-51
- 10.13481/j.1671-587x.20170110
-
文章历史
- 收稿日期: 2016-09-02
2. 吉林大学第一医院神经外科, 吉林 长春 130021;
3. 吉林大学第一医院儿科, 吉林 长春 130021
2. Department of Neurosurgery, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Pediatrics, First Hospital, Jilin University, Changchun 130021, China
癫痫是一种由于大脑神经元突发性异常放电,导致短暂大脑功能障碍的慢性疾病,主要病理改变为神经元树突串珠样变或树突棘缺失和超兴奋突触的重建[1]。后者的这种变化与细胞骨架丝状肌动蛋白(filamentous actin, F-actin)的异常重构有密切关系。在神经元发育过程中,RhoA/ Rho相关含卷曲螺旋蛋白激酶2(Rho-associated coiled-coil-containing protein kinase 2,ROCK2)信号分子可以通过调节F-actin在皮质的分布,诱导突起回缩和突起末梢生长锥的塌陷,维持胚胎视网膜神经上皮的顶-底极性和增殖[2]。在成熟神经元中RhoA/ROCK2被大量激活会导致F-actin解聚增多、聚合减少,神经元树突棘密度减少,树突棘增大[3]。目前研究者[4]认为:神经元树突棘的结构异常是导致癫痫患者神经元功能障碍和认知缺陷的原因,而树突损伤是细胞骨架F-actin的功能依赖性破坏的结果;而调宁蛋白3(Calponin 3)是一种F-actin结合蛋白,能特异性地与F-actin共定位于突触后部树突棘,参与维持树突棘的形态。为了明确癫痫神经元细胞内RhoA/ROCK2与Calponin 3及F-acitn之间的关系,本研究从细胞和蛋白水平探讨匹鲁卡品所致小鼠癫痫神经元模型中Calponin 3、F-actin、ROCK2及磷酸化ROCK2(p-ROCK2)的分布和表达水平的变化。
1 材料与方法 1.1 实验动物和主要试剂SPF级清洁新生24h的ICR乳鼠,动物许可证号:SCXK (吉)2013-0001,由吉林大学实验动物中心提供。DMEM/F12培养基(Hyclone公司,美国),Neurobasal-A Medium (1X)和B-27 Serum-Free (Gibco公司,美国),Hochest33342和匹鲁卡品(Sigma公司,美国),胎牛血清(BI公司, 以色列),微管关联蛋白2(MAP2) Polyclonal Antibody (Proteintech公司, 美国),Calponin3(H-55)(SANTA CRUZ公司,美国),Alexa Fluor 594标记驴抗小鼠IgG (H+L)和Alexa Fluor546标记的鬼笔环肽(Invitrogen公司,美国),Anti-ROCK2 antibody Rabbit (Abcam公司,英国),Anti-phospho-ROCK2(博奥森公司,中国),UltraSensitive S-P超敏试剂盒(鼠/兔)和DAB显色试剂盒(迈新生物技术有限公司,中国),多聚赖氨酸(鼎国生物技术有限公司,北京),水溶性抗猝灭封片剂(Thermo公司,美国)
1.2 皮质神经元的分离和培养新生24h的ICR乳鼠,75%乙醇消毒,用镊子分开头皮和颅骨,暴露大脑,取出大脑置于冷PBS中洗去血渍,再放入解剖液中;解剖显微镜下,用弯头无齿眼科镊剔除血管膜,取大脑皮层,转入冷DMEM/F12培养基中;用眼科剪剪切5 min;加入适量37℃预热的木瓜蛋白酶,在CO2培养箱中消化,每10 min轻柔吹打,共消化30 min;加入1 mL血清终止消化;吸取上清,800 r·min-1离心5 min;弃上清,用种植液重悬细胞,计数后以3×105 mL-1细胞密度种植于多聚赖氨酸包被的24孔板中,置于37℃、3.7% CO2培养箱,4h后更换维持液,每3d半量换液1次。分别在培养1~7 d于倒置相差显微镜下观察细胞形态和树突轴突的延伸变化,拍照记录。
1.3 建立细胞癫痫模型神经元培养至第7天,将细胞随机分为4组。对照组继续用正常维持液培养;不同浓度匹鲁卡品组:培养基中加入终浓度为2、3和4 mmol·L-1的匹鲁卡品,24 h后换为正常维持液。
1.4 免疫细胞化学染色培养神经元至第7天鉴定神经元,计数10个不同视野中MAP2阳性细胞核和总细胞核,二者比值为神经元纯度。造模后1、3和7d检测神经元内Calponin 3、ROCK 2和p-ROCK2分布和表达。37℃预热PBS润洗细胞;4%多聚甲醛固定30 min;PBS洗3次,每次3 min;0.1%Triton打孔30 min,PBS洗3次,每次3 min;滴加过氧化酶阻断剂(试剂A),室温孵育10 min,PBS洗3次,每次3 min;滴加非免疫动物血清(试剂B)封闭,室温孵育10 min,分别滴加一抗MAP2(1:200)、Calponin 3(1:100)、ROCK2(1:200)和p-ROCK2(1:200),4℃过夜孵育;16h后PBS洗3次,每次3min;滴加生物素标记的第二抗体(试剂C),室温孵育10min,PBS洗3次,每次3min;滴加链霉菌抗生物素-过氧化物酶溶液(试剂D),室温孵育10min,PBS洗3次,每次3min;DAB显色,苏木精复染核,自来水返蓝,封片后显微镜下观察。
1.5 荧光染色检测神经元内F-actin分布造模后0、1、3和7d,去除神经元培养液,37℃预热PBS润洗,4%多聚甲醛固定30 min,PBS洗3次,每次3 min;0.1%Triton打孔30 min,PBS洗3次,每次3 min;Alexa Fluor 546-Phalloidin (1:500)室温孵育40 min,PBS洗3次,每次10 min;Hochest 33342染核20 min,PBS洗3次,每次3 min;吸净,封片,荧光显微镜下观察。
2 结果 2.1 皮质神经元的形态学表现细胞接种4 h后换液,即可观察到90%的细胞贴壁。此时细胞呈正圆形,胞体轮廓清晰,周围有光晕,少数细胞有细小的短突起。更换维持液1d后,胞体饱满呈圆形或椭圆形,大部分细胞长出突起,末端有生长锥样结构,细胞形状对称,暂时不能分辨轴突和树突。培养3~4 d,神经元胞体增大为圆形或锥形,表面光滑,折光性强,突起变长,可区分轴突和树突,少数突起相互连接。培养5~6 d,神经元突起进一步增多、增长,二级和三级突起明显长出,细胞突起间相互连接形成网络。培养7 d,神经元胞体丰满且立体感强,多为椎体形,胞体聚集,轴突进一步延伸,树突反复分支向外生长,形成致密的神经细胞网络。见图 1。
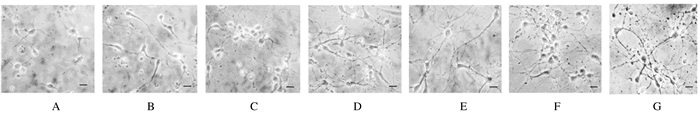
|
| 图 1 体外培养1~7d (A~G)的皮质神经元形态表现(bar=100μm) Figure 1 Morphology of cortical neurons cultured in vitrofor 1 to 7 d (A-G)(bar=100μm) |
|
|
MAP2为神经元特异性的细胞骨架蛋白,是神经元胞体和树突的标志物,常用于鉴定成熟神经元。培养7 d的神经元中MAP2阳性反应物呈棕黄色样,主要分布于神经元的胞体和突起中,胶质细胞不着色。神经元纯度达90%以上。见图 2(插页二)。
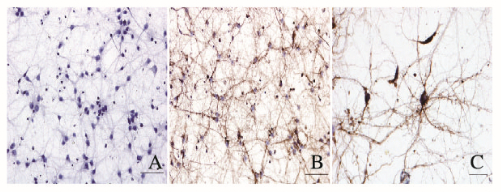
|
| A:Negative control of MAP2; B, C: Positive staining of MAP2;A, B:Bar=50 μm; C:Bar=20 μm. 图 2 免疫组织化学染色鉴定培养的皮质神经元 Figure 2 Cultured cortical neurons identified by immunohistochemistry staining |
|
|
分别采用2、3和4 mmol·L-1匹鲁卡品建立癫痫神经元模型。造模后对照组神经元中F-actin丰富,聚集在轴突、树突、树突棘以及胞体的周围,荧光强度强;2 mmol·L-1匹鲁卡品组与对照组比较无明显变化。随着匹鲁卡品的浓度增加,3和4 mmol·L-1匹鲁卡品组神经元在造模后0和1 d胞质内F-actin荧光强度较对照组明显降低,细胞突起变短甚至消失,细胞间网络连接瓦解。4 mmol·L-1匹鲁卡品组细胞结构崩解,突起断裂呈现不连贯状。在造模后3~7d,3 mmol·L-1匹鲁卡品组神经元突起和细胞间网络逐渐恢复,接近正常;而4 mmol·L-1匹鲁卡品组神经元未见改善。因此,最终选择3 mmol·L-1匹鲁卡品作为细胞癫痫模型的造模浓度。见图 3(插页二)。
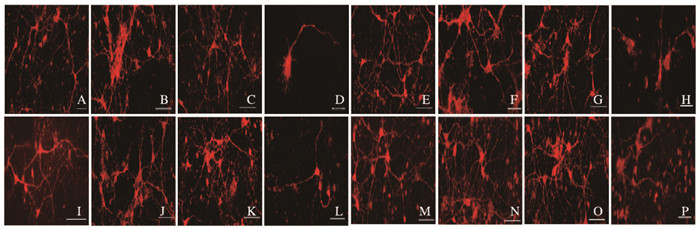
|
| A-D:0 d; E-H:1 d; I-L:3 d; M-P:7 d; A, E, I, M:Control group; B, F, J, N:2 mmol·L-1 pilocarpine group; C, G, K, O:3 mmol·L-1 pilocarpine group; D, H, L, P:4 mmol·L-1 pilocarpine group. 图 3 不同浓度匹鲁卡品组神经元中F-actin荧光染色(bar=20 μm) Figure 3 Fluorescence staining of F-actin in neurons in pilocarpine groups with different concentrations (bar=20 μm) |
|
|
对照组:Calponin 3染色浅,弥散分布在神经元胞质中细胞核周围,细胞轮廓模糊,提示表达量较少;ROCK2呈中等强度颜色,点状分布于胞质中,树突仅有少量分布,提示其表达量较低;p-ROCK2在胞质边缘及树突中有少量分布,提示磷酸化程度低。癫痫模型组(3mmol·L-1匹鲁卡品):Calponin 3染色明显加深,分布范围发生改变,主要表达在细胞膜下方,并沿树突走向增多,细胞和突起轮廓清晰,提示其表达量明显上调;ROCK2阳性染色强度明显加深,分布范围变广,细胞和突起轮廓清晰,提示其蛋白表达量增加;p-ROCK2分布变广,聚集在胞膜下方,在树突串珠样病变结构中的表达更多,提示其磷酸化水平明显提高。见图 4~6(插页二和三)。
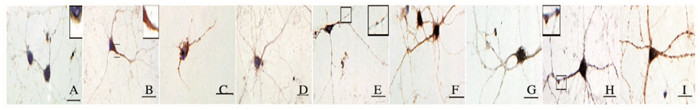
|
| A-C:1 d; D-F:3 d; G-I:7 d; A, D, G:Control group; B, E, H:2 mmol·L-1 pilocarpine group; C, F, I:3 mmol·L-1 pilocarpine group. 图 4 不同培养时间各组神经元Calponin 3免疫组织化学染色(bar=50 μm) Figure 4 Immunohistochemistry staining of Calponin 3 in neurons in various groups at different culture time (bar=50 μm) |
|
|
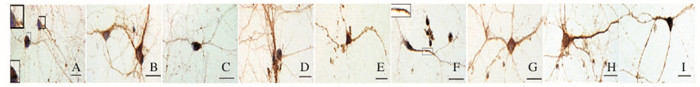
|
| A-C:1 d; D-F:3 d; G-I:7 d; A, D, G:Control group; B, E, H:2 mmol·L-1 pilocarpine group; C, F, I:3 mmol·L-1 pilocarpine group. 图 5 不同培养时间各组神经元ROCK2免疫组织化学染色(bar=20 μm) Figure 5 Immunohistochemistry staining of ROCK2 in neurons in various groups at different culture time (bar=20 μm) |
|
|
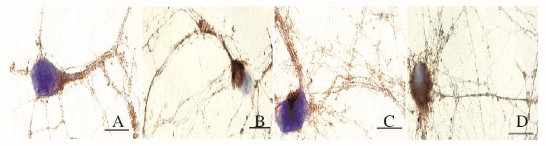
|
| A, B:0 d; C, D:3 d; A, C:Control group; B, D:3 mmol·L-1 pilocarpine group. 图 6 不同培养时间各组神经元p-ROCK 2免疫组织化学染色(bar=10 μm) Figure 6 Immunohistochemistry staining of p-ROCK2 in neurons in various groups at different culture time (bar=10 μm) |
|
|
癫痫作为世界性难治疾病,其发病机制比较复杂。通常构建的癫痫动物模型在癫痫发病机制和细胞形态学研究中有一定的局限性。Priel等[5]成功利用匹鲁卡品在体外建立了癫痫神经元模型, 本文作者参照该方法,利用培养7d的神经元培养体系建立癫痫细胞模型。由于F-actin主要分布在神经元树突和树突棘中,癫痫发作导致的F-actin的异常解聚是神经元树突棘数量减少、树突串珠样改变的形态学基础,因此F-actin可以作为评价癫痫细胞模型的形态学指标[6-7]。本研究结果显示:低浓度(2mmol·L-1)匹鲁卡品组神经元的形态和F-actin分布未发生明显改变;高浓度(4 mmol·L-1)匹鲁卡品组神经元中F-actin大量解聚,细胞突起基本消失,导致细胞死亡,无法进行后续实验,因此本研究最终采用的匹鲁卡品诱导浓度为3 mmol·L-1。虽然该组神经元F-actin部分解聚,树突棘数量有一定程度减少,但是随着培养时间的延长,这些变化逐渐改善。因此3 mmol·L-1浓度匹鲁卡品建立的神经元癫痫模型能满足本研究需要。
越来越多的证据[7-8]表明:F-actin和信号分子参与癫痫的发生和发展。研究[9-10]已经证实:NMDA受体接受刺激可活化树突棘中的RhoA,进而导致F-actin细胞骨架的重构和树突棘形态改变,并参与兴奋性谷氨酸能突触的形成和稳定。
RhoA的下游靶蛋白ROCK2在神经元中分布广泛,p-ROCK2是其活化形式,因此本文作者利用免疫组织化学方法分析癫痫神经元中ROCK2和p-ROCK2的表达和分布:对照组神经元ROCK2点状分布于胞质中,树突仅有少量存在,p-ROCK2在胞质边缘及树突中有少量分布;癫痫模型组神经元ROCK2染色明显加深,广泛分布于胞体及突起,细胞轮廓清晰,提示其蛋白表达水平提高;p-ROCK2染色也明显加深,聚集在细胞膜下方及树突串珠样病变处,提示ROCK2在表达量上升的同时其磷酸化水平同步提高,并且细胞内的分布发生改变。活化的RhoA可激活ROCK2使之磷酸化,形成复合物RhoA/p-ROCK2,并从细胞质转移到细胞膜下方[11]。这与本课题组前期的动物模型体内研究[12]结果相吻合。
目前研究[13]已证实:在非神经元细胞内,F-actin的聚合和延长与Calponin3关系密切。因此本文作者进一步研究了癫痫神经元中Calponin3的分布和表达,免疫组织化学实验结果显示:对照组神经元中Calponin 3染色浅,弥散分布在胞质中细胞核周围,细胞轮廓模糊;而癫痫细胞模型组神经元Calponin 3染色明显加深,主要分布在细胞膜下方的细胞皮质,在树突的串珠样病变处尤为明显,故细胞和突起轮廓清晰,提示Calponin3在细胞内分布改变的同时其表达量也明显上调。本文作者认为:Calponin3在癫痫细胞中定位发生变化与ROCK2的磷酸化有关。Shibukawa等[13]曾在体外滋养层细胞融合实验和成肌细胞融合实验中发现:p-ROCK2催化Calponin 3羧基端磷酸化,磷酸化的Calponin 3易位到细胞膜下方的细胞皮质。本文作者推测:本实验中癫痫神经元中Calponin3发生磷酸化,与RhoA/p-ROCK2形成复合物,从细胞质中易位到细胞膜下方的细胞皮质区。
本研究结果显示:随着培养时间延长,Calponin3表达量逐渐增加,与癫痫神经元的形态恢复程度和F-actin的分布吻合。由于磷酸化的Calponin3通过中央的actin结合区与F-actin结合,能防止F-actin解聚降解又能促进F-actin的延长和细胞骨架的稳定,使神经元的树突棘密度增加;增长的树突棘与轴突末端接触形成功能性突触结构[13-16],因此本文作者认为:在癫痫细胞模型中,Calponin 3通过代偿性表达增加,阻断F-actin解聚,促进F-actin重排,维持并恢复细胞的形态。
综上所述,在本研究中,本文作者利用3 mmol·L-1匹鲁卡品成功建立了癫痫神经元模型,并观察到神经元中F-actin解聚和重构的现象,另外神经元中Calponin 3、ROCK2和p-ROCK2的表达和细胞内定位均发生明显变化。本文作者认为:在癫痫神经元中,RhoA/p-ROCK2、Calponin3和F-actin之间有着紧密的联系。3 mmol·L-1匹鲁卡品可激活培养神经元中的RhoA/p-ROCK2复合物,促使F-actin解聚,并使Calponin 3发生磷酸化;同时,细胞内Calponin 3表达量代偿性增加,负反馈性促进F-actin的重排,逆转癫痫中神经元树突和树突棘数量的减少,促进神经元树突和树突棘数量的恢复。
| [1] | Schek HT, Gardner MK, Cheng J, et al. Microtubule assembly dynamics at the nanosale[J]. Curr Biol, 2007, 17(170): 1445–1455. |
| [2] | Poggi L, Vitorino M, Masai I, et al. Influences on neural lineage and mode of division in the zebrafish retina in vivo[J]. J Cell Biol, 2005, 171(6): 991–999. DOI:10.1083/jcb.200509098 |
| [3] | Amin E, Dubey B, Zhang SC, et al. Rho-kinase:regulation, (dys) function, and inhibition[J]. Biol Chem, 2013, 394(11): 1399–1410. |
| [4] | Plantier M, Fattoum A, Menn B, et al. Acidic calponin immunoreactivity in postnatal rat brain and cultures:subcellular localization in growth cones, under the plasma membrane and along actin and glial filaments[J]. Eur J Neurosci, 1999, 11(8): 2810–2812. |
| [5] | Priel MR, Albuquerque EX. Short-term effects of pilocarpine on rat hippocampal neurons in culture[J]. Epilepsia, 2002, 43(suppl5): 40–46. |
| [6] | Capani F, Martone ME, Deerinck TJ, et al. Selective localization of high concentrations of F-actin in subpopulations of dendritic spines in rat central nervous system:a three-dimensional electron microscopic study[J]. Comp Neurol, 2001, 435(2): 156–170. DOI:10.1002/(ISSN)1096-9861 |
| [7] | Xiong T, Liu J, Dai G, et al. The progressive changes of filamentous actin cytoskeleton in the hippocampal neurons after pilocarpine-induced status epilepticus[J]. Epilepsy Res, 2015, 118: 55–67. DOI:10.1016/j.eplepsyres.2015.11.002 |
| [8] | Zeng LH, Xu L, Rensing NR, et al. Kainate seizures cause acute dendritic injury and actin depolymerization in vivo[J]. J Neurosci, 2007, 27(43): 11604–11613. DOI:10.1523/JNEUROSCI.0983-07.2007 |
| [9] | Muly EC, Nairn AC, Greengard P, et al. Subcellular distribution of the Rho-GEF Lfc in primate prefrontal cortex:effect of neuronal activation[J]. J Comp Neurol, 2008, 508(6): 927–939. DOI:10.1002/(ISSN)1096-9861 |
| [10] | Bennett MR, Farnell L, Gibson WG. A model of NMDA receptor control of F-actin treadmilling in synaptic spines and their growth[J]. Bull Math Biol, 2011, 73(9): 2109–2131. DOI:10.1007/s11538-010-9614-4 |
| [11] | Schmandke A, Strittmatter SM. ROCK and Rho:biochemistry and neuronal functions of Rho-associated protein kinases[J]. Neuroscientist, 2007, 13(5): 454–469. DOI:10.1177/1073858407303611 |
| [12] | 程春旭, 李树蕾, 古小云, 等. PTZ诱导的癫痫急性发作大鼠大脑神经元中F-actin、Calponin 3和ROCK2的表达及其意义[J]. 吉林大学学报:医学版, 2015, 41(2): 299–303. |
| [13] | Shibukawa Y, Yamazaki N, Daimon E, et al. Rock-dependent calponin 3 phosphorylation regulates myoblast fusion[J]. Exp Cell Res, 2013, 319(5): 633–648. DOI:10.1016/j.yexcr.2012.12.022 |
| [14] | Shibukawa Y, Yamazaki N, Kumasawa K, et al. Calponin 3 regulates actin cytoskeleton rearrangement in trophoblastic cell fusion[J]. Mol Biol Cell, 2010, 21(22): 3973–3984. DOI:10.1091/mbc.E10-03-0261 |
| [15] | Appel S, Allen P, Vetterkind S, et al. h3/Acidic calponin:an actin-binding protein that controls extracellular signal-regulated kinase 1/2 activity in nonmuscle cells[J]. Mol Biol Cell, 2010, 21(8): 1409–1422. DOI:10.1091/mbc.E09-06-0451 |
| [16] | 朱坤, 胡明, 杨蓬勃, 等. 阿司匹林通过促进海马功能性神经再生改善颞叶癫痫慢性期小鼠的空间记性能力[J]. 西安交通大学学报:医学版, 2016, 37(5): 622–625. |
 2017, Vol. 43
2017, Vol. 43


