扩展功能
文章信息
- 付秀美, 杨振江, 王荣良, 王晶, 王小杰, 陈志宏, 杨振军
- FU Xiumei, YANG Zhenjiang, WANG Rongliang, WANG Jing, WANG Xiaojie, CHEN Zhihong, YANG Zhenjun
- 大鼠脂肪源性干细胞来源的施万样细胞的增殖能力
- Proliferation ability of Schwann-like cells derived from rat adipose-derived stem cells and its significance
- 吉林大学学报(医学版), 2017, 43(01): 36-41
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 36-41
- 10.13481/j.1671-587x.20170108
-
文章历史
- 收稿日期: 2016-06-09
2. 河北省承德市妇幼保健医院儿科, 河北 承德 067000;
3. 承德医学院预防医学教研室, 河北 承德 067000;
4. 承德医学院基础医学研究所, 河北 承德 067000
2. Department of Pediatrics, Chengde Maternal and Child Health Hospital, Chengde 067000, China;
3. Department of Preventive Medicine, Chengde Medical College, Chengde 067000, China;
4. Institute of Basic Medical Sciences, Chengde Medical College, Chengde 067000, China
施万细胞(Schwann cells,SCs)是周围神经的胶质细胞,具有神经营养、趋化和使再生神经纤维成熟的功能。周围神经损伤后,SCs不但能够增生、迁移,形成Büngner带,作为桥梁引导再生神经纤维向远端生长并到达靶器官,还能分泌多种神经营养因子和神经生长因子,诱导并促进轴突生长,为神经修复营造较为理想的微环境[1]。但临床上SCs的获取会对患者造成一定的损伤和后遗症状,且SCs来源有限,体外扩增缓慢,容易受增殖更快的成纤维细胞污染和排斥,难以满足临床的需要;而且为避免排斥反应所采用的自体SCs,需进行二次手术而延误最佳修复时间[2]。脂肪源性干细胞(adipose-derived stem cells,ADSCs)是从成体脂肪组织中分离出的间充质干细胞,具有来源广泛、取材方便、干细胞丰度高、体外可长时间扩增并增殖迅速的优点而成为研究热点[3]。本研究以ADSCs为种子细胞,将其在多种细胞因子的作用下诱导分化为施万样细胞,以期为神经再生的细胞治疗进一步提供理论和实验依据。
1 材料与方法 1.1 实验动物和主要试剂雄性Wistar大鼠(SPF级),鼠龄3~4周,体质量为80~100 g,动物合格证号:SYXK (辽)2013-0001。Ⅰ型胶原酶和0.25%胰酶-EDTA (美国Invitrogen公司),DMEM/F12细胞培养基(美国Genview公司),胎牛血清(以色列BI公司),S-100β、P75和胶质纤维酸性蛋白(GFAP)抗体(美国Santa Cruz公司),Cy3/FITC荧光二抗(美国Proteintech公司),RNA isolater及Ace-HiTM One Step Quantitative Real-time PCR SYBR Green Kit (美国Vazyme公司),S-100β、P75、GFAP和GAPDH引物由北京鼎国生物技术有限公司合成。
1.2 ADSCs的分离和培养无菌条件下切取雄性Wistar大鼠附睾旁脂肪组织;0.01mol·L-1 PBS仔细清洗、剪碎;0.1%Ⅰ型胶原酶37℃消化45~60 min;200目滤网过滤后加入等量的含10%FBS的DMEM/F12培养基终止消化,1200 r·min-1离心15 min,取细胞沉淀;重新悬浮细胞、过滤、离心,再次重悬细胞;最后用含有10% FBS的DMEM/F12培养液制成单细胞悬液,接种于培养瓶中,放入37℃、5% CO2培养箱内培养。2 d后第1次换液,以后根据细胞生长情况每2~3 d换液1次。待细胞铺满瓶底80%时,用0.25%胰酶-EDTA消化,按1:2比例传代培养。
1.3 ADSCs诱导分化为施万样细胞取第4代ADSCs,待贴壁细胞达80%时,加入0.25%胰酶-EDTA消化细胞,1000 r·min-1离心5 min收集细胞,调细胞密度至1×105mL-1;用含1 mmol -1β-巯基乙醇(β-mercaptoethanol,β-ME)的无血清培养液培养细胞24 h,用含35 μg·L-1全反式维甲酸(alltrans-retinoic acid,ATRA)的培养液培养72 h进行预诱导。换用SCs条件培养液[DMEM/F12培养液添加5 μg·L-1血小板衍生因子AA (PDGF-AA)、10 μg·L-1碱性成纤维细胞生长因子(bFGF)、0.014 mol·L-1腺苷酸环化酶激活剂(Forskolin,FSK)和200 μg·L-1 Heregulin-β]培养10~12 d。每3 d全量换液1次,用基础培养液代替条件培养液作为空白对照组。
1.4 施万样细胞表型鉴定ADSCs诱导分化10~12 d时,分别采用免疫荧光、Western blotting和Real-time PCR法检测SCs特异性标志物S-100β、P75、GFAP蛋白和mRNA的表达。
1.4.1 免疫荧光法细胞爬片48 h后,依次经过4%多聚甲醛固定细胞20 min、5% BSA室温封闭30 min后加入一抗:抗S-100β、抗P75和抗GFAP (稀释浓度均为1:200);4℃孵育过夜;加入二抗(Cy3/FITC标记, 1:100),室温孵育1 h;DAPI浸染细胞核,荧光防淬灭封片剂封片,荧光显微镜下观察并拍照。
1.4.2 Western blotting法采用0.25%胰酶-EDTA消化法收集细胞,向沉淀中加入裂解液(RIPA:PMSF为99:1),冰上裂解30~40 min;4℃、12 000 r·min-1离心30 min,取上清即为所得细胞蛋白;BCA蛋白试剂盒进行蛋白定量;配置30 μg上样体系,100℃、5 min蛋白变性;SDS-PAGE凝胶电泳;20V、23 min进行半干转电转移;5% BSA室温封闭1 h;加入一抗[S100β、P75、GFAP (1:200)和GAPDH (1:10000)],4℃孵育过夜;加入抗小鼠/兔IgG-HRP二抗(1:10000),37℃孵育1 h;采用ChemiDoc XRS+化学发光成像系统(美国Bio-Rad公司)进行ECL发光并行统计分析。
1.4.3 Real-time PCR法采用RNA isolater提取细胞mRNA;核酸仪检测mRNA纯度和浓度,纯度在1.9~2.1说明所提纯的mRNA没有被污染;采用Ace-HiTM One Step quantitative real-time PCR SYBR Green Kit并用罗氏480 Real-time PCR仪按照说明书进行mRNA定量分析。引物序列设计如下,S-100β:forward 5′-CTTGATTTGCTTCAGGGATGA-3′,reverse 5′-CCCACAG-AGTGTTGATTTCG-3′;P75:forward 5′-TTTGCTTGCTGTTGGAATGA-3′,reverse 5′-ATGCTCCTGGTCTCTTCACC-3′;GFAP:forward 5′-GCTCCAAGATGAAACCAACC-3′,reverse 5′-CCAGCGACTCAACCTTCCT-3′;GAPDH:forward 5′-GGAGCGTGGCTACTCTTTTG-3′,reverse 5′-GGCTGGAAGAGTGTCTCAGG-3′。PCR反应条件:反转录,50℃、30 min;预变性,95℃、10 min;95℃、10 s,60℃、30 s,40个循环。为减少误差,每个样本均重复3次。每一目的基因均与对应的内参基因GAPDH进行校正后采用2-ΔΔCt法进行相对定量分析。
1.5 MTT法检测施万样细胞的增殖能力取培养1、3、5、7、9和11 d的施万样细胞,用0.25%胰酶-EDTA消化后,制成单细胞悬液,调细胞密度至1×104mL-1,接种于96孔培养板(每孔200 μL);培养24 h后,每孔加入MTT溶液(5 g·L-1)20 μL,37℃孵育4 h;每孔加入DMSO 150 μL;将培养板置于酶联免疫检测仪上振荡10 min;测定每孔的吸光度(A)值,以A值代表细胞的增殖能力。以时间作为横轴,A值作为纵轴绘制细胞的生长曲线。倒置显微镜下每天观察和记录细胞的生长状态。
1.6 统计学分析应用SPSS 17.0统计学软件进行统计学分析。ADSCs组和施万样细胞组S100β、P75和GFAP蛋白及mRNA表达水平以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 ADSCs的分离和培养原代ADSCs接种24 h后大多数细胞均已贴壁生长,倒置显微镜下观察细胞为短梭形或多边形(图 1A,见插页二);1周后,大量成纤维细胞样细胞生长且细胞排列具有一定的方向性,呈簇状或漩涡状排列(图 1B,见插页二)。第1~5代细胞增长迅速,增殖活跃。
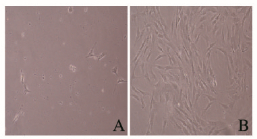
|
| A:24 h;B:1 week. 图 1 原代培养ADSCs的形态表现(×100) Figure 1 Morphological manifestation of primary ADSCs (×100) |
|
|
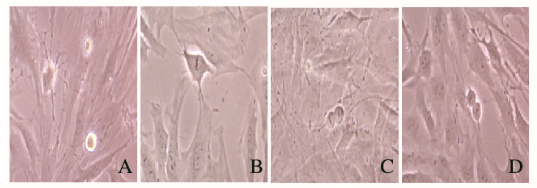
诱导分化初期,部分胞体收缩为梭形,胞体两侧可见对称生长的细长突起(图 2A,见插页二);培养10~12 d后胞体继续收缩呈梭形,排列成栅栏样,细长的突起增多,且互相吻合成网(图 2B,见插页二)。
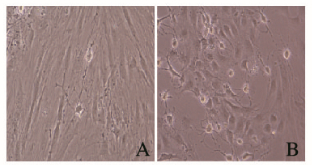
|
| A:Cultured cells at the early stage of differentiation;B:ADSCs differentiated into SC phenotype. 图 2 ADSCs诱导分化为施万细胞显型(×200) Figure 2 ADSCs differentiation into Schwann cell phenotype (×200) |
|
|
采用免疫荧光、Western blotting和Real-time PCR法检测细胞中S-100β、P75和GFAP蛋白及mRNA表达。免疫荧光结果:S-100β和P75蛋白阳性产物为红色荧光标记、GFAP蛋白阳性产物为绿色荧光标记,阳性产物均位于细胞浆及其突起(图 3,见插页二)。Western blotting结果:在蛋白Marker的10 000、42 000和48 000标记处可见S-100β、P75和GFAP蛋白的免疫印迹条带(图 4);定量分析结果:施万样细胞组S-100β、P75和GFAP蛋白和mRNA相对表达水平明显高于ADSCs组(P < 0.01)。见表 1。诱导分化后的细胞均表达SCs标志物S-100β、P75和GFAP,类似于真正的SCs。
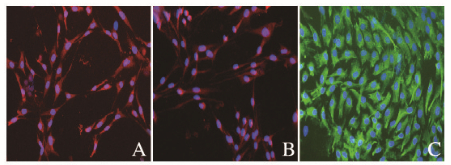
|
| A: S100β;B: P75;C: GFAP cell nuclei labeled with DAPI (blue). 图 3 免疫荧光染色检测施万样细胞表型(×200) Figure 3 Phenotypes of Schwann-like cells detected by immunofluorescence staining (×200) |
|
|
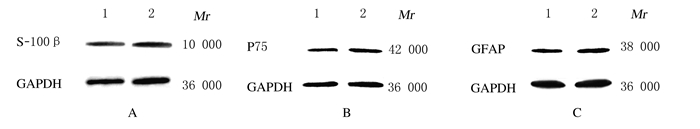
|
| A: S-100β;B: P75;C: GFAP;Lane 1: ADSCs;Lane 2: Schwann like cells. 图 4 Western blotting法检测施万样细胞中S-100β、P75和GFAP蛋白表达水平 Figure 4 Expression levels of S-100β, P75, and GFAP in Schwann-like cells by Western blotting method |
|
|
| (n=3, x±s) | |||||||
| Group | Protein | mRNA | |||||
| S-100β | P75 | GFAP | S-100β | P75 | GFAP | ||
| ADSCs | 0.42±0.26 | 0.43±0.23 | 0.50±0.15 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | |
| Schwann like cells | 0.85±0.50* | 0.72±0.33* | 0.77±0.36* | 65.16±4.38* | 51.05±7.94* | 79.61±8.02* | |
| *P < 0.01 vs ADSCs group. | |||||||
在诱导分化第1~3天细胞生长缓慢,第3天后细胞增殖迅速,且一直持续到第7天;第9~11天细胞仍处于增殖状态,但增殖速度却逐渐下降。见图 5。
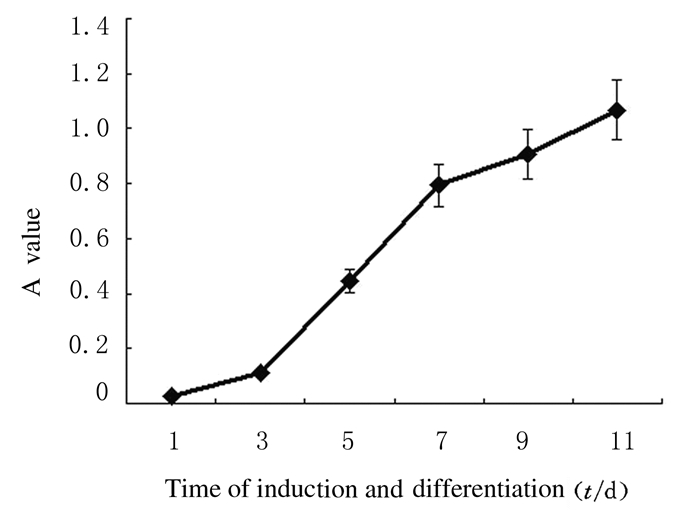
|
| 图 5 MTT法检测施万样细胞的增殖能力 Figure 5 Proliferation abilities of Schwann-like cells detected by MTT method |
|
|
在施万样细胞进行有丝分裂的前期, 核仁消失,染色体散乱地分布在细胞中央;细胞分裂中期, 染色体规则地排列在赤道板上;细胞分裂后期,姐妹染色单体分开,并向相反的方向移动,染色单体分成2组,细胞被拉长,呈哑铃型;细胞分裂末期,可见核膜出现,染色体消失,1个细胞分裂为2个。见图 6(插页二)。
|
| A:Prophase;B:Metaphase;C:Anaphase;D:Telophase. 图 6 施万样细胞的有丝分裂图像(×400) Figure 6 Images of mitosis of Schwann-like cells (×400) |
|
|
在干细胞的应用中,胚胎干细胞因存在法律和伦理道德问题,间充质干细胞(mesenchymal stem cells,MSCs)作为替代资源可从多种组织中分离出来。首先,可从脐带、脐带血或者胎盘组织中分离得到MSCs,但此操作要在婴儿出生时进行,如需自体移植还要确保能够长期储存。有研究[4]报道:脐带血来源的MSCs不具有向脂肪组织分化的能力。骨髓基质干细胞(bone marrow-derived mesenchymal stem cells,BMMSCs)不仅具有较强的增殖能力而且具有可塑性和多向分化潜能,但在临床应用中存在来源差、干细胞丰度低、有疼痛、创伤和感染等危险因素的局限[5]。脂肪组织和骨髓均来源于中胚层,ADSCs和BMMSCs在形态学和免疫表型上相近,并且脂肪组织在体内含量丰富,具有取材方便、损伤小、干细胞获得量大、适合自体移植且易于被患者接受等特点。研究[6-7]报道:ADSCs的获得量约为BMMSCs的500倍,而且ADSCs比BMMSCs易于培养、增殖速度相对较快且不易衰老。因此,ADSCs在细胞移植和组织工程等领域具有无可比拟的优越性。
本实验于无菌条件下切取Wistar大鼠附睾旁脂肪组织作为获取ADSCs的来源,ADSCs的体外分离、纯化是本实验的前提;应用0.1%Ⅰ型胶原酶于37℃消化45~60 min后得到单个核细胞群,经过差速贴壁、换液、传代等方法去除黏附能力差的杂细胞,获得贴壁、生长较好的ADSCs,1周后可见ADSCs形成70%~80%融合,漩涡状生长明显。经过多次传代,细胞形态均一,成类纤维细胞样外观,说明其能稳定增殖和传代。
SCs是周围神经系统中的神经胶质细胞,参与了神经损伤后再生、功能恢复的整个过程,在周围神经再生修复中具有核心作用。Sun等[8]用种植SCs的神经支架桥接损伤的坐骨神经发现:SCs能促进轴突再生及加速神经功能的恢复。Evans等[9]发现:神经缺损后,远端轴突再生面积与SCs呈浓度依赖性。但是,体外培养SCs来源受限,培养周期长,而且易受到其他细胞的污染和排斥,所以难以对SCs进行分离、纯化并使其达到治疗数量,因此SCs在临床上的应用受到极大的限制,寻找一种获取容易、增殖周期短,同时免疫原性小的SCs源,对周围神经损伤后的再生修复具有十分重要的意义。
本研究在多种细胞因子的共同作用下,将ADSCs诱导分化为施万样细胞。β-ME作为还原剂,可增加细胞内cAMP水平,进而减轻过氧化物对细胞的损害,从而促进细胞的贴壁[10]。β-ME对无血清培养液里的神经元具有保护功能,还可增加其发出神经突起的能力[11]。ATRA是机体正常生长发育和生理活动必不可少的主要因素之一,研究[12]表明:ATRA可通过细胞表面受体RARs和RXRs来调节一些编码因子的表达,发挥促有丝分裂和促分化作用,早期趋化干细胞向神经方向分化。Heregulin-β可阻滞前体SCs凋亡,选择性地引导神经嵴向SCs分化,其中neuregulin-1的主要作用就是参与神经胶质细胞的分化、调控SCs的产生及髓鞘的形成[13]。FSK是腺苷酸环化酶激活剂,可通过增加细胞内cAMP合成或激活PKA信号转导通路,使神经干细胞向胶质细胞分化[14]。bFGF和PDGF可发挥促进早期的神经细胞向SCs发育成熟的作用[15]。
本研究中免疫荧光结果显示:双极或三极甚至多极细胞高表达S-100β、P75和GFAP蛋白。为确认通过免疫荧光染色的结果不是由于任何人为的因素导致的细胞收缩,同时对所分化的细胞进行了Western blotting和Real-time PCR检测。Western blotting结果显示:在与蛋白Marker相对应的相对分子质量为10 000、42 000和48 000条带处呈现S-100β、P75和GFAP蛋白的免疫反应条带;同时Real-time PCR检测到S-100β、P75和GFAP mRNA的表达。有研究[16]表明:在多种诱导因子的作用下,ADSCs向SCs的分化是持久和不可逆的。
此外,在本研究过程中观察到了施万样细胞的有丝分裂现象。这种有丝分裂不但能够使施万样细胞在短时间内得到数量级的扩增,而且可使子代细胞保留原代细胞的形态学特征及其特点,具有非常稳定的遗传性状。如能充分利用细胞的这种有丝分裂,在短时间内就能得到大量遗传性稳定的施万样细胞,满足临床治疗的需要,就能解决临床上SCs应用的局限性。期望在不久的将来,源自ADSCs的施万样细胞在神经再生医学领域展现出更大的应用潜力。
| [1] | Lin G, Zhang H, Sun F, et al. Brain-derived neurotrophic factor promotes nerve regeneration by activating the JAK/STAT pathway in Schwann cells[J]. Transl Androl Urol, 2016, 5(2): 167–175. DOI:10.21037/tau |
| [2] | Arthur-Farraj PJ, Latouche M, Wilton DK, et al. c-Jun reprograms schwann cells of injured nerves to generate a repair cell essential for regeneration[J]. Neuron, 2012, 75(4): 633–647. DOI:10.1016/j.neuron.2012.06.021 |
| [3] | Boeloni JN, Ocarino NM, Goes AM, et al. Comparative study of osteogenic differentiation potential of mesenchymal stem cells derived from bone marrow and adipose tissue of osteoporotic female rats[J]. Connect Tissue Res, 2014, 55(2): 103–114. DOI:10.3109/03008207.2013.860970 |
| [4] | De Luca L, Trino S, Laurenzana I, et al. MiRNAs and piRNAs from bone marrow mesenchymal stem cell extracellular vesicles induce cell survival and inhibit cell differentiation of cord blood hematopoietic stem cells:a new insight in transplantation[J]. Oncotarget, 2016, 7(6): 6676–6692. |
| [5] | Liu G, Cheng Y, Guo S, et al. Transplantation of adipose-derived stem cells for peripheral nerve repair[J]. Int J Mol Med, 2011, 28(4): 565–572. |
| [6] | Mostafavi FS, Razavi S, Mardani M, et al. Comparative study of microtubule-associated protein-2 and glial fibrillary acidic proteins during neural induction of human bone marrow mesenchymal stem cells and adipose-derived stem cells[J]. Int J Prev Med, 2014, 5(5): 584–595. |
| [7] | Sabatino MA, Santoro R, Gueven S, et al. Cartilage graft engineering by co-culturing primary human articular chondrocytes with human bone marrowstromal cells[J]. J Tissue Eng Regen Med, 2015, 9(12): 1394–1403. DOI:10.1002/term.1661 |
| [8] | Sun XH, Che YQ, Tong XJ, et al. Improving nerve regeneration of acellular nerve allografts seeded with SCs bridging the sciatic nerve defects of rat[J]. Cell Mol Neurobiol, 2009, 29(3): 347–353. DOI:10.1007/s10571-008-9326-6 |
| [9] | Evans GR, Brandt K, Katz S, et al. Bioactive poly (L-lactic acid) conduits seeded with Schwann cells for peripheral nerve regeneration[J]. Biomaterials, 2002, 23(3): 841–848. DOI:10.1016/S0142-9612(01)00190-9 |
| [10] | Yang L, Fang J, Liao D, et al. Schwann cells differentiated from adipose-derived stem cells for the treatment of brain contusion[J]. Mol Med Rep, 2014, 9(2): 567–573. |
| [11] | Gao S, Zheng Y, Cai Q, et al. Different methods for inducing adipose-derived stem cells to differentiate into Schwann-like cells[J]. Arch Med Sci, 2015, 11(4): 886–892. |
| [12] | Quan H, Wu X, Tian Y, et al. Overexpression of CDK5 in neural stem cells facilitates maturation of embryonic neurocytes derived from rats in vitro[J]. Cell Biochem Biophys, 2014, 69(3): 445–453. DOI:10.1007/s12013-014-9816-8 |
| [13] | Barrenschee M, Lange C, Cossais F, et al. Expression and function of Neuregulin 1 and its signaling system ERBB2/3 in the enteric nervous system[J]. Front Cell Neurosci, 2015, 9: 360. |
| [14] | Zhu H, Yang A, Du J, et al. Basic fibroblast growth factor is a key factor that induces bone marrow mesenchymal stem cells towards cells with Schwann cell phenotype[J]. Neurosci Lett, 2014, 559: 82–87. DOI:10.1016/j.neulet.2013.11.044 |
| [15] | Zhao Y, Jiang H, Liu XW, et al. Erratumto:Neurogenic differentiation from adipose-derived stem cells and application for autologous transplantation in spinal cord injury[J]. Cell Tissue Bank, 2015, 16(4): 649. DOI:10.1007/s10561-015-9496-7 |
| [16] | Yan K, Zhang R, Sun C, et al. Bone marrow-derived mesenchymal stem cells maintain the resting phenotype of microglia and inhibit microglial activation[J]. PLoS One, 2013, 8(12): e84116. DOI:10.1371/journal.pone.0084116 |
 2017, Vol. 43
2017, Vol. 43


