扩展功能
文章信息
- 石立强, 李洪宇, 苑广信, 糜心雅, 谢立亚, 杜培革, 安丽萍
- SHI Liqiang, LI Hongyu, YUAN Guangxin, MI Xinya, XIE Liya, DU Peige, AN Liping
- 高活性小牛血去蛋白提取物对四氯化碳致急性肝损伤模型小鼠的保护作用
- Protective effect of high activity deproteinized extract of calf blood on CCl4-induced acute liver injury of mice
- 吉林大学学报(医学版), 2017, 43(01): 32-35
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 32-35
- 10.13481/j.1671-587x.20170107
-
文章历史
- 收稿日期: 2016-08-04
肝损伤是指病毒感染、肝毒性药物、有毒物质和肝缺血再灌注等因素导致的急性肝脏功能异常,是各种肝病共同的病理基础,其病理特点主要为肝细胞变性、坏死和凋亡,肝损伤长期存在往往导致肝纤维化,是肝硬化、肝癌发生的重要使动因素[1]。因此防治肝损伤是临床肝病治疗的主要环节之一,及时控制肝损伤的发生和发展对治疗肝病具有重要的临床意义。
小牛血去蛋白提取物(deproteinized extract of calf blood, DECB)主要成分为活性多肽(相对分子质量小于5000)、核苷酸、低聚糖和脂类等小分子有机物,目前的研究表明其具有促肝细胞生长、增加肝细胞氧及葡萄糖利用度和免疫增强作用[2]。已有研究[3-4]表明:DECB可以抑制乙型肝炎病毒复制,对外伤性肝脏损伤后肝功能具有保护作用,但其对化学性肝损伤的保护作用鲜有报道。本课题组一直致力于DECB相关研究,改进其生产工艺,提高药效学活性,这种高活性DECB生产工艺已经获得国家授权专利(专利号:201210434370.7)[5]。本研究通过建立四氯化碳(CCl4)致小鼠急性肝损伤模型,观察其对急性化学性肝损伤小鼠的保护作用及其机制,为进一步研究开发DECB的新用途提供重要的理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康ICR种小鼠40只,雄性,体质量(20±2) g,吉林省长春市亿斯实验动物技术有限责任公司提供(动物许可证号: 201500011019)。DECB由本实验室自制;护肝片由黑龙江葵花药业股份有限公司提供,批号201408073;丙氨酸氨基转移酶(ALT)试剂盒和天冬氨酸氨基转移酶(AST)试剂盒购自上海永乐生物制品研究所;谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒和总超氧化物歧化酶(T-SOD)试剂盒均购自南京建成生物工程研究所,批号分别为20151204、20151121和20151016;TUNEL凋亡检测试剂盒购自瑞士罗氏制药公司,批号为11684817910。SPX-250B-Z型恒温生化培养箱(上海博远实业有限公司),5430R低温高速离心机(美国Eppendorf公司),Infinite M200型酶标仪(瑞士TECAN公司)。
1.2 实验动物分组及给药雄性ICR小鼠40只,适应性喂养3 d。随机分为对照组、模型组、DECB组和阳性药物组,每组10只。对照组和模型组小鼠给予生理盐水(20 mL·kg-1),DECB组小鼠给予DECB 1 g·kg-1,阳性药物组小鼠给予护肝片0.63 g·kg-1。连续灌胃给药30 d,每天1次。
1.3 小鼠CCl4肝损伤模型制备各组小鼠末次灌胃给药2 h后,正常对照组腹腔注射调和油溶液,其余各组小鼠腹腔注射10%CCl4调和油溶液(10 mL·kg-1)。
1.4 生化指标测定及方法小鼠末次灌胃给药12 h后禁食不禁水,24 h后取外周血,离心血清,按照试剂盒说明书方法测定ALT和AST活性。取小鼠肝脏,用冷生理盐水冲洗后制备10%肝匀浆,离心后取上清,测定T-SOD、GSH和MDA水平,按照试剂盒说明书操作。
1.5 肝组织HE染色取小鼠肝脏,用10%中性甲醛固定,常规石蜡包埋、切片,HE染色,光镜下观察。
1.6 TUNEL法检测肝组织细胞凋亡取肝组织用TUNEL法检测肝细胞凋亡。按照试剂盒说明进行TUNEL染色,经TUNEL染色后凋亡细胞核染成深综色或深褐色。
1.7 统计学分析采用SPSS 16.0统计软件进行统计学处理。小鼠血清中ALT和AST活性及肝组织中GSH、MDA和T-SOD水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠肝功能指标与对照组比较,模型组小鼠血清中ALT和AST活性均明显升高(P < 0.05);与模型组比较,DECB组和阳性药物组小鼠血清中ALT和AST活性明显降低(P < 0.05)。见表 1。
| [n=10, x±s, λB/(IU·L-1)] | ||
| Group | AST | ALT |
| Control | 61.38±6.42 | 25.19±5.96 |
| Model | 97.73±9.33* | 56.46±11.30* |
| DECB | 65.34±15.39△ | 33.01±5.86△ |
| Positive drug | 63.70±7.48△ | 35.04±3.99△ |
| *P < 0.05 vs control group;△P < 0.05 vs model group. | ||
与对照组比较,模型组小鼠肝组织中T-SOD、GSH和MDA水平差异有统计学意义(P < 0.01);与模型组比较,DECB组和阳性药物组小鼠肝组织中T-SOD水平明显升高(P < 0.05),MDA和GSH水平明显降低(P < 0.05)。见表 2。
| (n=10, x±s) | |||
| Group | T-SOD [λB/(U·mg-1)] | GSH [wB/(mg·g-1)] | MDA [mB/(mmol·g-1)] |
| Control | 278.08±30.62 | 1.32±0.27 | 0.60±0.08 |
| Model | 164.41±63.57* | 4.18±1.99* | 1.24±0.64* |
| DECB | 247.41±37.89△ | 1.21±0.45△ | 0.56±0.22△ |
| Positive drug | 254.60±43.12△ | 1.01±0.13△ | 0.45±0.14△ |
| *P < 0.05 vs control group;△P < 0.05 vs model group. | |||
对照组小鼠肝组织中肝细胞排列整齐,核仁清晰,肝细胞内胞浆丰富,呈红色,细胞核呈圆形,核内染色质呈现蓝色,肝窦大小正常,肝脏无异常病理改变;模型组小鼠肝组织中肝细胞损伤明显, 肝细胞明显肿胀,胞核大小不等,呈不同程度的固缩,可见肝索紊乱、胞质疏松,肝细胞呈现不同程度的变性改变,大量肝细胞表现为脂肪变性,细胞浆疏松呈网状结构,呈现淡红色,胞质内可见大小不一的脂滴空泡,可见淋巴细胞浸润,未见明显肝纤维化改变;DECB组和阳性药物组小鼠肝组织中可见散在水样变性细胞和脂滴空泡,程度较模型组明显减少,细胞轻度肿大。见图 1(插页一)。

|
| A:Control group; B:Model group; C:DECB group; D:Positive group. 图 1 各组小鼠肝组织HE染色结果(×100) Figure 1 HE staining results of liver tissue of mice in various groups (×100) |
|
|
利用TUNEL检测试剂盒检测细胞凋亡,发生凋亡的胰岛细胞核呈棕黄色,未发生凋亡的胰岛细胞核呈蓝色。与对照组比较,模型组小鼠肝组织TUNUL染色阳性细胞数明显增多;与模型组比较,DECB组和阳性药物组小鼠肝组织TUNUL染色阳性细胞数明显减少。见图 2(插页一)。
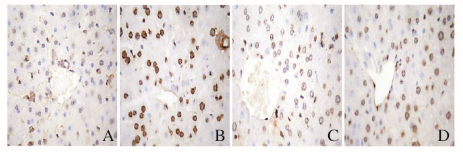
|
| A:Control group; B:Model group; C:DECB group; D:Positive group. 图 2 各组小鼠肝细胞TUNEL染色结果(×400) Figure 2 TUNEL staining results of liver cells of mice in various groups (×400) |
|
|
CCl4肝损伤模型是肝损伤的经典模型,常用来研究保肝、护肝药物的药效及其作用机制。CCl4在肝微粒体细胞色素P450激活下生成自由基,后者与肝细胞内大分子发生共价结合,攻击膜下不饱和脂质,引起脂质过氧化,从而产生脂质过氧化物(LPO),LPO及其降解产物可以损伤各种生物膜,使细胞膜稳定性和完整性降低、通透性增加,细胞质内ALT和AST等酶溢出,大量进入血液[6-7],因此测定血清中ALT和AST活性成为评价肝损伤的重要指标。本研究中DECB组小鼠血清中ALT和AST活性与模型组比较明显降低,说明其对CCl4致小鼠急性肝损伤具有一定保护作用。同时,CCl4在肝内代谢产生自由基,攻击细胞膜结构的磷脂分子中不饱合脂肪酸产生脂质过氧化物,后者代谢的终产物MDA可以反映机体内氧化反应程度,也可作为损害因子引起细胞的损伤[7-8]。SOD是细胞内主要的防御性抗氧化酶,能够清除自由基,减轻脂质过氧化链式反应,保护各种生物膜的结构稳定与功能完整。MDA和SOD水平可间接反映机体氧自由基的高低,而GSH水平可反映机体抗氧化能力[9-11]。本实验结果显示:与模型组比较,DECB给药组小鼠肝组织中SOD水平明显升高,MDA和GSH水平明显降低,表明DECB具有增强肝脏抗氧化能力、减少脂质过氧化物生成的作用。
本研究病理学结果显示:CCl4诱导的急性肝损伤模型小鼠肝细胞损伤明显,并出现明显的肝细胞凋亡,给予DECB治疗后肝细胞损伤程度明显减轻,凋亡细胞明显减少。凋亡是肝细胞对各种损伤因子作用的第一个细胞反应[12-15],因此这种高活性的DECB对CCl4诱导急性肝损伤具有保护作用,其机制可能是通过降低肝组织氧化应激水平,增强肝脏抗氧化能力,抑制肝细胞凋亡实现的。
| [1] | Gimson AE. Fulminant and late onset hepatic failure[J]. Br J Anaesth, 1996, 77(1): 90–98. DOI:10.1093/bja/77.1.90 |
| [2] | Lee M. Effect of a deproteinized calf blood extract on experimental periapical lesions[J]. Nihon Univ J Oral Sci, 1985, 11(2): 90–105. |
| [3] | 安保国, 李增欣, 王云, 等. 小牛血去蛋白提取物注射液治疗慢性乙型肝炎的临床疗效[J]. 中国医师杂志, 2003, 5(2): 263–265. |
| [4] | 陈继革, 宋先舟, 陈玲. 奥德金对实验性外伤性小鼠肝脏的保护作用[J]. 中西医结合肝病杂志, 2004, 14(4): 222–224. |
| [5] | 北华大学.小牛血去蛋白提取物及制备工艺:中国, 201210434370.7[P].2013-02-06. |
| [6] | Huang X, Wang X, Lv Y, et al. Protection effect of kallistatin on carbon tetrachloride-induced liver fibrosis in rats via antioxidative stress[J]. PLoS One, 2014, 9(2): e88498. DOI:10.1371/journal.pone.0088498 |
| [7] | Hsieh CW, Ko WC, Ho WJ, et al. Antioxidant and hepatoprotective effects of Ajuga nipponensis extract by ultrasonic-assisted extraction[J]. Asian Pac J Trop Med, 2016, 9(5): 420–425. DOI:10.1016/j.apjtm.2016.03.029 |
| [8] | Domitrovic R, Jakovac H, Vasiljev Marchesi V, et al. Differential hepatoprotective mechanisms of rutin and quercetin in CCl4-intoxicated BALB/cN mice[J]. Acta Pharmacol Sin, 2012, 33(10): 1260–1270. DOI:10.1038/aps.2012.62 |
| [9] | Mohammed A, Abd Al Haleem EN, El-Bakly WM, et al. Deferoxamine alleviates liver fibrosis induced by CCl4 in rats[J]. Clin Exp Pharmacol Physiol, 2016, 43(8): 760–768. DOI:10.1111/cep.2016.43.issue-8 |
| [10] | Tipoe GL, Leung TM, Liong EC, et al. Epigallocatechin-3-gallate (EGCG) reduces liver inflammation, oxidative stress and fibrosis in carbon tetrachloride (CCl4)-induced liver injury in mice[J]. Toxicology, 2010, 273(1-3): 45–52. DOI:10.1016/j.tox.2010.04.014 |
| [11] | Son G, Iimuro Y, Seki E, et al. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 293(3): G631–G639. DOI:10.1152/ajpgi.00185.2007 |
| [12] | Alsheblak MM, Elsherbiny NM, El-Karef A, et al. Protective effects of L-carnosine on CCl4-induced hepatic injury in rats[J]. Eur Cytokine Netw, 2016, 27(1): 6–15. |
| [13] | Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134(6): 1655–1669. DOI:10.1053/j.gastro.2008.03.003 |
| [14] | Weiskirchen R, Tacke F. Liver fibrosis:From pathogenesis to novel therapies[J]. Dig Dis, 2016, 34(4): 410–422. DOI:10.1159/000444556 |
| [15] | 童方念, 罗超, 罗丹, 等. 山奈酚对四氯化碳致小鼠急性肝损伤的保护作用[J]. 西安交通大学学报:医学版, 2014, 35(6): 816–819. |
 2017, Vol. 43
2017, Vol. 43


