扩展功能
文章信息
- 黄晓巍, 王艳玲, 李哲, 陶贵斌, 张天柱, 李朝政, 徐岩, 刘玥欣, 张丹丹, 曲晓波
- HUANG Xiaowei, WANG Yanling, LI Zhe, TAO Guibin, ZHANG Tianzhu, LI Chaozheng, XU Yan, LIU Yuexin, ZHANG Dandan, QU Xiaobo
- 鹿茸多肽对冈田酸致大鼠海马神经元损伤时Tau、Bcl-2和Caspase-3表达的影响
- Influence of pilose antler polypeptides on expressions of Tau, Bcl-2 and Caspase-3 in rat HT22 cells injured by okada acid
- 吉林大学学报(医学版), 2017, 43(01): 26-31
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 26-31
- 10.13481/j.1671-587x.20170106
-
文章历史
- 收稿日期: 2016-09-17
2. 吉林大学基础医学院病原免疫细胞遗传学实验中心, 吉林 长春 130021
2. Department of Experimental Cencer of Pathogenobiology, Immunology, Cytobiology and Genetics, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
鹿茸为鹿科动物梅花鹿(Cervus Nippon Temminck)或马鹿(Cervus elaphus Linnaeus)的雄鹿未骨化密生茸毛的幼角,首载于《本草纲目》:善于补肾壮阳、生精益血、补髓健骨[1]。研究[2]表明:鹿茸水提液可以在一定程度上促进细胞增殖。鹿茸水提物中含有诸如鹿茸多肽(pilose antler polypeptides,PAP)、神经生长因子、表皮生长因子和胰岛素样生长因子等诸多细胞生长因子[3],其中鹿茸多肽可明显促进周围神经组织以及骨组织的修复[4]。HT22细胞系是小鼠海马神经元细胞系,来自于HT4细胞,正常状态下贴壁生长,普通DMEM培养基加上血清及双抗即可培养,是体外研究神经退化性疾病的常用细胞系。HT22细胞是可以较理想地模拟与海马神经元相关疾病的体外细胞模型,广泛地应用于与神经元相关的疾病研究。
冈田酸(okadaic acid,OA)为磷酸酯酶抑制剂,对蛋白磷酸酯酶2A (protein phosphatase 2A, PP2A)和蛋白磷酸酯酶1(PP1)有选择性抑制作用。体外研究[5]表明:冈田酸能使神经元微管相关蛋白Tau过度磷酸化,通常用于建立Tau蛋白过度磷酸化的模型,冈田酸可以加快体内磷酸化-去磷酸化速率,导致脑组织β淀粉样蛋白沉积和Tau蛋白磷酸化,使神经元变性、突触损失和记忆障碍,引起认知功能障碍。因此,冈田酸可以用来作为实验工具研究神经变性的机制和阿尔茨海默病(Alzheimer’ s disease, AD)的病理研究靶标。本研究在前期工作的基础上,观察鹿茸多肽对冈田酸所致大鼠HT22细胞损伤模型Tau、Bcl-2和Caspase-3表达的影响,探讨鹿茸多肽对神经细胞损伤的保护机制。
1 材料与方法 1.1 实验药品及主要试剂鹿茸多肽:长春中医药大学制备,每1 g含生药量28.7 g。HT22细胞:上海亨代劳生物仪器有限公司,批号:37340-57-1。冈田酸、硫堇、DMSO、抗Tau蛋白抗体、PVDF膜、HRP-二抗、Trizol试剂、Taq DNA聚合酶和琼脂糖(上海源叶生物科技有限公司,批号:S30686、S19221、24295、Bs-4563R、H22092、Bs-0293p-HRP、R21086-10、S10118-10和S14003-10),Bcl-2抗体、Caspase-3抗体、ECL试剂和逆转录试剂盒(上海江莱生物科技有限公司,批号:bs-4563R、bs-0081R、KB9537和KB0283),引物(上海纳昂生物科技,批号:IDT)。
1.2 HT22细胞培养HT22细胞复苏后,每3d换液1次,每次更换50%新鲜培养液。倒置显微镜下观察。2h后,HT22开始贴壁,4h后完全贴壁伸展,随着培养时间的延长,细胞伸出较多的轴突和树突,有的相互连接交织成网状,体外培养的HT22在培养7d后发育成熟。
1.3 染色鉴定取48孔板,每孔放无菌盖玻片1块,用1%多聚赖氨酸室温包被3h,用无菌PBS洗3次;将生长状态良好的HT22细胞用胰酶消化后,制成细胞悬液,调节细胞浓度为1×105 mL-1,接种在涂有多聚赖氨酸的盖玻片上,每孔接种0.5 mL;待细胞爬片生长约7d,将爬满细胞的盖玻片用0.01 mol·L-1PBS漂洗3次,每次5 min。弃去洗液,用冷丙酮固定细胞10 min;用0.01 mol·L-1 PBS漂洗3×5 min。滴加硫堇染液1滴,室温下3~5 min;酒精脱水,光镜下控制时间,二甲苯透明,中性树胶封片。光镜下观察拍照并记录结果。
1.4 冈田酸细胞损伤模型的建立及分组将传代培养状态良好、呈对数生长的HT22细胞用胰酶消化后,加入含10%FCS的DMEM制成细胞悬液。将细胞浓度调节为1×106 mL-1,接种到50 mL细胞瓶中,每瓶3 mL,置于5%CO2、37℃培养箱中培养过夜;弃去培养液,每瓶先加含10%FCS的DMEM完全培养液2 mL,按各组条件分别加不同的条件培养液2mL。实验分为6组,每组设6个复孔。①正常对照组:HT22细胞加入等体积的培养液;②DMSO对照组:加入含DMSO终浓度为0.01%的培养液;③冈田酸损伤模型组:加入含终浓度为0.01%冈田酸的10%DMSO,终浓度为10 nmol·L-1;④50 mg·L-1鹿茸多肽组:加入含冈田酸(终浓度10 nmol·L-1)和50 mg·L-1鹿茸多肽的培养液;⑤500mg·L-1鹿茸多肽组:加入含冈田酸(终浓度10 nmol·L-1)和500 mg·L-1鹿茸多肽的培养液;⑥1000 mg·L-1鹿茸多肽组:加入含冈田酸(终浓度10 nmol·L-1)和1000mg·L-1鹿茸多肽的培养液。置于5% CO2、37℃培养箱中共同孵育24h。收集细胞用于相关指标检测。
1.5 Tau蛋白的免疫细胞化学染色分析各组细胞置于5% CO2、37℃培养箱中共同孵育24h后,取出长满细胞的盖玻片,0.01 mol·L-1 PBS漂洗3次,每次5 min,冷丙酮固定15 min;滴加0.2%的TritonX-100,室温下透化细胞10 min;滴加0.5%的H2O2-甲醇室温下封闭30 min,PBS漂洗3次,每次5 min;滴加山羊血清,室温孵育封闭60 min;滴加Tau蛋白一抗抗体液,阴性对照组用PBS代替,4℃孵育过夜后,PBS漂洗3次,每次5 min;滴加HRP酶标记的二抗工作液,室温孵育60 min,PBS漂洗3次,每次5 min;加新配制的底物DAB溶液室温下显色10 min,用蒸馏水冲洗终止显色反应;滴加苏木精染液室温下复染30s后,梯度酒精脱水干燥,二甲苯透明,中性树胶封片,生物光镜下观察。
1.6 Western blotting法检测HT22细胞中Tau、Bcl-2和Caspase-3蛋白表达水平将HT22条件培养细胞,PBS洗3次,每孔加入40μL RIP细胞裂解液制成细胞溶解液;采用BCA蛋白定量试剂盒对样品进行蛋白定量,调节蛋白浓度为2 g·L-1;将蛋白样品与等体积2×样品缓冲液混合后,100℃水浴5 min后即刻放入冰浴中冷却;将样品加到SDS-PAGE胶的加样孔内,每孔加样20 μL,100V电泳分离约1h;电泳结束后,采用半干式转膜仪,恒流2mA·cm-2转膜100 min;将转有蛋白的PVDF膜置于10 mL封闭液中,37℃封闭1 h;将膜放到含有一抗(1:1000)的反应液中,37℃特异性结合反应1h;TBS-T洗膜3次,每次10 min。加HRP标记二抗(1:2000),室温2h;TBS-T洗膜3次,每次10 min。加ECL发光液,室温孵育膜1 min。将膜正面朝上放到免疫印迹仪内,拍照、记录结果。对电泳条带进行灰度值扫描,对各目的蛋白进行半定量分析。以目的条带与内参照的吸光度(A)比值表示目的蛋白的相对表达水平。
1.7 RT-PCR法检测HT22细胞中Tau、Bcl-2和Caspase-3 mRNA表达水平提取细胞总RNA (total RNA):取条件培养细胞沉淀约100 mg,加入Trizol试剂1.0 mL,充分混合,室温下孵育5 min;加入氯仿200 μL,剧烈振荡30s,室温静置10 min。4℃、12000 r·min-1离心15 min;吸取400 μL上清液移至新的RNAse-free 1.5 mL离心管中,再加入400 μL异丙醇上下颠倒混匀,室温下静置10 min;4℃、12000 r·min-1离心10 min,弃上清,用700 μL 75%乙醇洗涤沉淀3次。4℃、7500 g离心10 min,弃上清保留沉淀,室温干燥10 min后,溶解于50 μL DEPC水中,用于逆转录反应。将提取的总RNA逆转录为cDNA,按照AMV Reverse transcriptase逆转录试剂盒操作规程逆转录合成cDNA第一链。20 μL反应体系:5×RT Buffer 4 μL,dNTP Mixture (10mmol·L-1) 2 μL,Oligo-dT 1 μL,RNase inhibitor (40U·μL-1) 1 μL, AMV Reverse Transcriptase (5U·μL-1) 1 μL,总RNA4 μL,RNA free H2O 7.0 μL;反应条件:60℃、45 min,95℃、5 min,冰浴5 min,-20℃条件下保存备用。以cDNA链作为模板,进行PCR扩增反应,25 μL反应体系:模板cDNA 1 μL,上游引物1 μL,下游引物1 μL,2×Taq PCR Master Mix12.5 μL,RNA free H2O 9.5 μL;反应条件:94℃预变性5 min,94℃变性30s,61℃退火30s,72℃延伸2 min,30个循环扩增反应后,72℃、10 min,4℃保存。Bcl-2基因引物:正义链为5′-TGGGATACTGGAGATGAAGACT-3′,反义链为5′-CCACCGAACTCAAAGAAGG-3′(268 bp);Caspase-3基因引物,正义链为5′-TGCTT ACTCTACCGCACCCG-3′,反义链为5′-AACATGCCCCTACCCCACTC-3′(218 bp);Tau引物,正义链为5′-GTTACCAGGGCTGCCTTC-3′,反义链为5′-CCCTTCAGGTGAGCCCCA-3′(353 bp);β-actin1引物:正义链为5′-ATCATGTTTGAGACCTTCAA-3′,反义链为5′-GCATGAGGGAGCGCGTAACC-3′(520 bp);β-actin2引物:正义链为5′-ATCATGTTTGAGACCTTCAA-3′,反义链为5′-CTCGAAGT-CTAGGGCAACAT-3′(436 bp)。
取5 μLPCR反应产物加入1 μL 6×Loading Buffer混匀,1.5%琼脂糖凝胶电泳检测,电压90V,凝胶成像系统观察、拍照,记录结果。Quantity One软件分析目的条带灰度,以目的条带与β-actin比值表示mRNA表达水平。
1.8 统计学分析采用SPSS13.0软件进行统计学处理。Tau、Bcl-2和Caspase-3蛋白及mRNA表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 免疫细胞化学染色分析Tau蛋白表达免疫细胞化学染色结果显示:磷酸化Tau蛋白的表达呈棕黄色颗粒,与正常对照组比较,冈田酸损伤模型组HT22细胞胞体及突起中磷酸化Tau蛋白的表达明显增加;与冈田酸损伤模型组比较,500和1000 mg·L-1鹿茸多肽组细胞胞体和突起的Tau蛋白表达程度下降。见图 1(插页一)。
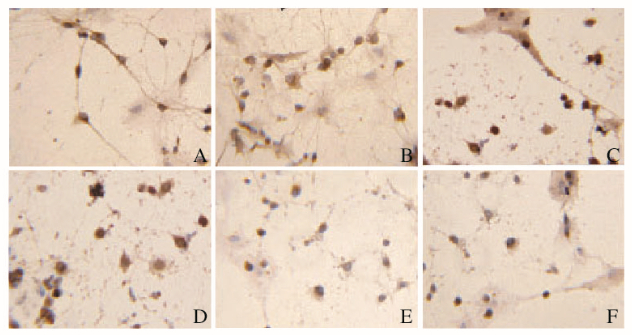
|
| A:Normal control group;B:DMSO control group;C:Okada acid injury model group;D:50 mg·L-1PAP group;E:500 mg·L-1PAP group;F:1 000 mg·L-1PAP group. 图 1 各组HT22细胞中Tau蛋白免疫细胞化学染色结果(×200) Figure 1 Results of immunocytochemistry of Tau proteinin HT22 cells (×200) |
|
|
与正常对照组比较,冈田酸损伤模型组HT22细胞中Tau蛋白表达水平明显升高(P < 0.05),Bcl-2和Caspase-3蛋白表达水平均未见明显变化(P>0.05);与冈田酸损伤模型组比较,各浓度鹿茸多肽组HT22细胞中Tau蛋白表达水平明显降低(P < 0.05或P < 0.01),1000 mg·L-1鹿茸多肽组细胞中Bcl-2蛋白表达水平升高(P < 0.05),各浓度鹿茸多肽组HT22细胞中Caspase-3蛋白表达水平均未见明显变化(P>0.05)。见图 2和表 1。
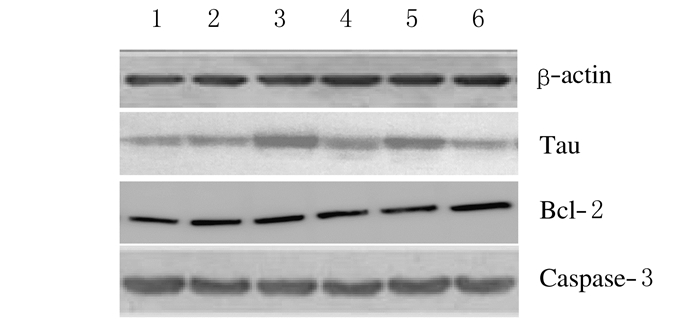
|
| Lane1:Normal control group;Lane2:DMSO control group;Lane3:Okada acid injury model group; Lane 4-6:50, 500, and 1000 mg·L-1 PAP group. 图 2 Western blotting法检测各组HT22细胞中Tau、Bcl-2和Caspase-3蛋白表达电泳图 Figure 2 Electrophoregram of expressions of Tau, Bcl-2, and Caspase-3 protein in HT22 cells in various groups detected by Western blotting method |
|
|
| (n=6, x±s) | |||
| Group | Tau | Bcl-2 | Caspase-3 |
| Normal control | 0.761±0.021 | 0.535±0.013 | 2.521±0.026 |
| DMSO control | 0.773±0.015 | 0.551±0.023 | 2.313±0.019 |
| Okada acid injury | 1.712±0.029* | 0.566±0.018 | 2.432±0.015 |
| PAP (mg·L-1) | |||
| 50 | 0.946±0.017△△ | 0.587±0.035 | 2.281±0.033 |
| 500 | 1.322±0.024△ | 0.544±0.028 | 2.477±0.038 |
| 1000 | 0.764±0.033△△ | 0.733±0.036△ | 2.311±0.032 |
| *P < 0.01 compared with normal control group;△P < 0.05,△△P < 0.01 compared with okada acid injury model group. | |||
与正常对照组比较,冈田酸损伤模型组细胞Tau和Caspase-3 mRNA表达水平明显升高(P < 0.05或P < 0.01),Bcl-2 mRNA表达水平明显降低(P < 0.01);与冈田酸损伤模型组比较,各浓度鹿茸多肽组HT22细胞中Tau mRNA表达水平明显降低(P < 0.05或P < 0.01),Bcl-2 mRNA表达水平明显升高(P < 0.05或P < 0.01),500和1 000 mg·L-1鹿茸多肽组Caspase-3 mRNA表达水平明显降低(P < 0.05或P < 0.01)。见图 3和表 2。
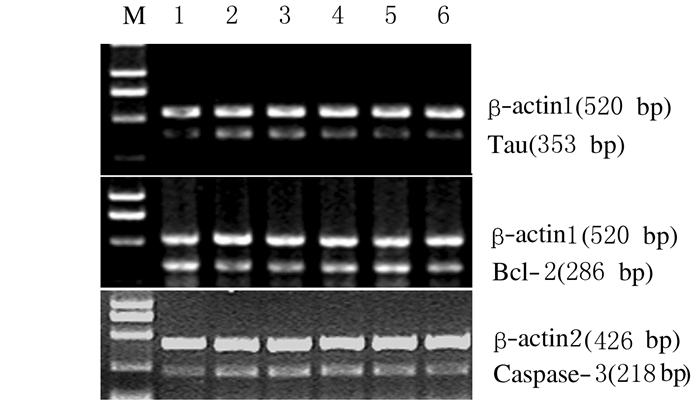
|
| M:DNA marker;Lane1:Normal control group;Lane2:DMSO control group;Lane3:Okada acid injury model group;Lane4-6:50, 500,and 1000 mg·L-1 PAP group. 图 3 RT-PCR法检测各组HT22细胞中Tau、Bcl-2和Caspase-3 mRNA表达电泳图 Figure 3 Electrophoregram of expressions of Tau, Bcl-2, and Caspase-3 mRNA in HT22 cells in various groups detected by RT-PCR |
|
|
| (n=6, x±s) | |||
| Group | Tau mRNA | Bcl-2 mRNA | Caspase-3 mRNA |
| Normal control | 0.108±0.021 | 0.815±0.015 | 0.511±0.024 |
| DMSO control | 0.571±0.027 | 0.561±0.025 | 0.528±0.019 |
| Okada acid injury | 0.492±0.022** | 0.415±0.023** | 0.656±0.028* |
| PAP (mg·L-1) | |||
| 50 | 0.349±0.031△ | 0.698±0.024△△ | 0.663±0.032 |
| 500 | 0.248±0.024△△ | 0.805±0.021△△ | 0.556±0.035△ |
| 1 000 | 0.227±0.018△△ | 0.526±0.037△ | 0.517±0.023△△ |
| P < 0.05,** P < 0.01 compared with normal control group;△P < 0.05,△△P < 0.01 compared with okada acid injury model group. | |||
AD是一种神经系统退行性疾病,又被称为老年痴呆症,其发病机制复杂,目前尚无有效治疗措施[6]。AD主要是由于大脑皮层高级神经功能严重障碍,造成认知功能低下。任何因素导致大脑皮层结构和功能损伤,都会造成脑组织合成与分解代谢障碍,毒素清除能力下降,神经递质发生质或量的改变,使脑内神经元间信息传递异常,导致认知功能障碍。目前公认AD的发病机制主要有以下几种学说:基因学说、胆碱能学说、传染学说、铝中毒学说、自由基学说、炎症学说、钙超载学说和代谢紊乱学说等。AD的主要病理特征是大脑萎缩,神经细胞外以β淀粉样蛋白(Aβ)沉积为核心形成老年斑(SP),导致神经元纤维缠结和细胞死亡。神经细胞内以过磷酸化的Tau蛋白为核心形成神经元纤维缠结和神经元丢失。
神经元微管相关蛋白(Tau蛋白)过度磷酸化是AD发病的主要机制之一,Tau蛋白具有促进微管组装并维持神经元微管稳定的作用,由于神经元微管过度磷酸化可造成神经细胞骨架完整性及胞体和轴突物质转运障碍,导致神经纤维缠结和神经细胞死亡[7-8]。拮抗神经元微管的磷酸化,抑制Tau蛋白的产生已经成为AD药物研发的一个重要靶点[9-10]。
冈田酸是一种从海洋生物中获得的提取物,同时也是蛋白磷酸酯酶PP-2A与PP-1的抑制剂。其相关体外实验研究[11]报道:冈田酸能使神经元微管相关蛋白Tau过度磷酸化;而动物实验研究[12]也有相关报道:冈田酸致大鼠HT22细胞损伤的机制与AD的病理学表现极其相似,均与Aβ沉积诱发神经元变性、突触减少等因素有关。因此,冈田酸细胞损伤模型是神经系统退行性疾病的研究常用模型。
导致AD患者神经元丢失的另一主要原因是各种原因通过一定的酶促反应而启动的细胞凋亡过程。研究[13]表明:神经元的丢失机制与细胞凋亡密切相关,在细胞凋亡机制中,最重要的环节就是Bcl-2和Caspase-3对于细胞凋亡的调控。Bcl-2家族是目前最受重视的凋亡相关基因家族[14]。研究[15]显示:Bcl-2蛋白具有抑制凋亡的作用,其机制可能为Bcl-2通过抑制钙离子浓度、抗氧化作用、蛋白双重作用、线粒体中的离子通道等方面来抑制细胞凋亡。Caspase-3是一种蛋白酶,其在细胞凋亡过程中发挥着重要作用,在启动凋亡程序中起到了最后的枢纽作用[16-17]。
本研究通过体外培养HT22细胞,建立冈田酸细胞损伤模型,采用分子生物学方法,观察了鹿茸多肽对冈田酸诱导细胞损伤模型细胞Tau蛋白及细胞凋亡相关因子Bcl-2和Caspase-3表达的影响,结果表明:鹿茸多肽对冈田酸诱导细胞损伤模型神经元Tau蛋白水平的升高有明显的抑制作用,提示鹿茸多肽可能通过抑制神经元微管相关蛋白过度磷酸化对神经细胞起一定的保护作用;鹿茸多肽在HT22细胞体外培养条件下能提高冈田酸诱导细胞损伤模型细胞Bcl-2的表达水平,降低Caspase-3表达水平,表明鹿茸多肽可能通过抵制细胞凋亡调途径对神经细胞损伤起保护作用,其相关机制和路径还有待于进一步深入研究。
| [1] | 国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社,2015: 323. |
| [2] | 吴帆, 董玲, 王春梅, 等. 不同部位鹿茸水提液对NRK-49F细胞促增殖作用的研究[J]. 世界科学技术-中医药现代化, 2014, 16(7): 1537–1541. |
| [3] | Gilbev A, Perezgonzalez JD. Health benefits of deer and elk velvet antler supplements:a systematic review of randomised controlled studies[J]. N Z Med J, 2012, 125(1367): 80–86. |
| [4] | 朱文赫, 李亚巍, 沈楠, 等. 不同交联方法制备的鹿茸多肽-胶原蛋白/壳聚糖复合材料对成骨细胞增殖的影响[J]. 中国实验方剂学杂志, 2014, 20(14): 5–8. |
| [5] | 李永坤, 陈晓春, 朱元贵, 等. 冈田酸诱导大鼠海马神经元Tau蛋白过度磷酸化[J]. 解剖学报, 2005, 36(3): 231–236. |
| [6] | 刘楠, 冯春生, 朴美花, 等. 异氟醚对转APP基因小鼠脑内海马神经元蛋白质损伤和蛋白聚集的影响[J]. 吉林大学学报:医学版, 2016, 42(4): 665–669. |
| [7] | Jensen JR, Cisek K, Funk KE, et al. Research towards tau imaging[J]. J Alzheimers Dis, 2011, 26(Suppl 3): 147–157. |
| [8] | Tanzi RE, Bertram L. Twenty years of the Alzheimer's disease amyloid hypothesis:A genetic perspective[J]. Cell, 2005, 120(4): 545–555. DOI:10.1016/j.cell.2005.02.008 |
| [9] | 李静, 王涛, 沈玉君, 等. MANF对神经细胞中tau蛋白过度磷酸化的抑制作用[J]. 中国药理学通报, 2012, 28(8): 1111–1115. |
| [10] | Mandelkow E. Alzheimer's disease.The tangled tale of tau[J]. Nature, 1999, 402(6762): 588–589. DOI:10.1038/45095 |
| [11] | 褚燕琦, 张兰, 李玮, 等. 人参皂苷对蛋白磷酸酶抑制剂冈田酸拟阿尔采末病细胞模型的影响[J]. 中国药理学通报, 2008, 24(7): 879–884. |
| [12] | 白鹏, 彭晓明, 高莉, 等. 类叶升麻苷对冈田酸诱导的阿尔茨海默病细胞模型的保护作用研究[J]. 中国中药杂志, 2013, 38(9): 1323–1326. |
| [13] | 陈雪, 孙婧霞, 蒋常文. Bcl-2、Caspase-3与阿尔茨海默病关系的研究进展[J]. 临床医学工程, 2013, 20(9): 1177–1179. |
| [14] | 李伟, 吴刚, 薛荣亮. Bcl-2过度表达对全脑缺血再灌注后大鼠海马回P53蛋白表达的影响[J]. 吉林大学学报:医学版, 2012, 38(2): 175–179. |
| [15] | Sperling RA, Aisen PS, Beckctt LA, et al. Toward defining the preclinical stages of Alzheimer's disease:recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J]. Alzheimers Dcmcnt, 2011, 7(3): 280–292. DOI:10.1016/j.jalz.2011.03.003 |
| [16] | 王树华. 叶酸、VitaminB12与血管性痴呆[J]. 卒中与神经疾病, 2005, 12(5): 311–313. |
| [17] | 金小小, 张淑玲, 徐黎娟, 等. CIC-3在SIN-1诱导的大鼠海马神经元凋亡中的作用[J]. 郑州大学学报:医学版, 2014, 49(3): 315–318. |
 2017, Vol. 43
2017, Vol. 43


