扩展功能
文章信息
- 王治国, 刘学明, 佟胜全, 石哲群, 饶莉
- WANG Zhiguo, LIU Xueming, TONG Shengquan, SHI Zhequn, RAO Li
- 骨髓间充质干细胞移植对大鼠肺动脉高压的治疗作用
- Therapeutic effect of mesenchymal stem cell transplantation on pulmonary hypertension in rats
- 吉林大学学报(医学版), 2017, 43(01): 21-25
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 21-25
- 10.13481/j.1671-587x.20170105
-
文章历史
- 收稿日期: 2016-06-17
2. 河北医科大学附属唐山工人医院神经内科, 河北 唐山 063000
2. Department of Neurology, Tangshan Worker's Hospital, Hebei Medical University, Tangshan 063000, China
干细胞是存在于哺乳动物体内的一类具有强大分裂分化能力的细胞。目前使用最多的也是最早发现的干细胞是骨髓间充质干细胞(mesenchymal stem cells, MSCs)[1]。干细胞治疗是具有临床应用前景的重要治疗手段之一[2]。肺动脉高压是一种临床上较难治疗的疾病,主要表现为肺动脉的压力升高,不断冲击右心室,最终导致右心室心力衰竭而死亡[3]。肺动脉高压的致病因素较多,目前尚未明确。肺动脉高压发病初期表现为肺血管的扩张和血管收缩的不平衡。除此之外,有研究[4-5]显示:一氧化氮(nitric oxide, NO)等血管松弛因子在肺动脉高压的发生发展过程中起重要作用。
目前对于肺动脉高压的治疗主要是多种疗法同时进行,包括增氧和对疾病产生的一些症状进行对症治疗等。而药物治疗则是通过环前列腺素、磷酸二酯酶抑制剂和内皮素受体拮抗剂进行治疗。这些疗法虽然效果明确,但不良反应严重且对疾病病程没有显著性的影响。因此,寻找新的可以长期缓解肺动脉高压的治疗方案尤为重要[6]。本文作者通过腹主动脉-下腔静脉分流法建立肺动脉高压大鼠模型[7],并分离MSCs对模型大鼠进行治疗,通过检测大鼠心脏功能变化、氧化应激指标和炎症指标来探讨MSCs对肺动脉高压的治疗作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器雄性SD大鼠8只,SPF级,4~5周龄,体质量80~100 g,用于制备MSCs;雄性SD大鼠40只,SPF级,6~8周龄,体质量180~220g。所有大鼠均购自河北省实验动物中心,动物合格证号:SCXK (冀)2008-1-003,在光照和黑暗各12 h交替环境中标准饲养,所有实验大鼠符合卫生部一级动物标准,得到动物伦理学委员会批准。DMEM培养基(美国Hyclone公司),胰蛋白酶(美国Sigma公司),胎牛血清(西安四季生物科技有限公司),CD44、CD90、CD105和CD45荧光标记抗体(美国Invitrogen公司),NO及NADPH氧化酶试剂盒(南京建成生物科技有限公司),TNF-α Elisa试剂盒(武汉华美生物科技有限公司),Q-PCR实验试剂(美国Qiagen公司),其余化学试剂均为国产分析纯(天津大茂化学试剂厂等)。超净工作台(苏净安泰仪器设备有限公司),流式细胞仪(美国BD公司),TGL-16C离心机(湖南湘仪仪器厂),pH计(美国Thermo Scientific公司),37℃恒温CO2孵箱(美国Thermo Scientific公司),冻存管、培养瓶和培养板(美国Corning公司)。
1.2 MSCs的分离与鉴定将8只幼年大鼠处死,消毒后转移入超净台内。分离大鼠股骨与胫骨。使用无菌PBS冲洗大鼠股骨与胫骨的骨髓腔,得到少量混合液。1 000 r·min-1离心10 min得到细胞,弃上清后使用含有10%胎牛血清的低糖DMEM培养基重悬细胞,接种于培养瓶中。待细胞贴壁生长后,冲洗掉未黏附的细胞。待培养液稍微变黄后及时更换培养液。细胞生长至80%瓶底后,传代细胞。培养3代后,细胞的生长密度及状态适合用于实验。
选择第3代贴壁细胞进行细胞鉴定,使用PBS冲洗细胞去除死亡及不干净的细胞后,胰蛋白酶消化细胞,1 000 r·min-1离心5 min收集细胞,加入CD44、CD90、CD105和CD45抗体进行染色。流式细胞仪鉴定细胞。
1.3 实验动物分组及模型制备将40只大鼠随机分为2组:对照组10只,手术组30只。手术组大鼠经3%戊巴比妥麻醉后,腹部正中切口暴露腹腔。使用棉签充分暴露大鼠腹腔腹主动脉及下腔静脉。用加热的针头灼伤腹主动脉附近的髋动脉、髋静脉及连接脊柱的几根动脉。结扎左肾动脉起始部及髋动脉上方并于左肾动脉下方三分之二处造瘘后使用细管连接该动脉与相邻的下腔静脉。导管事先使用肝素钠抗凝。手术时间控制在2 h内。最后缝合腹部伤口,涂抗生素预防感染。8周后,手术组大鼠死亡3只,剩余大鼠随机分为模型组、低剂量MSCs组(3×105个MSCs,MSCL)和高剂量MSCs组(6×105个MSCs,MSCH),采用戊巴比妥麻醉后,MSCL和MSCH组大鼠分别从舌下静脉注射相应剂量MSCs,模型组大鼠注射等量的生理盐水。
1.4 测定各组大鼠右心室收缩压(RVSP)、平均右室压(MRVP)和肺动脉压(MPAP)待注射MSCs 6周后,采用戊巴比妥钠腹腔注射麻醉大鼠。分离颈总动脉,远心端结扎颈总动脉。取一根3F导管,先使用肝素溶液充满管腔后沿着动脉插入,使用线栓固定导管,另一端连接三通头,用于排除气泡和关闭外界联系。采用同样方法,使用另外一根3F导管插入肺动脉中,用于接收肺部的压力变化。压力感受器与Powerlab生理多功能记录系统相连接,记录各组大鼠RVSP、MRVP和MPAP。
1.5 检测各组大鼠血清及肺组织中NO和肿瘤坏死因子α(TNF-α)水平大鼠心脏指标检测完成后,颈总动脉取血,3 000 r·min-1离心5 min分离血清,用于检测NO及TNF-α水平。取血后,分离右心室称质量计算右心室指数(VDI)。取部分肺组织匀浆取上清,BCA蛋白定量后测定肺组织中NO及TNF-α水平。
1.6 Q-PCR法检测大鼠肺组织中NADPHmRNA表达水平[8]部分肺组织取出后置于Trizol内匀浆,按照试剂盒说明书提取RNA,逆转录成cDNA后,按说明书测定并计算NADPH mRNA表达水平。
1.7 大鼠肺组织形态观察待血液流变学指标测定完成后,处死大鼠,取出左侧肺叶置于多聚甲醛中固定4 d,HE染色,于显微镜下观察大鼠肺病理组织形态结构表现。
1.8 统计学分析采用SPSS21.0软件进行统计学处理。大鼠血清及肺组织中NO和TNF-α水平、肺组织中NADPH mRNA表达水平均以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 MSCs形态表现及鉴定将首次分离出来的细胞接种于培养瓶时,细胞多呈圆形。一段时间后,大多数细胞会贴壁,使用PBS冲洗细胞,可以筛除大部分的血细胞得到较纯的MSCs。及时换液可以保证细胞的正常生长。待细胞融合大于80%时,及时传代细胞,等待细胞传代至第3代后,可见较为明显的梭形细胞,密集生长成为集落装。鉴定结果:CD44、CD90和CD105细胞表型呈阳性表达,CD45细胞表型呈阴性表达。见图 1。
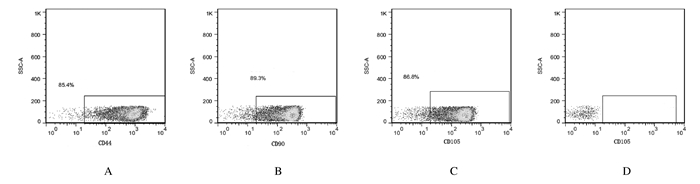
|
| A:CD44;B:CD90;C:CD105;D:CD45. 图 1 流式细胞术鉴定MSCs Figure 1 Identification of MSCs by flow cytometry |
|
|
与对照组比较,模型组大鼠VDI、RVSP、MRVP和MPAP明显增加(P < 0.05);与模型组比较,MSCH组大鼠VDI和RVSP明显下降(P < 0.05),MSCL和MSCH组大鼠MRVP和MPAP明显下降(P < 0.05)。见表 1。
| (x±s) | |||||
| Group | n | VDI | RVSP (P/mmH2O) | MRVP (P/mmH2O) | MPAP (P/mmH2O) |
| Control | 10 | 0.48±0.03 | 31.74±0.53 | 18.34±1.74 | 20.75±1.57 |
| Model | 9 | 0.62±0.05* | 60.38±3.75* | 47.73±3.07* | 44.23±2.75* |
| MSCL | 9 | 0.59±0.04 | 54.78±2.75 | 42.96±4.85△ | 33.85±2.64△ |
| MSCH | 9 | 0.51±0.04△ | 48.75±3.75△ | 33.74±3.74△ | 29.64±1.64△ |
| *P < 0.05 compared with control group; △P < 0.05 compared with model group. | |||||
与对照组比较,模型组大鼠血清及肺组织中NO和TNF-α水平明显升高(P < 0.01);与模型组比较,MSCH组大鼠血清中、MSCL组和MSCH组大鼠肺组织中NO和TNF-α水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (x±s) | ||||||
| Group | n | NO | TNF-α | |||
| Serum | Lung tissue | Serum | Lung tissue | |||
| Control | 10 | 12.74±1.29 | 45.78±4.86 | 0.72±0.01 | 1.73±0.14 | |
| Model | 9 | 18.43±3.21* | 66.83±6.32* | 0.98±0.02* | 2.57±0.21* | |
| MSCL | 9 | 16.99±2.12 | 52.87±2.19△△ | 0.90±0.18 | 2.12±0.22△△ | |
| MSCH | 9 | 15.32±1.09△ | 48.38±1.32△△ | 0.81±0.05△ | 1.87±0.04 △△ | |
| * P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. | ||||||
与对照组比较,模型组大鼠肺组织中NADPH mRNA表达水平明显升高(P < 0.01);与模型组比较,MSCH组大鼠肺组织中NADPH mRNA表达水平明显降低(P < 0.01)。见表 3。
| (x±s) | ||
| Group | n | NADPH mRNA |
| Control | 10 | 1.009±0.005 |
| Model | 9 | 1.402±0.013* |
| MSCL | 9 | 1.372±0.021 |
| MSCH | 9 | 1.210±0.018△ |
| *P < 0.01 compared with control group; △P < 0.01 compared with model group. | ||
对照组大鼠肺组织中肺小动脉壁的排列整齐清晰,有明显的层次结构;模型组大鼠肺组织结构紊乱,肺小动脉的管壁明显增厚,且有重叠紊乱的现象;与模型组比较,MSCL和MSCH组大鼠肺组织结构更为清晰,肺小动脉壁增厚和重叠紊乱等表现明显减轻。见图 2(插页一)。
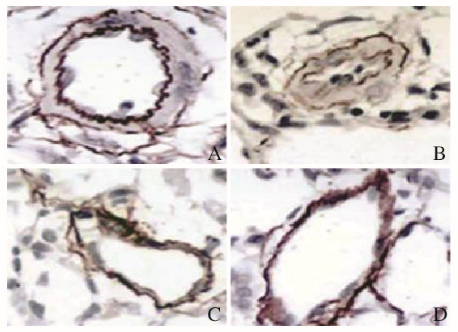
|
| A:Control group; B:Model group; C:MSCL group; D:MSCH group. 图 2 各组大鼠肺组织形态表现(HE, ×200) Figure 2 Morphology of lung tissue of rats in various groups (HE, ×200) |
|
|
肺动脉高压性病变是一种严重的致命的肺部疾病。目前肺动脉高压的发病机制尚不清楚[9]。传统疗法主要是针对肺动脉高压的症状进行治疗,使用治疗高血压病的方法对症治疗,采用扩张血管的方法,减轻肺部血压高的问题。肺动脉高压属于顽固性的病变,尽管保持服药可以有效地缓解病情[10],但是突发情况依然会导致其高致死率,因此寻找一种新的、可持续起效的治疗方案对控制该病的病情尤为重要[11]。
干细胞治疗法是一种利用人体自身干细胞的增殖分化能力对疾病进行治疗的方法,其中MSCs是最重要的一种[12]。有研究[13]证实:脐带血干细胞有治疗肺动脉高压的潜在作用,对肺动脉高压引起的某些疾病具有一定的治疗作用。
以往实验中大鼠的MSCs移植均为异体移植,因此过量的细胞会引起机体的免疫反应,从而破坏干细胞的生存[14]。因此,本实验初期,对MSCs治疗的量进行了多次预实验,确定低及高剂量MSC组MSCs最适合的注入量。本实验采用大鼠制备肺动脉高压模型,并采用较高难度的手术进行模拟,从增加血压的角度来建立的肺动脉高压模型,与疾病的发展过程有着较好的相似性[15]。该模型制备过程中,最重要的就是保暖、保湿和麻醉,除了转基因动物模型外,采用该种方法制备的动物损伤模型最符合疾病发展过程[16]。本研究结果表明:肺动脉高压病变中伴随有NADPH mRNA表达水平的增加,抑制该酶的表达可以抑制氧化应激水平,从而起到缓解病情的作用。
本研究采用腹主动脉-下腔静脉搭桥的方法制备动物模型同时应用MSCs治疗结果表明:MSCs可以通过改善大鼠氧化应激水平,减少炎症因子释放,抑制NADPH氧化酶,起到治疗肺动脉高压的作用。本研究结果为MSCs用于肺动脉高压的治疗提供了理论依据。
| [1] | Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893): 41–49. DOI:10.1038/nature00870 |
| [2] | Tian HJ, YangJP, WangXX. The effect of bone marrow mesenchymal stem cell transplantation on hypoxic pulmonary hypertension in rats[J]. Chin J Appl Physiol, 2014, 30(3): 233–236. |
| [3] | 陈果.肺动脉高压的临床研究[D].北京:北京协和医学院, 2014. |
| [4] | van der Laarse A, Cobbaert CM, Umar S. Stem and progenitor cell therapy for pulmonary arterial hypertension:effects on the right ventricle (2013 Grover Conference Series)[J]. Pulm Circ, 2015, 5(1): 73–80. DOI:10.1086/679701 |
| [5] | 谭如彬.肺动脉高压细胞治疗研究中骨髓间充质干细胞性别对疗效的影响及其机制[D].武汉:华中科技大学, 2013. |
| [6] | 张国富, 刘宏宇. 肺动脉高压治疗的进展[J]. 中国胸心血管外科临床杂志, 2015, 22(12): 1157–1162. |
| [7] | 吴文振, 郝恩魁, 程义伟, 等. 不同急性肺动脉高压模型的建立及其血流动力学转归的实验研究[J]. 山东大学学报:医学版, 2012, 50(3): 34–39. |
| [8] | 黄维佳, 覃家锦, 何巍, 等. NOX4在高肺血流肺动脉高压大鼠中表达的意义[J]. 微创医学, 2012, 7(4): 340–342. |
| [9] | 潘艳云.CD40/CD40L通路对内皮祖细胞功能的调控及在肺动脉高压中的应用[D].杭州:浙江大学, 2015. |
| [10] | Sun JH, Chen LX, Chen LF. Effects of ramipril on nitric oxide concentration and endothelial nitric oxide synthase activation in lung of rats with pulmonary arterial hypertension induced by monocrotaline[J]. Med J Chin PLA, 2009, 34(5): 583–586. |
| [11] | Chen JY, An R, Liu ZJ, et al. Therapeutic effects of mesenchymal stem cell-derived microvesicles on pulmonary arterial hypertension in rats[J]. Acta Pharmacol Sin, 2014, 35(9): 1121–1128. DOI:10.1038/aps.2014.61 |
| [12] | Benza RL, Park MH, Keogh A, et al. Management of pulmonary arterial hypertension with a focus on combination therapies[J]. J Heart Lung Transplant, 2007, 26(5): 437–446. DOI:10.1016/j.healun.2007.01.035 |
| [13] | Kim DH, Yoo KH, Choi KS, et al. Gene expression profile of cytokine and growth factor during differentiation of bone marrow-derived mesenchymal stem cell[J]. Cytokine, 2005, 31(2): 119–126. DOI:10.1016/j.cyto.2005.04.004 |
| [14] | Liu J, Han Z, Han Z, et al. Mesenchymal stem cell-conditioned media suppresses inflammation-associated overproliferation of pulmonary artery smooth muscle cells in a rat model of pulmonary hypertension[J]. Exp Ther Med, 2016, 11(2): 467–475. |
| [15] | Akca B, Erdil N, Disli OM, et al. Coronary bypass surgery in patients with pulmonary hypertension:assessment of early and long term results[J]. Ann Thorac Cardiovasc Surg, 2015, 21(3): 268–274. DOI:10.5761/atcs.oa.14-00227 |
| [16] | 郭丽萍.颈动-静脉分流法猪肺动脉高压模型左右心室形态及功能变化与肺动脉压的关系[D].南宁:广西医科大学, 2013. |
 2017, Vol. 43
2017, Vol. 43


