扩展功能
文章信息
- 邓海月, 于方, 姜红
- DENG Haiyue, YU Fang, JIANG Hong
- 直接肾素抑制剂阿利吉仑对肾纤维化小鼠上皮-间质转化的调节作用
- Regulatory effect of direct renin inhibitor aliskiren on epithelial-mesenchymal transition of renal fibrosis mice
- 吉林大学学报(医学版), 2017, 43(01): 16-20
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 16-20
- 10.13481/j.1671-587x.20170104
-
文章历史
- 收稿日期: 2016-03-05
上皮细胞向间质细胞(包括肌成纤维细胞)的转化(epithelial-mesenchymal transition, EMT)与肿瘤侵袭转移[1]、复发[2]和器官纤维化等疾病的病理过程有密切关联。有文献[3-4]报道:EMT在肾纤维化发生发展过程中也发挥着重要作用。越来越多调控EMT的分子作为治疗器官纤维化的新的靶点而被开发利用。阿利吉仑(aliskiren)是新一代非肽类口服直接肾素抑制剂,在2007年成为此类药物中第一个获得监管部门批准的治疗高血压的药品[5],具有抗高血压和心、肾保护作用。但阿利吉仑对单侧输尿管结扎引起的小鼠肾纤维化EMT的调节作用,至今尚未见相关文献报道。本研究拟通过单侧输尿管结扎制备小鼠肾纤维化的体内模型,并且体内给予阿利吉仑预处理,观察阿利吉仑是否通过调节上皮标志蛋白E钙黏蛋白(E-cadherin, E-cad)和间质标记蛋白α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达,进而抑制Ⅰ型胶原(type Ⅰ collagen, Col Ⅰ)的表达而发挥抗EMT作用,阐明阿利吉仑抗肾纤维化的可能作用机制。
1 材料与方法 1.1 实验动物及主要试剂SPF级雄性ICR小鼠24只,3~4周龄,体质量18~22g,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK (京)2012-0001。阿利吉仑购于大连美仑生物技术有限公司(A0618A);一抗:Col Ⅰ购于美国Gene Tex公司(BA0325),α-SMA购于美国EPITOMICs公司(1184-1),E-cad购于北京博奥森公司(ZS-7870)。
1.2 实验动物分组及模型制备小鼠随机分为3组,每组8只:①假手术组,仅游离小鼠左侧输尿管但不结扎、剪断,每天给予生理盐水25 mg·kg-1腹腔注射;②模型组,小鼠行左侧输尿管结扎手术,每天给予生理盐水25 mg·kg-1腹腔注射;③阿利吉仑干预组,小鼠行左侧输尿管结扎手术,手术前1 d开始给予阿利吉仑25 mg·kg-1腹腔注射。小鼠适应性喂养1周后,准备手术,术前1 d需禁食,自由饮水。按4 mL·kg-1腹腔注射10%水合氯醛麻醉小鼠,右侧卧位固定于手术台,剪毛后用75%酒精消毒手术区,行左侧背部切口,逐层切开后暴露并游离左侧输尿管。模型组和阿利吉仑干预组小鼠行单侧输尿管结扎手术,用丝线结扎左侧输尿管肾盏和肾下极处,并剪断输尿管;假手术组仅游离输尿管但不结扎、剪断,逐层缝合。各组小鼠分别腹腔注射生理盐水或阿利吉仑至处死前,第14天处死小鼠时留取左侧肾组织。
1.3 HE染色及Masson染色取小鼠肾组织置于4%多聚甲醛固定48 h,酒精脱水,二甲苯透明,石蜡浸润包埋,切片机切4 μm厚薄片,贴片后放45℃恒温箱中烘干。染色前,再将切片入二甲苯脱蜡,经高浓度到低浓度酒精,入蒸馏水后可染色。HE染色:苏木精溶液染色5 min,流水洗1~3s,1%盐酸酒精和1%氨水酒精各数秒钟分色,蒸馏水冲洗后1%伊红染色3 min,经梯度酒精脱水,二甲苯使切片透明,最后中性树胶封片。Masson染色:Masson复合染液染5 min,醋酸洗液冲洗3次,磷钨酸染色7 min,醋酸液冲洗3次,甲苯胺蓝染色2 min,醋酸液冲洗3次,酒精脱水、透明,中性树胶封片。
1.4 α-SMA免疫组织化学染色常规制备小鼠肾组织石蜡切片,枸盐酸盐高压修复,一抗(1:100)4℃过夜。二抗37℃孵育20 min。DAB显色,轻度复染,常规脱水透明,中性树胶封片。α-SMA阳性表达在镜下呈棕黄色,主要进行定位分析。
1.5 蛋白免疫印迹法检测小鼠肾组织中E-cad、α-SMA和Col Ⅰ表达水平提取总蛋白并测定蛋白浓度,按50 μg蛋白/泳道上样,常规电泳并电转。5%牛血清白蛋白封闭,一抗(1:500)4℃过夜,二抗(1:5 000)37℃孵育1 h,HRP-ECL发光法显色。图像扫描后,用Image Pro Plus 6.0图像分析软件对蛋白条带测量光密度(A)值,目的蛋白条带与相应内参A值之比为该蛋白的相对表达水平。
1.6 统计学分析采用SPSS 13.0软件进行统计学分析。小鼠肾组织中E-cad、α-SMA和Col Ⅰ蛋白表达水平均以x±s表示,组间比较采用方差分析,方差齐采用LSD检验,方差不齐采用Tamhane’ s检验。以P < 0.05为差异有统计学意义。
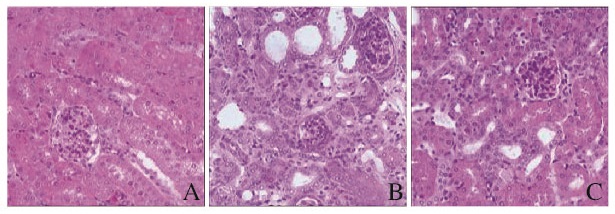
2 结果 2.1 各组小鼠肾组织病理形态表现小鼠结扎侧肾脏明显增大,积液量大,肉眼观囊性改变,触之有波动性,提示肾积水、肾间质水肿。HE染色:假手术组小鼠肾组织中肾小体呈圆球形,由肾小囊和肾小球组成,与之相连的是被单层立方上皮细胞覆盖的肾小管;模型组小鼠肾组织中肾小管大部分发生萎缩,肾间质水肿,立方状的上皮细胞坏死、脱落,管腔扩张,间质纤维组织增生,大量慢性炎细胞浸润,形态学上显示小鼠肾纤维化模型成功;阿利吉仑干预组小鼠肾组织中肾小球纤维化病变不明显,出现少量间质纤维组织的增生,肾小管萎缩不明显。见图 1(插页一)。
|
| A: Sham group; B: Model group; C: Aliskiren intervention group. 图 1 各组小鼠肾组织病理形态表现(HE,×400) Figure 1 Pathomorphology of kidney tissue of mice in various groups (HE, ×400) |
|
|
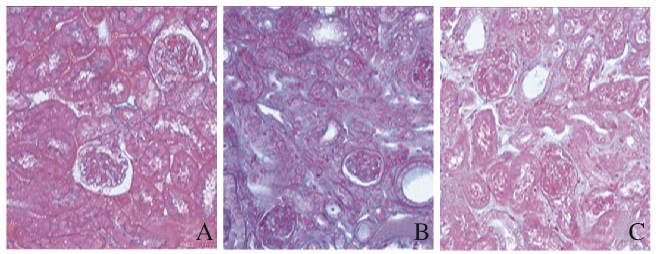
Masson染色:假手术组小鼠肾组织中肾小球与肾小管腔内有微量蓝色胶原蛋白的表达;模型组小鼠肾组织中肾间质出现大量蓝色胶原蛋白的表达;阿利吉仑干预组小鼠肾间质区域胶原蛋白表达明显减少。见图 2(插页一)。
|
| A: Sham group; B: Model group; C: Aliskiren intervention group. 图 2 各组小鼠肾组织中胶原蛋白的表达(Masson,×400) Figure 2 Expressions of collagen in kidney tissue of mice in various groups (Masson, ×400) |
|
|
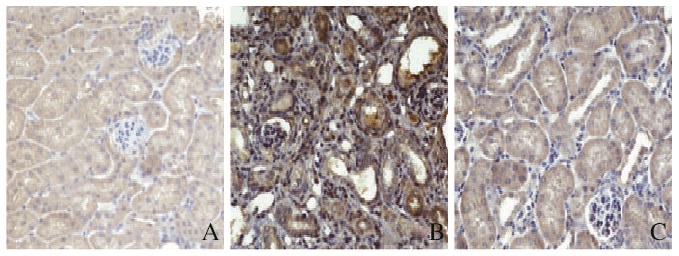
模型组小鼠肾组织中α-SMA棕黄色阳性表达颗粒较假手术组明显增多, 而阿利吉仑干预组小鼠肾组织中α-SMA阳性表达颗粒较模型组明显减少。见图 3(插页一)。
|
| A: Sham group; B: Model group; C: Aliskiren intervention group. 图 3 各组小鼠肾组织α-SMA蛋白的表达(免疫组织化学,×400) Figure 3 Expressions of α-SMA in kidney tissue of mice in various groups (Immunohistochemistry, ×400) |
|
|
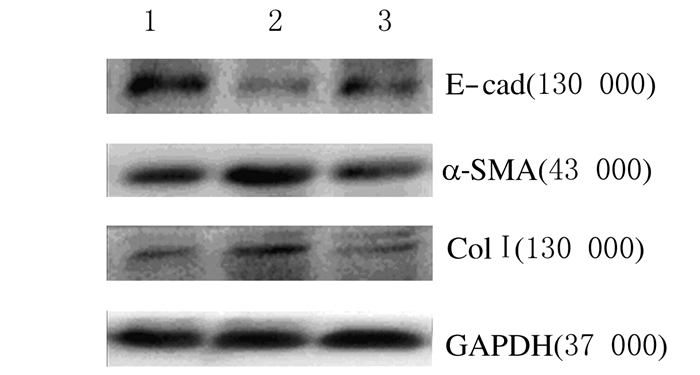
与假手术组比较,模型组小鼠肾组织中E-cad蛋白表达水平降低(P < 0.05),α-SMA和Col Ⅰ蛋白表达水平升高(P < 0.05);与模型组比较,阿利吉仑干预组小鼠肾组织中E-cad蛋白表达水平升高(P < 0.05),α-SMA和Col Ⅰ蛋白表达水平降低(P < 0.05)。见图 4和表 1。
|
| Lane 1: Sham group; Lane 2: Model group; Lane 3: Aliskiren intervention group. 图 4 各组小鼠肾组织中E-cad、α-SMA和Col Ⅰ蛋白表达电泳图 Figure 4 Electrophoregram of expressions of E-cad, α-SMA, and Col Ⅰ in kidney tissue of mice in various groups |
|
|
| (n=8, x±s) | |||
| Group | E-cad | α-SMA | Col Ⅰ |
| Sham | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| Model | 0.37±0.10* | 1.79±0.15* | 1.95±0.38* |
| Aliskiren | 0.78±0.08△ | 1.14±0.09△ | 1.28±0.18△ |
| F | 56.835 | 51.940 | 12.342 |
| P | 0.000 1 | 0.000 2 | 0.007 5 |
| *P < 0.05 compared with sham group;△P < 0.05 compared with model group. | |||
纤维化是多种器官慢性疾病发展到终末期共同经历的病理过程,预后不良,严重影响患者生存质量,寻求纤维化的作用靶点对于该类患者的长期生存有着至关重要的作用。随着对纤维化研究的深入,EMT成为纤维化发展过程中一个重要的研究热点。肾脏纤维化过程中存在EMT。制备单侧输尿管梗阻动物模型[6-7],镜下观察可见大量细胞共同表达α-SMA和小管上皮标志物,处于上皮和间质的过渡阶段。这些肾小管上皮细胞丢失了上皮细胞标志物E-cad,获得间充质细胞的特异性蛋白,如α-SMA和Vimentin等,并产生ColⅠ等基质组分[8]。Iwano等[9]利用单侧输尿管梗阻(UUO)模型研究发现:在肾间质纤维化中,新形成的成纤维细胞中约36%来源于EMT,约14%或15%来源于骨髓干细胞,其余来自本身组织中成纤维细胞的增殖,可见EMT是肾纤维化中的关键步骤。体外研究[10]显示:重组人结缔组织生长因子(rhCTGF)刺激人肾小管上皮细胞后,可以使细胞形态由椭圆形转为梭形, 下调E-cad mRNA表达, 上调α-SMA mRNA表达, 促进了肾小管上皮细胞EMT的发生。miR-29b可以通过调控多种信号通路如TGF-β/Smad[11]、NF-κB[12]、Wnt/β catenin[13]和MAPK[14]抑制纤维化过程的发展。Sapkota等[15]发现:过表达的miR-29b可以通过在mRNA和蛋白水平抑制TGF-β1的表达,从而抑制纤维化过程。研究[16]显示:过表达的miR-29b可以明显抑制由AngⅡ诱导产生的TGF-β、α-SMA和Col Ⅰ,起负向调节EMT的作用。
本研究结果显示:行单侧输尿管结扎14 d后,小鼠结扎侧肾脏明显增大,积液量大,肉眼观呈囊性改变,触之有波动性,提示出现肾积水和肾间质水肿;病理切片显示肾脏肾小管萎缩,间质纤维组织增生,大量慢性炎细胞浸润,发生纤维化病变,与有关文献报道一致[17]。
大量研究[18-21]证实:阿利吉仑具有抗高血压和心、肾保护作用。探讨糖尿病患者阿利吉仑、氯沙坦单独或联合用药对左心室质量回归影响的研究[18]显示:在左心室肥大的糖尿病患者中,联合应用阿利吉仑和氯沙坦治疗心室肥厚要比单独使用氯沙坦获得更加明显的效果。阿利吉仑对高血压患者肾脏保护作用的研究[19]显示:无论是糖尿病患者还是非糖尿病患者,阿利吉仑均可以使研究对象血压、血浆肾素活性、血清醛固酮和蛋白尿水平降低。Imbalzano等[20]在评估阿利吉仑对高血压并有微量蛋白尿且并发2型糖尿病患者的降压疗效和安全性问题的研究中发现:在常规用药的基础上,阿利吉仑在降低血压和尿白蛋白排泄率上的作用均优于氯沙坦和雷米普利。
本研究中免疫组织化学染色和免疫印迹法结果显示:与模型组比较,阿利吉仑干预组小鼠肾组织中E-cad蛋白表达水平增加,α-SMA和Col Ⅰ蛋白表达水平降低,提示直接肾素抑制剂阿利吉仑能够通过上调上皮标志蛋白E-cad、下调间质标记蛋白α-SMA进而抑制Col Ⅰ的表达,从而通过抑制肾纤维化中小鼠EMT的转化,抑制胶原合成,发挥抗纤维化的作用。
综上所述,本研究通过小鼠体内实验证明阿利吉仑能够通过下调α-SMA表达、上调E-cad表达从而抑制小鼠肾脏EMT的机制发挥其抗纤维化作用。
| [1] | Benzoubir N, Mussini C, Lejamtel C, et al. Gamma-smooth muscle actin expression is associated with epithelial-mesenchymal transition and stem-Like properties in hepatocellular carcinoma[J]. PLoS One, 2015, 10(6): e0130559. DOI:10.1371/journal.pone.0130559 |
| [2] | Xia H, Chen J, Shi M, et al. EDIL3 is a novel regulator of epithelial-mesenchymal transition controlling early recurrence of hepatocellular carcinoma[J]. J Hepatol, 2015, 63(4): 863–873. DOI:10.1016/j.jhep.2015.05.005 |
| [3] | Lovisa S, LeBleu VS, Tampe B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nat Med, 2015, 21(9): 998–1009. DOI:10.1038/nm.3902 |
| [4] | Morizane R, Fujii S, Monkawa T, et al. miR-34c attenuates epithelial-mesenchymal transition and kidney fibrosis with ureteral obstruction[J]. Sci Rep, 2014, 3(4): 4578. |
| [5] | Robles NR, Cerezo I, Hernandez-Gallego R. Renin-angiotensin system blocking drugs[J]. J Cardiovasc Pharmacol Ther, 2014, 19(1): 14–33. DOI:10.1177/1074248413501018 |
| [6] | Yang J, Liu Y. Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J]. J Am Soc Nephrol, 2002, 13(1): 96–107. |
| [7] | Sharma A, Khan M, Levick S, et al. Novel omega-3 fatty acid epoxygenase metabolite reduces kidney fibrosis[J]. Int J Mol Sci, 2016, 17(5): 751. DOI:10.3390/ijms17050751 |
| [8] | Li S, Shi S, Wei J, et al. Protective role of propofol on the kidney during early unilateral ureteral obstruction through inhibition of epithelial-mesenchymal transition[J]. Am J Transl Res, 2016, 8(2): 460–472. |
| [9] | Iwano M, Plieth D, Danoff TM, et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis[J]. J Clin Invest, 2002, 110(3): 341–350. DOI:10.1172/JCI0215518 |
| [10] | 钱明, 甘卫华, 陈荣华, 等. 外源性结缔组织生长因子对肾小管上皮细胞的转分化和胶原合成效应[J]. 中国当代儿科杂志, 2006, 8(2): 144–146. |
| [11] | Pan J, Zhang J, Zhang X, et al. Role of microRNA-29b in angiotensin Ⅱ-induced epithelial-mesenchymal transition in renal tubular epithelial cells[J]. Int J Mol Med, 2014, 34(5): 1381–1387. |
| [12] | Chen HY, Zhong X, Huang XR, et al. MicroRNA-29b inhibits diabetic nephropathy in db/db mice[J]. Mol Ther, 2014, 22(4): 842–853. DOI:10.1038/mt.2013.235 |
| [13] | Kapinas K, Kessler CB, Delany AM. miR-29 suppression of osteonectin in osteoblasts:regulation during differentiation and by canonical Wnt signaling[J]. J Cell Biochem, 2009, 108(1): 216–224. DOI:10.1002/jcb.v108:1 |
| [14] | Sapkota GP. The TGFβ-induced phosphorylation and activation of p38 mitogen-activated protein kinase is mediated by MAP3K4 and MAP3K10 but not TAK1[J]. Open Biol, 2013, 3(6): 130067. DOI:10.1098/rsob.130067 |
| [15] | Luna C, Li G, Qiu J, et al. Cross-talk between miR-29 and transforming growth factor-betas in trabecular meshwork cells[J]. Invest Ophthalmol Vis Sci, 2011, 52(6): 3567–3572. DOI:10.1167/iovs.10-6448 |
| [16] | Pan J, Zhang J, Zhang X, et al. Role of microRNA-29b in angiotensin II-induced epithelial-mesenchymal transition in renal tubular epithelial cells[J]. Int J Mol Med, 2014, 34(5): 1381–1387. |
| [17] | 韩红, 孙东, 麻艳艳, 等. 单侧输尿管梗阻模型小鼠肾脏微血管损伤与肾间质纤维化的关系研究[J]. 中国病理生理杂志, 2010, 26(12): 2478–2481, 2486. |
| [18] | Vardeny O, Pouleur AC, Takeuchi M, et al. Influence of diabetes on efficacy of aliskiren, losartan or both on left ventricular mass regression[J]. J Renin Angiotensin Aldosterone Syst, 2012, 13(2): 265–272. DOI:10.1177/1470320312437893 |
| [19] | Abe M, Suzuki H, Okada K, et al. Efficacy analysis of the renoprotective effects of aliskiren in hypertensive patients with chronic kidney disease[J]. Heart Vessels, 2013, 28(4): 442–452. DOI:10.1007/s00380-012-0260-7 |
| [20] | Imbalzano E, Scarpelli M, Mandraffino G, et al. Combination therapy with aliskiren versus ramipril or losartan added to conventional therapy in patients with type 2 diabetes mellitus, uncontrolled hypertension and microalbuminuria[J]. J Renin Angiotensin Aldosterone Syst, 2015, 16(4): 956–964. DOI:10.1177/1470320314530018 |
| [21] | 康阳阳, 刘章锁, 刘东伟. 中国成人慢性肾脏病患病率荟萃分析[J]. 中国实用内科杂志, 2016, 36(9): 785–789. |
 2017, Vol. 43
2017, Vol. 43


