扩展功能
文章信息
- 常彩芳, 候勇, 丛刚
- CHANG Caifang, HOU Yong, CONG Gang
- α-2b干扰素对乙型肝炎模型鸭肝组织炎症和肝纤维化的治疗作用
- Therapeutic effect of α-2b interferon on inflammation of liver tissue and liver fibrosis in hepatitis B model ducks
- 吉林大学学报(医学版), 2017, 43(01): 11-15
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 11-15
- 10.13481/j.1671-587x.20170103
-
文章历史
- 收稿日期: 2016-05-27
2. 河北北方学院药学系, 河北 张家口 075061
2. Department of Pharmacy, Hebei North University, Zhangjiakou 075061, China
尽管乙型肝炎疫苗的研制和开发已经大大降低了世界范围内乙型肝炎的感染率,但流行病学调查[1-2]显示:全球仍有近3.5亿的乙肝病毒(hepatic B virus, HBV)携带者。乙型肝炎是我国的高发性疾病之一,慢性乙型肝炎患者人数居高不下,而慢性乙型肝炎是诱发肝纤维化、肝硬化以及肝癌的主要诱因。抑制HBV的复制是目前治疗乙型肝炎的主要手段之一[3]。干扰素类制剂是目前临床常用的抗乙型肝炎的药物制剂之一,其本身具有控制HBV复制能力和调节机体免疫的双向作用[4]。人体自身具备分泌干扰素从而起到抗病毒的作用。研究[5]表明:在HBV携带者体内,干扰素的生成能力下降,因此通过外部注入干扰素是一种有效的治疗乙型肝炎的方式。干扰素-α可以缓解由四氯化碳诱发的肝纤维化,但对于重组的α-2b干扰素能否起到治疗HBV诱发的肝纤维化作用尚未见相关报道。鸭乙型肝炎模型是国内进行乙型肝炎研究最常用的模型[6-7]。研究[8]表明:使用小鼠、大鼠等常用啮齿类动物进行HBV注射造模时,模型不稳定;而使用鸭HBV (duck hepatitis B virus, DHBV)阳性血清注射造模的鸭乙型肝炎动物模型,可以最大程度保证模型的均一性,是国内目前研究乙型肝炎的主要动物模型。本实验通过DHBV阳性血清注射造鸭乙型肝炎模型,探讨干扰素对鸭乙型肝炎病变中炎症因子和肝纤维化的影响,为其临床应用提供指导。
1 材料与方法 1.1 实验动物、试剂和主要仪器10日龄的北京麻鸭40只(购于北京种鸭场),于实验前进行DHBV-DNA检测,确定动物未感染DHBV。α-2b干扰素(天津华立达生物工程有限公司),DHBV阳性血清(中国医学科学院馈赠),天冬氨酸氨基转移酶(AST)和谷氨酸氨基转移酶(ALT)试剂盒(南京建成生物试剂有限公司),HBV-DNA Dot-blot试剂盒(天泽生物技术有限公司),白细胞介素6(IL-6)、白细胞介素12(IL-12)及肿瘤坏死因子α(TNF-α)酶联免疫试剂盒(武汉华美生物技术有限公司),苏木素-伊红(广州赛业生物技术有限公司),组织细胞裂解液(碧云天生物技术有限公司),BCA蛋白浓度测定试剂盒(美国Thermo fisher公司),其余化学试剂均为国产分析纯(天津大茂化学试剂厂)。病理全扫倒置显微镜和组织切片机(德国Leica公司),电热干燥箱(上海医疗器械总厂),低速离心机(美国赛洛捷克公司),电动移液器(芬兰百得公司),超纯水机(德国Milipore公司),移液枪(德国Eppendorf公司),T1000电子天平(双杰测试仪器厂),酶标仪(美国Thermo公司)。
1.2 α-2b干扰素注射液剂量α-2b干扰素单位为5×106 U·mL-1, 正常人使用每日1次,连用1个月,根据动物体表面积换算,高剂量α-2b干扰素组为5×105U·100 g-1,低剂量α-2b干扰素组为1×105 U·100 g-1,疗程为1个月。
1.3 动物造模及分组给药10日龄鸭随机分为对照组(6只)和感染组(34只),除对照组外,感染组鸭采用DHBV-DNA阳性血清经腿静脉注射感染,每天1次,共3次,第4天开始隔天1次,共7d。感染7 d后,取血清检测DHBV感染情况,按试剂盒说明书操作,以吸光度(A)值大于0.5为感染阳性[9]。去除未感染鸭2只,32只感染阳性鸭随机分为模型组(10只)、低和高剂量α-2b干扰素组(各11只)。分组完成后次日开始给予相应量的α-2b干扰素肌肉注射,对照组和模型组鸭给予等量生理盐水注射。治疗持续30d。
1.4 斑点杂交法检测鸭血清DHBV-DNA水平于感染后7 d及治疗30 d后,鸭腿静脉取血,4℃、3000 r·min-1离心5 min,取血清,按照试剂盒说明书要求操作,采用酶标仪在490 nm处读取A值,以A值代表DHBV-DNA水平。
1.5 鸭血清中AST、ALT、层黏连蛋白(LN)和Ⅲ型前胶原肽(PCⅢ)水平检测于治疗30 d后,鸭腿静脉取血,4℃、3000 r·min-1离心5 min,取血清,按照AST和ALT试剂盒说明书检测血清中AST和ALT水平,部分血清干冰冷藏后,送上海军医研究所检测LN和PCⅢ水平。
1.6 ELISA法检测鸭肝组织中IL-6、IL-12和TNF-α水平及肝组织病理形态观察于治疗30 d鸭取完血后,过量麻醉处死,剖取部分肝脏液氮急冻保存待测。取部分肝脏组织,使用组织匀浆液匀浆后,BCA法测定蛋白浓度,按照试剂盒说明书采用ELISA法检测肝组织中IL-6、IL-12和TNF-α水平。部分肝脏置于多聚甲醛内固定,送检病理切片,HE染色,观察肝纤维化的程度。
1.7 统计学分析采用SPSS 21.0统计软件进行统计学分析。血清DHBV-DNA、AST、ALT、LN、PCⅢ水平及肝组织中IL-6、IL-12和TNF-α水平均以x±s表示,多组间样本均数比较采用单因素方差分析,2组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组鸭血清中DHBV-DNA水平注射DHBV-DNA血清7 d后,剔除2只未感染鸭,32只DHBV阳性鸭为感染组。与对照组(0.243±0.003)比较,感染组鸭DHBV-DNA水平(1.528±0.183)明显升高(P < 0.01),证实模型建立成功。模型建立30 d后,与对照组比较,模型组鸭血清中DHBV-DNA水平明显升高(P < 0.01),表明模型稳定。采用α-2b干扰素治疗30 d后,与模型组比较,低和高剂量α-2b干扰素组鸭血清中DHBV-DNA水平明显降低(P < 0.01)。见表 1。
| (x±s) | ||
| Group | n | DHBV-DNA |
| Control | 6 | 0.206±0.001 |
| Model | 10 | 1.692±0.372* |
| α-2b interferon | ||
| Low dose | 11 | 1.036±0.129△ |
| High dose | 11 | 0.728±0.095△ |
| *P < 0.01 compared with control group; △P < 0.01 compared with model group. | ||
与对照组比较,模型组鸭血清中AST、ALT、LN和PCⅢ水平明显升高(P < 0.01)。与模型组比较,低和高剂量α-2b干扰素组鸭血清中AST、ALT、LN和PCⅢ水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (x±s) | |||||
| Group | n | AST [λB/(U·L-1)] | ALT [λB/(U·L-1)] | LN [ρB/(mg·L-1)] | PCⅢ [ρB/(mg·L-1)] |
| Control | 6 | 36.66±7.96 | 33.57±4.35 | 9.22±3.26 | 27.32±11.54 |
| Model | 10 | 137.24±14.76* | 110.74±6.53* | 223.64±17.64* | 167.33±19.45* |
| α-2b interferon | |||||
| Low dose | 11 | 72.32±9.43△△ | 90.85±6.32△ | 110.13±13.54△△ | 96.54±14.46△ |
| High dose | 11 | 68.43±4.85△△ | 66.54±3.63△△ | 96.23±10.53△△ | 88.46±7.35△△ |
| *P < 0.01compared with control group; △P < 0.05, △△P < 0.01 compared with model group. | |||||
与对照组比较,模型组鸭肝组织中IL-6和TNF-α水平明显升高(P < 0.01),IL-12水平明显降低(P < 0.05)。与模型组比较,低和高剂量α-2b干扰素组鸭肝组织中IL-6和TNF-α水平明显下降(P < 0.05),IL-12水平无明显变化(P>0.05)。见表 3。
| (x±s) | ||||
| Group | n | IL-6[ρB/(μg·L-1)] | IL-12[ρB/(ng·L-1)] | TNF-α[cB/(pmol·L-1)] |
| Control | 6 | 89.65±6.37 | 10.64±0.09 | 95.85±11.64 |
| Model | 10 | 105.84±3.54** | 7.98±0.12* | 186.45±11.75** |
| α-2b interferon | ||||
| Low dose | 11 | 96.43±2.11△ | 8.14±0.95 | 144.75±7.54△ |
| High dose | 11 | 93.64±1.54△ | 8.04±1.11 | 127.35±15.75△ |
| *P < 0.05, ** P < 0.01 compared with control group; △P < 0.05compared with model group. | ||||
对照组鸭肝组织无明显的纤维化,肝细胞之间界线不明确,肝细胞较为完整无明显破坏;模型组鸭肝组织中可见纤维组织增生,有部分肝细胞坏死,有少量炎症细胞浸润;低和高剂量α-2b干扰素组鸭肝组织中纤维组织较少,其中高剂量α-2b干扰素组鸭肝组织未见明显纤维组织。见图 1(插页一)。
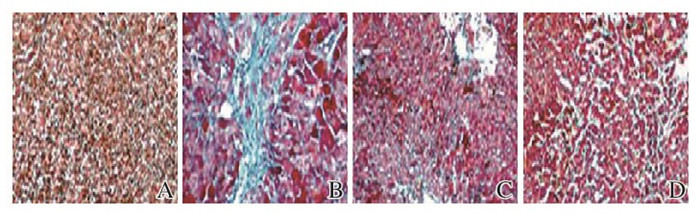
|
| A: Controlgroup; B: Modelgroup; C:Low dose of α-2b interferongroup; D:High dose of α-2b interferongroup. 图 1 各组鸭肝组织病理形态表现(HE,×100) Figure 1 Pathomorphology of liver tissue of ducks in various groups (HE, ×100) |
|
|
乙型肝炎的发病率在我国处于较高水平[10]。干扰素是用于治疗乙型肝炎最早的一类药物制剂之一,除有效抑制HBV复制外,还可以通过作用于人体免疫调节系统起到抗病毒的作用[11]。本研究探讨了干扰素对HBV所导致的肝纤维化和炎症的影响,为其临床应用提供参考。目前,鸭乙型肝炎模型仍然是最为经典和容易建立的动物模型[12]。乙型肝炎在鸭物种群中的流行度很高,为保证实验的准确性,本研究首先对动物的感染状况进行检测,选择未感染的动物用于实验,统一进行DHBV阳性血清的注射造模。
cccDNA是HBV复制的起始模板,而该因子的稳定存在是HBV持续感染的关键所在,临床乙型肝炎治疗的难点也在于此。实验研究[9]表明:干扰素可以有效地抑制HBV的复制,阻止感染的进一步发展。除HBV拷贝量以外,本研究选择了LN和PCⅢ作为评价干扰素治疗肝纤维化效果的指标。研究[13]表明:PCⅢ在肝纤维化发生的早期会大量合成,是肝纤维化发生的最敏感指标之一。而LN在正常肝组织中几乎不存在,仅在肝纤维化发生时才能够检测到[13-14]。本研究结果表明:模型组鸭血清中LN和PCⅢ的水平明显升高,而α-2b干扰素治疗组鸭血清中LN和PCⅢ水平均明显降低,该结果与病理切片鸭肝组织形态表现相符,证实α-2b干扰素对肝纤维化进程有一定的抑制作用。为探讨α-2b干扰素对DHBV所致鸭肝炎症的作用,本研究检测乙型肝炎模型鸭肝组织中IL-6、IL-12和TNF-α结果表明:α-2b干扰素可以通过降低IL-6和TNF-α起到抗炎的作用,而对保护性的IL-12水平无明显的影响。IL-12是由巨噬细胞分泌的具有增强自然杀伤细胞功能和促进细胞免疫作用的细胞因子。HBV感染持续的出现,除了HBV本身具有极强的复制能力外,还与机体本身免疫系统的缺陷有关,免疫系统在病毒作用下会产生大量的IL-6和TNF-α,这些免疫因子的过量产生会导致机体本身系统的混乱,从而产生炎症[15-17]。本研究结果表明:α-2b干扰素抗炎作用的实现与抑制IL-6和TNF-α的分泌有关,而与增加IL-12的分泌无关。
肝纤维化的治疗准则是结合患者的具体情况配合使用抗病毒疗法及免疫调节疗法,干扰素同时具有抗乙肝病毒复制和免疫调节的作用,是治疗肝纤维化病变的重要药物之一[18]。本研究证实了α-2b干扰素可以抑制IL-6和TNF-α表达,起到调节免疫因子、降低肝纤维化所致炎症反应,从而起到治疗肝纤维化的作用;同时,α-2b干扰素的应用还可以抑制促使肝纤维化病变的主要因子LN和PCⅢ的合成,从而对肝纤维化起到治疗作用。本研究结果对于α-2b干扰素治疗乙型肝炎的临床应用具有重要的指导意义。
| [1] | Hayashi PH, Di Bisceglie AM. The progression of hepatitis B-and C-infections to chronic liver disease and hepatocellular carcinoma:epidemiology and pathogenesis[J]. Med Clin North Am, 2005, 89(2): 371–389. DOI:10.1016/j.mcna.2004.08.014 |
| [2] | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures[J]. J Viral Hepat, 2004, 11(2): 97–107. DOI:10.1046/j.1365-2893.2003.00487.x |
| [3] | 李赫伦.抗纤协定方联合恩替卡韦治疗血瘀气血两虚乙肝肝纤维化的临床观察[D].沈阳:辽宁中医药大学, 2015. |
| [4] | 陈简.聚乙二醇干扰素治疗拉米夫定耐药慢乙肝患者中耐药毒株动态变化及其与疗效的关系[D].广州:南方医科大学, 2015. |
| [5] | 陈爱萍. 核苷(酸)类似物联合干扰素治疗144例慢性乙肝患者的药效评估[J]. 海南医学院学报, 2013, 19(2): 209–211. |
| [6] | 陈军, 杨发周, 鲁磊. 解毒软肝片防治鸭乙型肝炎肝纤维化的实验研究[J]. 中西医结合肝病杂志, 2014, 24(6): 354–356. |
| [7] | 沈海容.红背叶根提取物抗乙肝病毒和抗肝损伤的药效学研究[D].广州:南方医科大学, 2014. |
| [8] | 张传涛, 廖志航, 陈东辉, 等. 乙型肝炎病毒感染细胞与动物模型研究现状[J]. 军医进修学院学报, 2010, 7(10): 1036–1038. |
| [9] | 耿淼, 王建华, 陈红艳, 等. 金丝桃苷对鸭乙肝病毒cccDNA清除及免疫调节作用探讨[J]. 药学学报, 2009, 4(12): 1440–1444. |
| [10] | 陈银苹, 吴爱萍, 余亮科. 组合模型对乙肝发病趋势的预测研究[J]. 解放军医学杂志, 2014, 7(1): 52–56. |
| [11] | 张军楠, 邵杰, 梁争论. Ⅰ型干扰素免疫应答作用机制研究进展[J]. 微生物学免疫学进展, 2014, 8(3): 54–58. |
| [12] | Cao J, Ou X, Zhu D, et al. The 2A2 protein of Duck hepatitis A virus type 1 induces apoptosis in primary cell culture[J]. Virus Genes, 2016, 52(6): 780–788. DOI:10.1007/s11262-016-1364-4 |
| [13] | 黄东彬, 管静. 龙葵承气汤对原发性肝癌患者TACE术后肝纤维化指标及免疫功能的影响[J]. 新中医, 2016, 48(5): 211–213. |
| [14] | 陈宏超. 鳖甲软肝丸联合恩替卡韦片治疗乙肝肝硬化临床疗效观察[J]. 中国现代药物应用, 2015, 9(24): 103–104. |
| [15] | Thermet A, Buronfosse T, Werle-Lapostolle B, et al. DNA vaccination in combination or not with lamivudine treatment breaks humoral immune tolerance and enhances cccDNA clearance in the duck model of chronic hepatitis B virus infection[J]. J Gen Virol, 2008, 89(Pt 5): 1192–1201. |
| [16] | Chang L, Lan T, Wu L, et al. The association between three IL-6 polymorphisms and HBV-related liver diseases:a meta-analysis[J]. Int J Clin Exp Med, 2015, 8(10): 17036–17045. |
| [17] | Saxena R, Chawla YK, Verma I, et al. IFN-γ (+874) and not TNF-α (-308) is associated with HBV-HCC risk in India[J]. Mol Cell Biochem, 2014, 385(1/2): 297–307. |
| [18] | 王晓丽, 王永明, 朱万光, 等. 干扰素研究进展[J]. 动物医学进展, 2008, 29(12): 60–63. |
 2017, Vol. 43
2017, Vol. 43


