扩展功能
文章信息
- 赵兰平, 薛淑芳, 陈彦静, 王雪芳, 陈立锋, 黄嘉诚
- ZHAO Lanping, XUE Shufang, CHEN Yanjing, WANG Xuefang, CHEN Lifeng, HUANG Jiacheng
- 非对称性二甲基精氨酸对豚鼠左心室流出道自律细胞电活动的影响
- Influence of ADMA in electrical activity of pacemaker cells in guinea-pig left ventricular outflow tract
- 吉林大学学报(医学版), 2017, 43(01): 6-10
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 6-10
- 10.13481/j.1671-587x.20170102
-
文章历史
- 收稿日期: 2016-04-27
2. 中国中医科学院中医基础理论研究所, 北京 100700
2. Institute of Basic Theories of TCM, China Academy of Chinese Medical Sciences, Beijing 100700, China
随着心内电生理和射频消融技术的发展,研究发现特发性室速(idiopathic ventricular tachycardia,IVT)多源于心室流出道,其产生机制涉及多个方面,折返、异常自律性增高和触发激动均有可能导致IVT。本课题组前期研究[1-2]表明:在豚鼠、大鼠及兔左心室流出道的特定部位存在慢反应自律细胞,其0和4期去极离子流与窦房结起搏细胞具有相似的特征,而且该区域富含神经纤维,可能同样接受自主神经的调控。因此,心室流出道很可能作为心脏另一潜在起搏点,在心脏节律异常时,其自发电活动表现出来,参与源于流出道IVT的发生发展。一氧化氮(nitric oxide,NO)/一氧化氮合酶(nitric oxide synthase,NOS)系统在多种心血管疾病如冠心病、心力衰竭等的发生发展中发挥了重要作用。血浆内源性NOS抑制物非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)的浓度升高是内皮功能不全和心血管疾病的危险因子,血浆ADMA浓度升高与动脉粥样硬化和冠心病等有密切关联[3-4]。在健康志愿者体内注入ADMA后可出现血压升高、血管阻力增加、心输出量降低和心率下降等[5-7]。ADMA对心脏的直接电生理效应国内外尚未见相关报道。为探讨NO/NOS系统在源于心室流出道心律失常发生发展中的作用,本研究应用内源性NOS抑制物ADMA灌流豚鼠离体左心室流出道标本,观察并记录其对该部位自发慢反应动作电位(slow action potential, sAP)的影响,研究NO供体硝普钠(sodium nitroprusside,SNP)预处理对ADMA所致左心室流出道自律性电活动改变的效应。
1 材料与方法 1.1 实验动物及主要试剂普通级Dunkin Hartley豚鼠,体质量250~350g,雌雄不限,购自北京金牧阳实验动物养殖有限公司,动物许可证号:SCXK (京)2010-0001。SNP和ADMA购自美国Sigma公司。
1.2 标本制备豚鼠击昏后迅速开胸取出心脏,并用氧饱和的改良Locke液(mmol·L-1: NaCl 157,KCl 5.6,CaCl2 2.1,NaHCO3 1.8,葡萄糖5.6,pH7.3~7.4)经冠脉进行灌注冲洗后,从主动脉瓣的左瓣与后瓣间向下剪开心室,保留各瓣膜完整,并以此为宽度,向下切取约4 mm的前庭组织制成标本。制好的标本用不锈钢针固定于灌流槽(1.5 cm×2.0 cm)内的硅橡胶上。用氧饱和的改良Locke液恒温(35℃±1℃)下10 mL·min-1进行灌流,标本在灌流液中稳定30 min后开始实验。
1.3 电位引导采用常规玻璃微电极细胞内电位记录技术,引导心室流出道自律细胞的sAP。如能直接记录到自发电位,则不再进行刺激,若记录不到,则将刺激电极置于标本远离瓣膜一端的心肌组织上,给予波宽2 ms、1 Hz、2倍阈强度的方波刺激,刺激时间由数秒至数分钟不等,直至诱发出稳定的自发节律,即停止电刺激开始实验。引导出的sAP,经SWF-1B型高阻抗微电极放大器放大,一路输入监听器监听,另一路采用RM6280多道生理信号采集处理系统,自动显示电信号,分析sAP的各项参数指标。
1.4 观测指标观测指标包括4相自动除极速度(velocity of diastolic depolarization,VDD)、自发放电频率(rate of pacemaker firing,RPF)、最大舒张电位(maximal diastolic potential,MDP)、0相最大除极速度(maximal rate of depolarization,Vmax)、动作电位幅度(amplitude of action potential,APA)及复极50%和90%时间(50% and 90% of duration of action potential,APD50和APD90)。
1.5 实验分组及过程待自发节律稳定30 min后,开始采集一组正常的sAP做对照,然后采用一定浓度的药液进行灌流,实时记录并分析药物对豚鼠左心室流出道sAP的影响。为保证药效,各种药液均在实验前1h内配制。内源性NOS抑制物ADMA对豚鼠左心室流出道自律性电活动的影响:ADMA分为3个浓度组(1、10和100 μmol·L-1),每个浓度组灌流20 min。NO供体SNP预处理对ADMA所致豚鼠左心室流出道sAP改变的影响:采集对照sAP,以含有10 μmol·L-1 SNP灌流液灌流预处理10 min,再以10 μmol·L-1 SNP+10 μmol·L-1 ADMA灌流液灌流10 min,记录电位的变化。
1.6 统计学分析采用SPSS15.0软件进行统计学分析。左心室流出道sAP各项观测指标(VDD、RPF、MDP、Vmax、APA、APD50和APD90)以x±s表示,给药前后各指标比较采用配对t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 ADMA灌流后豚鼠左心室流出道sAP各项指标1 μmol·L-1 ADMA灌流豚鼠左心室流出道标本20min,与对照组比较,VDD和RPF有逐渐减慢的趋势,但差异无统计学意义(P>0.05),sAP的其他各项指标也无明显变化(P>0.05)。
10 μmol·L-1 ADMA灌流20 min,与对照组比较,VDD、RPF和Vmax明显减慢(P < 0.05),APD50和APD90明显延长(P < 0.05);与1 μmol·L-1 ADMA组比较,RPF进一步减慢(P < 0.05),VDD有进一步减慢的趋势,但差异无统计学意义(P>0.05),APD90明显延长(P < 0.05)。
100 μmol·L-1 ADMA灌流20 min,与对照组比较,VDD、RPF和Vmax明显减慢(P < 0.05),APA明显减小(P < 0.05),APD50和APD90明显延长(P < 0.05);与1 μmol·L-1 ADMA组比较,RPF、Vmax和APD50均有明显改变(P < 0.05);与10 μmol·L-1 ADMA组比较,APA明显减小(P < 0.05)。见图 1和表 1。
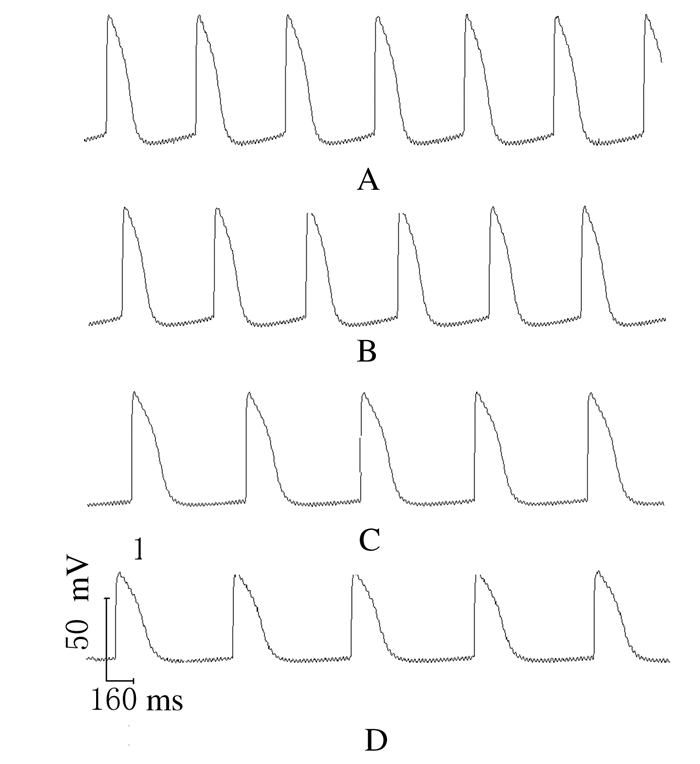
|
| A:Control group; B:1 μmol·L-1 ADMA group; C:10 μmol·L-1 ADMA group; D:100 μmol·L-1 ADMA group. 图 1 ADMA灌流后豚鼠左心室流出道sAP Figure 1 sAP of guinea-pig left ventricular outflow tract after ADMA perfusion |
|
|
| (n=9, x±s) | |||||||
| Group | VDD (mV·s-1) | RPF (min-1) | MDP (U/mV) | Vmax(V·s-1) | APA (U/mV) | APD50(t/ms) | APD90(t/ms) |
| Control | 30.25±5.68 | 131±12 | -62.37±9.21 | 7.34±1.34 | 59.27±7.08 | 122±28 | 168±37 |
| ADMA (μmol·L-1) | |||||||
| 1 | 23.20±7.92 | 128±21 | -59.17±7.25 | 7.40±0.66 | 57.74±8.68 | 121±15 | 171±22 |
| 10 | 22.98±2.57* | 116±18* | -63.09±2.36 | 5.02±0.96* | 51.84±3.39 | 134±16* | 183±28* |
| 100 | 20.13±3.88* | 114±11*△ | -68.19±5.37 | 4.84±0.35*△ | 46.87±7.26*# | 139±24*△ | 185±33* |
| *P < 0.05 vs control group; △P < 0.05 vs 1 μmol·L-1 ADMA group; #P < 0.05 vs 10 μmol·L-1 ADMA group. | |||||||
ADMA呈浓度依赖性降低左心室流出道细胞的自发放电活动,使VDD和RPF逐渐减慢。冲洗10 min,自发节律恢复至给药前对照组水平。
2.2 SNP预处理时ADMA灌流后豚鼠左心室流出道sAP各项指标10 μmol·L-1 SNP灌流豚鼠左心室流出道标本10 min,细胞的自发放电活动明显增加,与对照组比较, VDD、RPF和Vmax明显加快(P < 0.05),APD90明显缩短(P < 0.05),MDP绝对值和APA有增大趋势,但差异无统计学意义(P>0.05)。
10 μmol·L-1 SNP灌流10 min后,改用10 μmol·L-1 SNP+10 μmol·L-1 ADMA的灌流液灌流10 min,SNP预处理标本可逆转ADMA灌流时降低自发放电活动的效应,与对照组比较,SNP+ADMA组VDD和RPF进一步加快(P < 0.05),但与10 μmol·L-1 SNP组比较无明显变化(P>0.05)。
与对照组比较,SNP+ADMA组MDP绝对值明显增大(P < 0.05),APD50和APD90明显缩短(P < 0.05);与10 μmol·L-1SNP组比较,SNP+ADMA组Vmax明显减慢(P < 0.05),APD90明显缩短(P < 0.05)。见图 2和表 2。

|
| A:Control group; B:10 μmol·L-1 SNP group; C:10 μmol·L-1 SNP+10 μmol·L-1 ADMA group. 图 2 经SNP预处理ADMA灌流后豚鼠左心室流出道sAP Figure 2 sAP of guinea-pig left ventricular outflow tract after pretreatment of SNP and ADMA perfusion |
|
|
| (n=9, x±s) | |||||||
| Group | VDD (mV·s-1) | RPF (min-1) | MDP (U/mV) | Vmax(V·s-1) | APA (U/mV) | APD50(t/ms) | APD90(t/ms) |
| Control | 33.64±4.33 | 148±22 | -58.84±5.30 | 8.28±0.50 | 56.50±4.81 | 129±16 | 168±34 |
| SNP | 37.74±1.36* | 157±19* | -65.17±4.24 | 9.06±0.36* | 61.09±3.96 | 123±18 | 151±26* |
| SNP+ADMA | 39.17±1.15* | 161±32* | -65.60±6.67* | 7.66±0.07△ | 55.12±5.69 | 117±24* | 143±27*△ |
| *P < 0.05 vs control group; △P < 0.05 vs SNP group. | |||||||
临床资料[8]表明:特发性室速多起源于心室流出道,约占所有IVT的80%。本课题组前期研究[1-2]表明:豚鼠、大鼠和家兔等的心室流出道部位存在慢反应自律细胞,具有自律性电活动。一些因素如自主神经、体液因素变化或高血压时心室内压增高,流出道的机械牵张性增大而触发局灶性电活动,可能诱发心律失常,说明心室流出道自律细胞的电生理特性的改变与源于流出道心律失常的发生有密切关联。
NO是体内参与心血管活动调节的重要气体信使分子。体内NO由L-精氨酸在NOS的催化下生成。NOS主要有3种不同的亚型:神经型NOS (nNOS)、诱导型NOS (iNOS)和内皮型NOS (eNOS)。当NOS活性受到抑制时,NO生成减少。内源性NOS抑制物ADMA抑制3种NOS所有异构体。健康成年人血浆ADMA的浓度为0.4~1.3 μmol·L-1,当血浆ADMA浓度达到3~15 μmol·L-1时能导致内皮功能紊乱。有研究[9]表明:原发性高血压患者血浆ADMA浓度可升高到(0.029±0.010) mmol·L-1。动物实验[10]中,ADMA浓度在3~15 μmol·L-1时可抑制离体动脉段的NO生成。内源性NOS抑制物ADMA和NG-单甲基-L-精氨酸甲酯(NG-monomethyl-L-arginine,L-NMMA)均能降低NOS的活性,并且这种效应可被高浓度L-Arg所逆转,提高L-Arg/NOS抑制物的比值,可逆转NOS抑制物对NOS的竞争性抑制。在体内应用外源性NOS抑制物NG-硝基-L-精氨酸甲基酯(NG-nitro-L-arginine methyl ester,L-NAME)可使左室内压上升速率明显减小,左心室射血分数明显下降[11-12]。有研究[13]表明:NOS抑制物ADMA和NG-硝基-L-精氨酸(NG-nitro-L-arginine,L-NNA)可直接抑制大鼠离体左心室乳头肌条电刺激时收缩发展张力峰值,降低收缩力。长期应用L-NAME阻断狗的NO释放还可导致心动过缓[14],NOS抑制物的上述效应被认为是NOS系统对心脏的直接效应。本实验中应用内源性NOS抑制物ADMA灌流豚鼠左心室流出道标本20min,可呈浓度依赖性导致VDD和RPF减慢,可能与ADMA抑制NOS的活性使NO生成减少,导致相关离子通道通透性发生改变有关。ADMA可使MDP绝对值增大,细胞膜的兴奋性降低,也是导致VDD和RPF减慢的原因之一。ADMA可使APD50和APD90明显延长,从而延长了心室流出道自律细胞的有效不应期(effective refractory period, ERP),减少心律失常的发生,与NOS抑制剂减少缺血再灌注导致的室性心律失常发生率的相关报道一致[14]。100 μmol·L-1ADMA还可使APA明显减小,对心室流出道的电活动表现为抑制效应。
在离体动物心脏,NO供体SNP对窦房结具有剂量依赖性的变时性效应,在低浓度时增加豚鼠窦房结的搏动节律,高浓度时减慢心率,并可影响房室传导和ERP[14-15]。SNP影响豚鼠左心室流出道细胞的自律性电活动,同样表现为其自发放电频率在低浓度时加快、高浓度时减慢的双相效应[16],且各个浓度SNP灌流时左心室流出道自发节律平稳规整,不易出现节律不齐。上述电生理效应的改变是由于NO供体增加超极化激活的内向电流(If)、增强或抑制L型钙通道引起的Ca2+内流、增加内向整流K+电流IK1等原因而产生的。本实验中用10 μmol·L-1 SNP预处理标本10min后自发放电频率增加,再用10 μmol·L-1 SNP+10 μmol·L-1 ADMA灌流10min可逆转单独应用ADMA对自发放电活动的抑制效应,表明提高NO供体的浓度可逆转NOS抑制物对心室流出道自发电活动的抑制效应。
综上所述,ADMA可呈浓度依赖性降低左心室流出道部位的自发放电活动,直接抑制其起搏频率。但血浆ADMA浓度升高,抑制NOS活性,减少NO合成,导致内皮功能障碍,进而间接导致动脉粥样硬化等一系列心脑血管疾病的发生发展。补充外源性NO供体SNP可逆转由于ADMA浓度升高所致的上述效应。本研究结果为探讨ADMA在心血管疾病中的作用提供了直接的实验依据。
| [1] | 陈彦静, 葛赋贵. 豚鼠主动脉前庭组织的自律性研究和形态学观察[J]. 生理学报, 1994, 46(5): 458–464. |
| [2] | 张晓云, 陈彦静, 葛赋贵, 等. 兔主动脉前庭自律细胞与窦房结电生理特性的比较[J]. 生理学报, 2003, 55(4): 405–410. |
| [3] | 张慧平, 柳景华. 非对称性二甲基精氨酸与冠心病的相关性研究进展[J]. 中国临床保健杂志, 2014, 17(6): 667–670. |
| [4] | 黄新金, 李菊香, 颜素娟, 等. 冠状微血管痉挛性心绞痛患者血内源性一氧化氮合酶抑制物的变化[J]. 中国循环杂志, 2007, 22(2): 100–102. |
| [5] | 王亮, 张抒扬. 新的血管内皮损伤标记物-非对称性二甲基精氨酸[J]. 中华临床医师杂志:电子版, 2011, 5(16): 4795–4797. |
| [6] | Zhao JR, Zhang DY, Sun DZ. Correlation research on ADMA plasma levels and left ventricular function of peritoneal dialysis patients[J]. Int J Chin Exp Med, 2014, 7(11): 4455–4460. |
| [7] | Rafat P, Pawet G, Matgorzata P, et al. Left ventricular diastolic dysfunction and plasma asymmetric dimethylarginine concentration in patients with essential hypertension[J]. Arch Med Sci, 2015, 11(3): 521–529. |
| [8] | Saliba WI, Natale A. Ventricular tachycardia syndromes[J]. Med Clin North Am, 2001, 85(2): 267–304. DOI:10.1016/S0025-7125(05)70316-3 |
| [9] | 王洪巨, 刘俊, 史晓俊, 等. 原发性高血压患者血浆非对称性二甲基精氨酸浓度升高[J]. 中华高血压杂志, 2007, 15(11): 930–932. |
| [10] | BögerRH. Asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, explains the "L-arginine paradox" and acts as a novel cardiovascular risk factor[J]. J Nutr, 2004, 134(10 suppl): 2842s–2847s. |
| [11] | Ferreira-Melo SE, Demacq C, Lacchini S, et al. Sildenafil preserves diastolic relaxation after reduction by L-NAME and increases phosphodiesterase-5 in the intercalated discs of cardiac myocytes and arterioles[J]. Clinics (Sao Paulo), 2011, 66(7): 1253–1258. DOI:10.1590/S1807-59322011000700022 |
| [12] | Luo Y, Cha DG, Liu YL, et al. Differential effects of selective and non-selective nitric oxide synthase inhibitors on the blood perfusion of ischemia-reperfused myocardium in dogs[J]. Med Sci Monit Basic Res, 2013, 19: 181–186. DOI:10.12659/MSMBR.883964 |
| [13] | 聂凡, 宜全, 张贵平, 等. 一氧化氮合酶抑制物对大鼠离体乳头肌收缩力的影响及其机制[J]. 国际病理科学与临床杂志, 2012, 32(1): 1–7. |
| [14] | Wang LX. Role of nitric oxide in regulating cardiac electrophysiology[J]. Exp Clin Cardiol, 2001, 6(3): 167–171. |
| [15] | Bonilla IM, Sridhar A, Györke S, et al. Nitric oxide synthases and atrial fibrillation[J]. Front Physiol, 2012, 3: 105. |
| [16] | 赵兰平, 薛淑芳, 陈彦静, 等. 一氧化氮对缺血再灌注豚鼠左心室流出道自律性电活动的影响[J]. 中国病理生理杂志, 2015, 31(7): 1166–1171. |
 2017, Vol. 43
2017, Vol. 43


