扩展功能
文章信息
- 赵岩, 韩玲玲, 侯莹莹, 郭帅, 唐国胜, 张连学
- ZHAO Yan, HAN Lingling, HOU Yingying, GUO Shuai, TANG Guosheng, ZHANG Lianxue
- 淫羊藿醇提物对高脂血症模型小鼠的降血脂作用及其抗氧化活性
- Hypolipidemic effect of ethanol from Epimedium brevicornu Maxim on hyperlipidemia of mice and its antioxidant activity
- 吉林大学学报(医学版), 2017, 43(01): 1-5
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 1-5
- 10.13481/j.1671-587X.20170101
-
文章历史
- 收稿日期: 2016-06-21
淫羊藿又称仙灵脾,为小檗科(Berberidaceae)淫羊藿属(Epimedium)多年生草本植物,已有2000多年药用历史[1],主要分布在吉林、黑龙江、辽宁、山东和江西等地[2]。淫羊藿资源极为丰富,化学成分多样,目前对于淫羊藿的研究主要集中在以淫羊藿苷为代表的黄酮类化合物[3-4],淫羊藿苷具有改善心脑血管功能、增强机体免疫功能、延缓衰老、增强性腺功能和抗肿瘤等生物活性[5-10]。
血清总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)的升高是导致心血管疾病的主要危险因素。心血管疾病如冠心病(coronary heart disease, CHD)和外周动脉疾病是在全球上导致死亡的主要原因[11-12]。尽管心血管疾病具有多因素的发病机制,但是摄入大量的胆固醇丰富的脂肪及饱和脂肪酸是主要的危险因素[13]。到目前为止,有许多药物能够显著降低CHD的风险,但同时会带来很多不良反应[14]。近年来,以天然药用植物为来源的天然降血脂药物受到越来越多的关注。到目前为止,虽然淫羊藿广泛分布于中国,但尚未见其降血脂作用的相关报道。本课题组前期测定了淫羊藿醇提物(ethanol from Epimedium brevicornu Maxim, EEBM)总酚及总黄酮水平,其总酚和总黄酮质量分数分别为14.3%和74.6%,本实验在此基础上进一步对其抗氧化活性及降血脂活性进行了研究,旨在能更好地利用淫羊藿资源,为其潜在降血脂成分的开发及利用提供实验依据。
1 材料与方法 1.1 实验动物KM SPF级小鼠,体质量(20±2) g,购于长春市生物制品研究所有限责任公司,动物许可证号:SCXK (吉)2011-0003。所有的小鼠均在标准的实验室条件下饲养,温度(22±2)℃,湿度40%~70%,昼夜12h交替。
1.2 实验药品及试剂阳性对照药血脂康胶囊(批号:121206),北京北大维信生物科技有限公司生产。血清总胆固醇(批号:2015005)、甘油三酯(TG,批号:2015004)、高密度脂蛋白胆固醇(HDL-C,批号:2015009)和LDL-C (批号:2015008)测定试剂盒,均购自长春汇力生物技术有限公司。淫羊藿采收于吉林省临江市,经吉林农业大学张连学教授鉴定为淫羊藿(Epimedium brevicornu Maxim),实验前筛选去梗、去茎、晒干、粉碎,过20目,阴凉处保存,备用。没食子酸和芦丁购买于中国药品生物制品检定所(北京,中国)。乙醇、亚硝酸钠、硝酸铝、氢氧化钠、2,2-二苯基苦基肼(DPPH)和福林酚试剂购自杭州试剂公司。其他溶剂和化学药品均为分析级别。
1.3 样品的制备干燥淫羊藿粉末(0.5 kg),用95%乙醇回流提取3次(10、8和6 L),合并提取液,过滤,将滤液置于45℃的条件下真空干燥,得到提取物即EEBM,在2~8℃条件下存储备用。
1.4 高脂饲料配方基础饲料(质量分数):玉米粉25%、麸皮11%、小麦粉27%、油渣15%、鱼粉7%、豆饼12%、食盐0.17%、维生素0.25%、微量元素0.25%、鱼肝油0.33%和石粉2%。高脂饲料(质量分数):78.8%基础饲料、1%胆固醇、10%蛋黄粉、10%猪油和0.2%胆盐。
1.5 体外抗氧化试验①EEBM还原能力的测定:根据参考文献[15]中的实验方法进行了一定修改。不同浓度的EEBM溶液(5~1000 mg·L-1),加入磷酸钠缓冲液(1.5 mL,0.2 mol·L-1,pH=6.6)与铁氰化钾(1.5 mL,质量分数1%)混合,50℃孵育20 min。加入三氯乙酸(TCA,1.5mL,质量分数10%),将混合物以3000 r·min-1离心15min,离心液(1.5 mL)被充分混合,使用去离子水1.5 mL和FeCl30.3 mL (质量浓度0.1%),并在700 nm处测定吸光度(A)值。反应混合物A值增加表明还原能力增强。还原能力以半最大效应浓度(EC50)表示(mg·L-1),用丁基羟基甲苯(BHT)作为标准品。②EEMB对DPPH自由基清除实验:根据Singleton等[16]的实验法测定EEBM的DPPH自由基清除能力。配制0.15%DPPH甲醇溶液,用来配制不同浓度(5~1000 mg·L-1) EEBM溶液,10min后,在波长515 nm处测A值。自由基清除活性用半数抑制浓度(IC50)表示,以维生素C作为标准品[17]。使用下列方程计算DPPH自由基的清除能力。DPPH自由基清除能力=(A0-A1)/ A0×100%,其中A0是30 min时对照品的A值,A1是30 min时样品的A值(n=3)。
1.6 动物实验设计在实验开始前1周开始喂食小鼠基础饲料,使小鼠适应实验环境。喂食基础饲料1周后,将小鼠随机分为6组,每组8只:正常对照组,模型组,阳性对照组(血脂康胶囊,1000 mg·kg-1),低、中和高剂量EEBM组(25、50和150 mg·kg-1)。正常对照组小鼠饲喂基础饲料,其他各组小鼠饲喂高脂饲料。正常对照组和模型组小鼠灌胃给予同体积饮用水,其他各组小鼠灌胃给予相应剂量的药物,每日1次,给药4周。小鼠在实验期间可以自由摄食水。
预防性给药与治疗性给药:预防性给药是在小鼠给予高脂饲料的同时给予不同剂量的EEBM;治疗性给药是小鼠给予高脂饮食2周后,再给予不同剂量的EEBM。
1.7 小鼠血清生化指标检测预防性给药和治疗性给药的实验周期分别为28和42 d,每天1次,连续给予药物及生理盐水灌胃,分别在27和41 d后16 h内禁食水,采用眼球取血法每只小鼠取血约1 mL,3000 r·min-1离心15 min,获得血清,4℃保存。采用试剂盒检测各组小鼠血脂水平。
1.8 计算各组小鼠肝指数和脾指数实验结束后,处死各组小鼠,取各组小鼠肝脏和脾脏称取质量,计算肝指数(肝质量/体质量)和脾指数(脾质量/体质量)。
1.9 统计学分析采用Excel进行数据整理和统计学分析。各组小鼠血脂水平、肝指数和脾指数以x±s表示,多组间样本均数比较采用单因素方差分析,2组间比较采用t检验。以P < 0.05为差异有统计学意义。
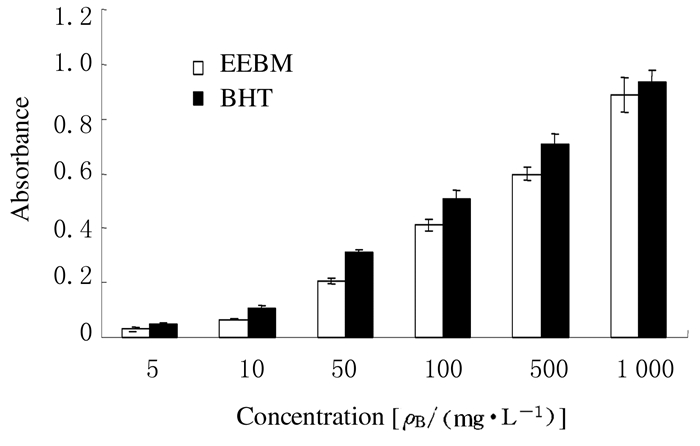
2 结果 2.1 EEBM的抗氧化活性EEBM还原能力测定:对EEBM和标准品BHT的还原能力进行对比,EEBM的还原能力随着浓度的增加而升高,EEBM和BHT的EC50值分别为(148.35±1.38) mg·L-1和(78.12±0.63) mg·L-1。见图 1。
|
| 图 1 EEBM和BHT的抗氧化能力 Figure 1 Antioxidant abilities of EEBM and BHT |
|
|
EEBM对DPPH自由基清除活性:EEBM的DPPH清除能力与维生素C进行对比,随着浓度增加EEBM自由基的清除能力也明显增加,EEBM的IC50为(35.12±0.48) mg·L-1,维生素C的IC50为(26.42±0.31) mg·L-1。见图 2。

|
| 图 2 EEBM和维生素C对DPPH自由基清除能力 Figure 2 Scavenging activities of EEBM and vitamin Cto DPPH free radicals |
|
|
随着给药时间的延长,各组小鼠体质量均正常增加。实验结束后,各组小鼠体质量增加的百分率分别为:正常对照组36.8%,模型组51.3%,阳性对照组41.5%,低剂量EEBM组48.1%,中剂量EEBM组43.1%,高剂量EEBM组42.3%,与正常对照组比较, 模型组小鼠的体质量增加百分率差异有统计学意义(P < 0.01),表明制备高脂模型成功。与正常对照组比较,模型组小鼠肝指数明显增加(P < 0.01),脾指数明显降低(P < 0.01);与模型组比较,高剂量EEBM组和阳性对照组小鼠肝指数明显降低(P < 0.01),低和中剂量EEBM组小鼠肝指数、阳性对照组和各剂量EEBM组小鼠脾指数差异均无统计学意义(P>0.05)。
给药4周后,与正常对照组比较,模型组小鼠血清中TC、TG和LDL-C水平明显升高(P < 0.05),HDL-C水平明显降低(P < 0.05),表明高脂血症小鼠模型成功建立。与模型组比较,各剂量EEBM组和阳性对照组小鼠血清中TC、TG和LDL-C水平均明显降低(P < 0.01),HDL-C水平明显升高(P < 0.01)。见表 1。
| (n=8, x±s) | ||||||
| Group | TC [cB/(mmol·L-1)] | TG [cB/(mmol·L-1)] | HDL-C [cB/(mmol·L-1)] | LDL-C [cB/(mmol·L-1)] | Liver index | Spleen index |
| Normal control | 3.34±0.72 | 0.63±0.11 | 2.74±0.83 | 1.31±0.47 | 0.19±0.11 | 0.13±0.28 |
| Model | 6.01±0.62* | 1.61±0.46* | 1.15±0.56* | 4.04±0.92* | 0.62±0.19** | 0.92±0.45** |
| Positive control | 3.52±0.74△ | 0.61±0.15△ | 2.42±0.71△ | 1.32±0.33△ | 0.24±0.17 △ | 0.78±0.43 |
| EEBM | ||||||
| Low | 5.03±0.55△ | 0.98±0.13△ | 2.68±0.56△ | 1.61±0.39△ | 0.41±0.22 | 0.74±0.42 |
| Medium | 4.62±0.35△ | 0.89±0.24△ | 3.27±0.67△ | 0.90±0.24△ | 0.32±0.19 | 0.71±0.52 |
| High | 4.74±0.49△ | 0.87±0.29△ | 3.65±0.52△ | 1.30±0.29△ | 0.29±0.14 △ | 0.59±0.31 |
| *P < 0.05, **P < 0.01 compared with normal control group; △P < 0.01 compared with model group. | ||||||
随着给药时间的延长,各组小组体质量均增加。实验结束后,各组小鼠体质量增加的百分率分别为:正常对照组38.1%,模型组52.7%,阳性对照组42.7%,低剂量EEBM组47.6%,中剂量EEBM组45.2%,高剂量EEBM组41.1%;与正常对照组比较,模型组小鼠的体质量增加百分率差异有统计学意义(P < 0.01),表明高脂血症小鼠模型成功建立。与正常对照组比较,模型组小鼠肝指数明显增加(P < 0.01),脾指数增加但差异无统计学意义(P>0.05);与模型组比较,中、高剂量EEBM组和阳性对照组小鼠肝指数明显降低(P < 0.01),低剂量EEBM组小鼠肝指数差异无统计学意义(P>0.05),各剂量EEBM组和阳性对照组小鼠脾指数差异无统计学意义(P>0.05)。
给药6周后,与正常对照组比较,模型组小鼠血清中TC、TG和LDL-C水平明显升高(P < 0.05),HDL-C水平明显降低(P < 0.05),表明高血脂模型成功建立。与模型组比较,各剂量EEBM组和阳性对照组小鼠血清中HDL-C水平明显升高(P < 0.01),TC、TG和LDL-C水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (n=8, x±s) | ||||||
| Group | TC [cB/(mmol·L-1)] | TG [cB/(mmol·L-1)] | HDL-C [cB/(mmol·L-1)] | LDL-C [cB/(mmol·L-1)] | Liver index | Spleen index |
| Normal control | 3.11±0.29 | 0.48±0.14 | 2.26±0.50 | 1.13±0.53 | 0.12±0.09 | 0.08±0.11 |
| Model | 6.08±0.89* | 1.46±0.27* | 1.30±0.32* | 3.38±0.90* | 0.54±0.16 ** | 0.88±0.33 |
| Positive control | 3.26±0.33△△ | 0.50±0.11△△ | 2.67±0.64△△ | 1.15±0.27△△ | 0.19±0.11△△ | 0.54±0.29 |
| EEBM | ||||||
| Low | 4.67±0.95△ | 1.29±0.43 | 2.98±0.90△△ | 1.70±0.34△△ | 0.44±0.19 | 0.72±0.34 |
| Medium | 4.37±1.02△ | 1.08±0.32△△ | 3.11±0.46△△ | 1.12±0.69△△ | 0.29±0.17△△ | 0.67±0.32 |
| High | 4.04±0.54 △△ | 0.94±0.20△△ | 3.32±0.87 △△ | 1.02±0.27△△ | 0.22±0.10 △△ | 0.64±0.27 |
| *P < 0.05, **P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. | ||||||
高脂血症是以血液中的脂蛋白或胆固醇水平增加为特征的疾病,血清TC和LDL-C的增加也是导致心血管系统疾病的主要危险因素。在亚洲和许多其他发展中国家,利用天然药物开发降血脂药物较普遍[18],相关的研究和报道也是科研工作者们关注的热点。天然产物可通过调节多个表观遗传机制来改善心血管疾病和动脉粥样硬化,包括升高HDL-C和降低LDL-C,有报道一些中药材已用于控制高脂血症[19-20]。
本文作者对传统中药淫羊藿的降血脂及抗氧化活性研究结果显示:EEBM具有很好的DPPH清除活性以及较强的体外还原能力,并且抗氧化效果在一定范围内与其浓度呈正相关关系,即随着浓度的增加,其抗氧化能力增强。在高脂饮食诱导的高脂血症小鼠实验中,无论是预防性给药或治疗性给药,高脂血症小鼠血清TC、TG和LDL-C水平均明显升高,HDL-C明显下降,而EEBM组小鼠血清TC、TG和LDL-C水平均降低,血清HDL-C水平均升高,表明EEBM具有显著的降血脂活性及抗氧化活性,其降血脂作用与其有效成分总黄酮类化合物有关,抗氧化活性与其有效成分总酚类化合物有关。本课题组前期研究表明EEBM中淫羊藿总酚和总黄酮质量分数分别为14.3%和74.6%,该结果为本实验提供了有利的数据支持。本研究结果为降血脂药物的开发提供了理论依据。
| [1] | Zhang HF, Yang TS, Li ZZ, et al. Simultaneous extraction of epimedin A, B, C and icariin from Herba Epimedii by ultralsonic technique[J]. Ultrason Sonochem, 2008, 15(4): 376–385. DOI:10.1016/j.ultsonch.2007.09.002 |
| [2] | Ma H, He X, Yang Y, et al. The genus Epimedium:an enthnopharmacological and phytochemical review[J]. Ethnopharmacology, 2011, 134(3): 519–541. DOI:10.1016/j.jep.2011.01.001 |
| [3] | 黄弥娜, 周燕妮, 柳强, 等. HPLC法测定不同产地淫羊藿中7种主要黄酮类成分的含量[J]. 第二军医大学学报, 2015, 36(12): 1352–1355. |
| [4] | 付亮, 袁璟亚, 丁春邦, 等. 四川不同产地淫羊藿总黄酮及淫羊藿苷含量的分析测定[J]. 现代中药研究与实践, 2015, 29(5): 27–31. |
| [5] | 胡彦武, 刘凯, 闫梦彤, 等. 淫羊藿总黄酮及淫羊藿苷的心血管保护作用及机制研究进展[J]. 中国实验方剂学杂志, 2015, 21(13): 227–230. |
| [6] | 赵冰洁, 宋捷, 章丽, 等. 淫羊藿醇提物对去卵巢大鼠骨质疏松治疗作用及机制研究[J]. 中草药, 2016, 47(11): 1919–1925. |
| [7] | 纪昕. 淫羊藿苷免疫调节作用的研究进展[J]. 河北医药, 2016, 38(5): 753–755, 756. |
| [8] | 杨晓旭, 王宇, 薛迪, 等. 基于抗衰老抗氧化作用的淫羊藿拆分组分筛研究[J]. 辽宁中医药大学学报, 2016, 18(2): 11–14. |
| [9] | 陈发菊, 石京山, 吴芹. 淫羊藿抗衰老作用及其机制研究[J]. 中国药理学通报, 2015, 31(B11): 17. |
| [10] | 贾东升, 贾晓斌, 施峰, 等. 淫羊藿苷元脂质体的制备及其对大鼠骨髓基质细胞增殖分化影响的研究[J]. 中国药学杂志, 2010, 45(3): 353. |
| [11] | 陈伟伟, 隋辉, 马丽媛. 中国心脑血管病流行现状及防治进展[J]. 心脑血管病防治, 2016, 16(2): 79–83. |
| [12] | 张圆, 姚家忠. 心脑血管疾病的病因分析与探讨[J]. 医学美学美容:中旬刊, 2015(1): 546. |
| [13] | 高树友, 王传智. 心脑血管疾病的病因与预防[J]. 医药卫生:文摘版, 2016(2): 15. |
| [14] | 宋媛媛, 杜丽萍, 王藴怡, 等. 他汀类药物在临床应用中的不良反应及产生机制[J]. 中国生化药物杂志, 2016, 37(1): 174–177, 182. |
| [15] | Karabegovic IT, Veljkovic VB, Lazic ML. Ultrasound-assisted extraction of total phenols and flavonoids from dry tobacco (Nicotiana tabacum) leaves[J]. NatProdCommun, 2011, 6(12): 1855–1856. |
| [16] | Singleton VL, Orthofer R, Lamuela-Raventós RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J]. Methods Enzymol, 1999, 299C(1): 1521–178. |
| [17] | Prathapan A, Krishna MS, Nisha VM, et al. Polyphenol rich fruit pulp of Aegle marmelos Correa exhibits nutraceutical properties to down regulate diabetic complications-An in vitro study[J]. Food ResInt, 2012, 9(48): 690–695. |
| [18] | 王高超. 中药降血脂中的降血脂单味中药药物疗效研究[J]. 医药卫生:全文版, 2016, 6(3): 189. |
| [19] | Dahanukar SA, Kulkarni RA, Rege NN. Pharmacology of medicinal plants and natural products[J]. Indian J Pharmacol, 2000, 32: S81–S118. |
| [20] | 仝晨均, 付晓丽, 付余, 等. 左旋肉碱对肥胖患者血脂水平影响的Meta分析[J]. 郑州大学学报:医学版, 2015, 50(2): 214–217. |
 2017, Vol. 43
2017, Vol. 43


