扩展功能
文章信息
- 季红, 贾荣, 郭鑫
- JI Hong, JIA Rong, GUO Xing
- 大孔树脂对山葡萄籽多酚提取物的纯化工艺优选
- Optimization of purification technology for polyphenols from vitis amurensis seed extract with macroporous resins
- 吉林大学学报(医学版), 2017, 43(06): 1272-1277
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1272-1277
- 10.13481/j.1671-587x.20170639
-
文章历史
- 收稿日期: 2017-10-17
2. 内蒙古自治区包头市医疗机构药品和医用耗材 网上集中采购服务管理中心, 内蒙古 包头 014010
2. Online Centralized Purchasement Service Management Center for Drug and Medical Consumables of Medical Institution, Baotou City, Inner Mongolia Autonomous Region, Baotou 014010, China
山葡萄多酚是从山葡萄籽中提取的天然植物多酚类活性化合物,该类化合物具有抗氧化和抗衰老作用,同时具有保护血管和心肌缺血等功能[1-8],有很高的食用价值和药用价值。近年来已被广泛应用在医药、食品和保健等多行业中,但目前各种方法提取得到的山葡萄多酚纯度较低,有效成分浓度过低势必会影响葡萄多酚生理活性的发挥。研究[9-10]表明:大孔树脂吸附法是目前制备多酚的最佳生产工艺。大孔树脂具有稳定性高、吸附和解吸容易、再生简单及树脂可以重复利用等特点。树脂吸附法具有工艺操作简单、生产周期短、生产成本低、溶剂易回收、吸附和解吸效果良好等优点,被广泛用于天然产物中生物活性物质的分离和纯化,尤其适用于多酚类化合物的纯化,大孔树脂纯化后的多酚不仅浓度高,且很好地保留了多酚的生物活性[11]。但相关文献[12-13]报道的大多是大孔树脂对葡萄皮和葡萄枝条中多酚的纯化,对山葡萄籽多酚提取物的纯化尚未见报道,为了充分利用山葡萄野生资源,本研究利用AB-8型大孔树脂对山葡萄籽粗提物进行纯化,旨在提高山葡萄籽多酚的纯度和利用率,以增强其生理和药理活性,将酿酒后产生的山葡萄籽变废为宝。该纯化方法成本低,简单易行,具有广阔的开发应用前景。
1 材料与方法 1.1 样品和主要试剂山葡萄籽多酚粗提物为吉林大学药学院药物分析教研室自制棕色粉末[14],纯度为35.02%。上柱液为多酚粗提物加入蒸馏水超声溶解。AB-8大孔吸附树脂购于天津南开大学有限责任公司,没食子酸对照品为中国药品生物制品检定所提供,乙醇和碳酸钠等试剂均为分析纯。
1.2 仪器AB204-E分析天平(瑞士),AB204-E电子天平(上海实验仪器厂),KQ3200DE型医用数控超声波清洗器(昆山市超声仪器有限公司),SHH W21-Cr三用电热恒温水箱(北京长安科学仪器厂),RE-52A旋转蒸发器(上海亚荣生化仪器厂),722可见分光光度计(上海精密科学仪器有限公司),D2F-6020型真空干燥箱(上海博迅实业有限公司)。
1.3 山葡萄多酚提取液的制备和多酚浓度的测定称取一定量的山葡萄籽多酚粗提物粉末,加入蒸馏水适量,超声溶解,制备成不同浓度的样品溶液,备用。采用Folin-Ciocalteu比色法[15]分别测定样品溶液、吸附液和洗脱液中山葡萄籽多酚的浓度。
1.4 树脂预处理和树脂柱洗脱将AB-8大孔树脂采用95%乙醇浸泡24 h充分溶胀后,取适量树脂置于玻璃层析柱中,采用95%乙醇流动清洗至加入蒸馏水无浑浊现象产生,再用大量蒸馏水冲洗至无乙醇味。将样品溶液上柱,静置吸附饱和后,用蒸馏水洗脱至Molish反应为阴性,再用60%乙醇溶液进行洗脱,收集洗脱液。
1.5 大孔树脂静态学性能的测定 1.5.1 大孔树脂的静态吸附和解吸性能测定准确称取预处理好的大孔树脂1 g,平行取3份,分别置于具塞锥形瓶中,精密加入一定浓度的样品溶液20 mL,室温避光放置24 h至饱和吸附,取上清液分别测定多酚浓度,根据公式计算饱和吸附量和吸附率。饱和吸附量(mg/g)=(C0-C1)V0/M,吸附率=(C0-C1)/C0×100%。计算公式中C0为吸附前的多酚溶液浓度(g·L-1),C1为吸附后多酚溶液浓度(g·L-1),V0为吸附液体积(mL),M为树脂质量(g)。将上述吸附饱和的3份大孔树脂过滤,蒸馏水冲洗,滤干,置于具塞锥形瓶中,加入60%乙醇溶液20 mL,间隔振摇,室温避光放置24 h,吸取上清液分别测定多酚浓度,根据公式计算解吸率。解吸率= C2/(C0-C1) ×100%。计算公式中C2为解吸后的多酚溶液浓度(g·L-1)。
1.5.2 静态吸附动力学曲线的绘制准确称取预处理好的大孔树脂1 g,置于具塞锥形瓶中,加入20 mL浓度为10 g·L-1样品溶液,分别于0.5、1、2、3、4、5、6、10、12和24 h依次取上清液,测定其多酚浓度,根据公式计算吸附率,以多酚吸附率为纵坐标,吸附时间为横坐标,绘制静态吸附动力学曲线。
1.5.3 不同上样浓度下大孔树脂的吸附率配制浓度为3、5、8、10和15 g·L-1样品溶液,分别上样于经预处理后的大孔树脂柱,进行静态吸附试验,计算各浓度样品的吸附率,考察上样浓度不同时大孔树脂的吸附率。
1.5.4 不同乙醇浓度下大孔树脂的解吸率准确称取预处理的干树脂1 g,平行取5份,分别置于100 mL具塞锥形瓶中,各加入浓度为10 g·L-1样品溶液20 mL,室温放置24 h至饱和吸附后,滤过,分别加入20 mL浓度为20%、40%、60%、80%和100%的乙醇溶液进行洗脱,放置24 h后吸取上清液,测定多酚浓度,计算解吸率,考察乙醇浓度不同时大孔树脂的解吸率。
1.6 大孔树脂动态学性能的测定将预处理好的AB-8大孔树脂湿法装柱,蒸馏水平衡,加入一定量多酚样品溶液,充分吸附后,先用蒸馏水洗去除多糖、蛋白质等杂质,再用乙醇溶液洗脱,收集合并乙醇洗脱液,计算多酚浓度。分别考察不同上样流速(mL·min-1)、洗脱流速(mL·min-1)、洗脱液体积(BV)时大孔树脂吸附率和解吸率。
1.6.1 不同上样流速时大孔树脂的吸附率准确量取经预处理过的湿树脂30 mL湿法装柱,以浓度为10 g·L-1的样品溶液上柱,上液体积为30 mL,考察上样流速为1、2和3 mL·min-1时大孔树脂的吸附率。
1.6.2 不同洗脱液流速时大孔树脂的解吸率采用浓度为60%乙醇,分别选择流速1、2和3 mL·min-1对吸附多酚的饱和吸附树脂柱进行动态洗脱,洗脱液用量为30 mL,测定洗脱液中多酚浓度,计算解吸率。
1.6.3 动态洗脱曲线的绘制吸取浓度为10 g·L-1样品溶液,以3 mL·min-1的流速进行动态吸附,待吸附饱和后,先用蒸馏水洗脱至中性,再用60%乙醇以2 mL·min-1流速进行动态洗脱,每隔一定体积收集乙醇洗脱液,分别测定多酚浓度,以多酚浓度(g·L-1)为纵坐标,洗脱液体积(BV)为横坐标,绘制动态洗脱曲线。
1.6.4 样品多酚回收率和多酚纯度取预处理好的AB-8大孔树脂2 000 mL,湿法装柱,将浓度为10 g·L-1山葡萄籽多酚样品溶液上柱后,按上述优选工艺进行吸附解吸试验后,加入足量蒸馏水洗至无乙醇味,重复将样品溶液上柱,如此反复操作3次,分别收集乙醇洗脱液,回收乙醇,浓缩,真空干燥,定量,根据公式计算样品多酚回收率及浓度。回收率=(测得量-样品浓度)/加入量×100%。多酚浓度=C×N/M×100%。计算公式中C为样品浓度(g·L-1),N为稀释倍数,M为称样质量(g)。
2 结果 2.1 大孔树脂的静态学性能 2.1.1 大孔树脂静态吸附和解吸率AB-8大孔树脂的平均饱和吸附量可达到66.60 mg·g-1,平均吸附率可达到90.48%,吸附性能良好;AB-8大孔树脂的平均解吸率可达到71.42%,解吸性能良好。见表 1。
| Resin number | Initial concentration[ρB/(g·L-1)] | Equilibrium concenration[ρB/(g·L-1)] | Desorption concentration[ρB/(g·L-1)] | Saturated adsorption amount[ρB/(g·L-1)] | Adsorption rate(η/%) | Desorption rate(η/%) |
| 1 | 3.68 | 0.33 | 2.40 | 67.01 | 91.03 | 71.64 |
| 2 | 3.68 | 0.3 | 2.36 | 66.20 | 89.95 | 71.15 |
| 3 | 3.68 | 0.35 | 2.38 | 66.60 | 90.45 | 71.47 |
| Average | 3.68 | 0.35 | 2.38 | 66.60 | 90.48 | 71.42 |
吸附速度是反映树脂吸附性能的重要参考指标,AB-8大孔树脂对山葡萄籽多酚的吸附速度在0~5 h内上升较快,5~6 h吸附速度变缓,6 h之后吸附速度趋于稳定,吸附率可达到90%,说明静态吸附时间以6 h为宜。见图 1。
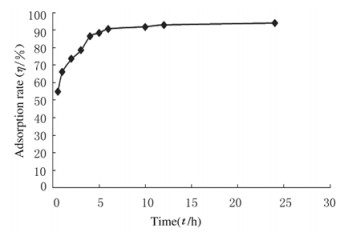
|
| 图 1 大孔树脂的静态吸附动力学曲线 Figure 1 Static adsorption curve of macroporous resin |
|
|
在考察浓度范围内,样品浓度对吸附效果的影响不大。为了提高树脂的使用效率,缩短多酚饱和吸附的时间,同时避免发生穿透。综合考虑本实验选择10 g·L-1作为上样浓度。见图 2。
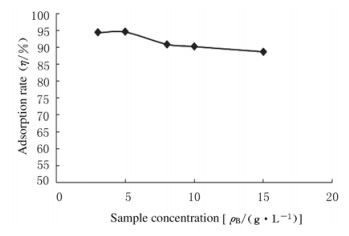
|
| 图 2 不同样品浓度时大孔树脂的吸附率曲线 Figure 2 Curve of adsorption rates of macroporous resin with different concentrations of sample |
|
|
在乙醇浓度考察范围内,树脂解吸率随乙醇浓度的增大呈逐渐上升趋势,乙醇浓度为20%~60%时,树脂的解吸率上升趋势较快,乙醇浓度为60%~100%时,树脂的解吸率上升趋势不明显。且在实际生产中,高浓度溶剂易挥发,生产成本也有所增加,故本实验选择60%乙醇为最佳洗脱剂。见图 3。
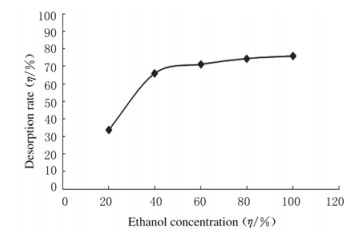
|
| 图 3 不同乙醇浓度时大孔树脂的解吸率曲线 Figure 3 Curve of desorption rates of macroporous resin with different concentrations of ethanol |
|
|
上样流速不同对树脂吸附率影响不大,随着上样流速的增加吸附率有所降低,但降低幅度小。上样流速慢虽有利于树脂对多酚物质的吸附,但会降低树脂吸附的效率,考虑在实际应用中,流速过低会增加生产周期,降低工作效率,因此,综合考虑选择3 mL·min-1作为上样流速。见图 4。

|
| 图 4 不同上样流速时大孔树脂的吸附率曲线 Figure 4 Curve of adsorption rates of macroporous resin with different flowing speeds of sample |
|
|
洗脱液流速的增加对解吸率影响明显,随着洗脱速度的增大,解吸率逐渐减小,洗脱液速度为1 mL·min-1时解吸率达到最大。在实际应用中洗脱流速过快,目标物质未充分吸附便流出,造成浪费,而洗脱流速过慢则耗费工时,增加成本,故选择洗脱液流速为2 mL·min-1。见图 5。
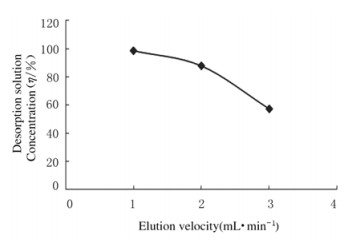
|
| 图 5 不同洗脱液流速时大孔树脂的解吸率曲线 Figure 5 Curve of desorption rates of macroporous resin with different flowing seeds of elution velocity |
|
|
AB-8大孔树脂对山葡萄籽多酚具有良好的洗脱效果,当洗脱液体积达到20 mL时,多酚开始被洗脱下来,洗脱液体积达到60 mL时,多酚基本均被洗脱下来,且解吸峰集中,对称,拖尾峰不明显。因此,将多酚洗脱完全需要2倍柱床体积的洗脱液。见图 6。

|
| 图 6 大孔树脂的动态洗脱曲线 Figure 6 Dynamic desorption curve of macroporous resin |
|
|
大孔树脂重复使用3次对多酚回收率及浓度影响不大,AB-8大孔树脂重复使用性能好,多酚回收率平均为63.95%,纯化后的多酚平均浓度为88.04%。见表 2。
| (η/%) | ||
| Group | Recovery rate | Concentration |
| 1 | 63.68 | 87.83 |
| 2 | 64.25 | 88.16 |
| 3 | 63.91 | 88.14 |
| Average | 63.95 | 88.04 |
按照上述优选工艺对3批山葡萄籽多酚粗提物进行纯化,分别对纯化前后山葡萄籽提取物中的多酚浓度进行测定,3批山葡萄籽多酚粗提物的多酚平均浓度为35.02%,经大孔树脂纯化后的山葡萄籽多酚平均浓度为88.80%,纯化后的山葡萄籽多酚浓度是山葡萄籽粗提物中多酚浓度的2.5倍。
3 讨论近年来,葡萄多酚作为一种天然高效的抗氧化剂,已被广泛应用于食品、药品和保健品等多个领域,因此对山葡萄籽中多酚类物质进行开发和利用极具前景,本研究前期采用超声波辅助乙醇提取山葡萄籽多酚,工艺简单,方法可行,多酚获得率尚可,但多酚纯度较低,为了提高目标产物多酚纯度,更好地开发和利用野生山葡萄资源,对山葡萄籽中多酚的纯化工艺做进一步研究具有一定的现实意义。目前,多酚类化合物的纯化方法众多,如大孔树脂法、溶剂萃取法和沉淀法等,其中溶剂萃取纯化法虽然操作简单,但溶剂消耗量大、毒性大,成本相对较高,环境污染严重;离子沉淀法溶剂用量少、设备工艺较简单、生产安全性好,但在制备过程中具有多酚易被氧化、产品纯度低等缺点,使其广泛应用受到了限制[16]。
本研究根据多酚的结构特点并结合文献[17-18]综述,在前期研究[14-15]的基础上,着重研究了山葡萄籽多酚的纯化工艺,选用AB-8型大孔树脂,通过静态和动态吸附解吸实验,分别考察上样浓度、上样流速、洗脱液浓度和体积、洗脱流速等因素对吸附率和解吸率的影响,最终确定山葡萄籽多酚纯化最佳工艺条件。本研究结果表明:上样溶液浓度为10 g·L-1、上样流速为3 mL·min-1时,吸附效果最好;乙醇浓度为60%、洗脱流速为2 mL·min-1、解吸液体积为2倍柱体积时,解吸效果最好;在该吸附解吸条件下,山葡萄籽多酚的浓度提高了2.5倍。山葡萄籽多酚粗提物经AB-8大孔树脂纯化后,多酚浓度远高于山葡萄籽粗提物,采用AB-8大孔吸附树脂纯化山葡萄籽粗提物,操作简单、安全,经济效益好,纯化后的山葡萄多酚具有很高的应用价值,纯化条件可为工业生产提供理论参考,同时也拓宽了山葡萄的综合利用途径,具有很好的应用前景。
| [1] | 崔长伟, 刘丽媛, 王华, 等. 山葡萄综合开发利用研究进展[J]. 食品科学, 2015, 36(13): 276–282. DOI:10.7506/spkx1002-6630-201513051 |
| [2] | 高兆允, 陈守臻, 史本康. 葡萄多酚对糖尿病大鼠膀胱功能的保护作用及其机制探讨[J]. 山东医药, 2016, 56(14): 4–6. DOI:10.3969/j.issn.1002-266X.2016.14.002 |
| [3] | 聂相珍, 申丽媛. 葡萄皮渣多酚提取及其对五种食源性致病菌的抑制作用[J]. 中国酿造, 2016, 35(9): 101–105. DOI:10.11882/j.issn.0254-5071.2016.09.023 |
| [4] | 焦淑萍, 倪海镜, 杜培革. 山葡萄多酚对大鼠红细胞膜结构稳定性的影响[J]. 吉林大学学报:医学版, 2006, 32(5): 829–831. |
| [5] | 王尔孚, 焦淑萍, 尹桂春. 山葡萄多酚对辐射小鼠红细胞免疫功能的影响[J]. 北华大学学报, 2008, 9(1): 32–33. |
| [6] | 高维明, 焦淑萍. 野生山葡萄多酚对大鼠心肌缺血的保护作用[J]. 中国公共卫生, 2005, 21(7): 849–850. DOI:10.11847/zgggws2005-21-07-48 |
| [7] | 焦淑萍, 倪海镜, 薛丽娟. 山葡萄多酚对大鼠心肌线粒体氧化损伤的保护作用[J]. 吉林大学学报:医学版, 2008, 34(1): 117–119. |
| [8] | Fu YC, Jin XP. The effects on cell growth of tea polyphenols acting as a stronganti-peroxidatant and an inhibitor of apoptosisinprmiary cultured rat skin cells[J]. Biomed Environ Sci, 2000, 13(3): 170–179. |
| [9] | 张旭, 陈丹, 曹丽娟, 等. 5种大孔树脂纯化鲜核桃青皮汁多酚工艺的比较[J]. 中成药, 2016, 38(8): 1852–1855. |
| [10] | Kammerer J, Kammerer DR, Jensen U, et al. Interaction of apple polyphenols in a multi-compound system upon adsorption onto a food-grade resin[J]. J Food Engin, 2010, 96(4): 544–554. DOI:10.1016/j.jfoodeng.2009.08.038 |
| [11] | Sahin S, Amll R. Optimization of olive leaf extract obtained by ultrasound-assisted extraction with response surface methodology[J]. Ultrason Sonochem, 2013, 20(1): 595–602. DOI:10.1016/j.ultsonch.2012.07.029 |
| [12] | 齐岩, 孙金月, 程安玮, 等. 葡萄皮多酚的提取、纯化及组成研究[J]. 中国食物与营养, 2016, 22(8): 58–62. |
| [13] | 张静, 高园, 万力, 等. 大孔吸附树脂分离纯化葡萄枝条中多酚类物质[J]. 西北农业学报, 2013, 22(3): 173–177. |
| [14] | 贾荣, 季红. 超声波辅助乙醇提取山葡萄籽多酚的工艺研究[J]. 吉林大学学报:医学版, 2017, 43(1): 190–195. |
| [15] | 贾荣, 倪海镜, 赵春芳, 等. 山葡萄籽提取物中总多酚的含量测定[J]. 吉林大学学报:医学版, 2009, 35(5): 877–879. |
| [16] | 林樱姬, 赵萍, 王雅. 植物多酚的提取方法和生物活性研究进展[J]. 陕西农业科学, 2009, 55(6): 105–107. |
| [17] | 张立华, 董业成, 张元湖. 大孔吸附树脂纯化石榴花多酚的工艺[J]. 江苏农业科学, 2015, 43(10): 359–361, 362. |
| [18] | 林枞雨, 王鑫, 李鉴昊, 等. 甜玉米芯多酚纯化工艺研究[J]. 农产品加工(上), 2017(2): 43–47. |
 2017, Vol. 43
2017, Vol. 43


