扩展功能
文章信息
- 彭印印, 陈礼平, 刘林, 陈建斌, 陈亚娟, 韩晓黎, 肖青
- PENG Yinyin, CHEN Liping, LIU Lin, CHEN Jianbin, CHEN Yajuan, HAN Xiaoli, XIAO Qing
- 利妥昔单抗致间质性肺疾病1例报告及文献复习
- Rituximab-induced interstitial lung disease:A case report and literature review
- 吉林大学学报(医学版), 2017, 43(06): 1260-1264
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1260-1264
- 10.13481/j.1671-587x.20170636
-
文章历史
- 收稿日期: 2016-11-28
2. 重庆医科大学附属第一医院呼吸内科, 重庆 400016
2. Department of Respiratory Medicine, First Affiliated Hospital, Chongqing Medical University, Chongqing 400016, China
利妥昔单抗(rituxinab,RTX)商品名为美罗华,是由罗氏公司生产的全球第一个被批准用于临床治疗的单克隆抗体。RTX是一种人/鼠嵌合的单克隆抗体,能特异性地与跨膜抗原CD20结合,目前已作为CD20(+)的非霍奇金淋巴瘤的一线治疗药物,也可作为免疫抑制剂用于一些自身免疫性疾病的治疗。RTX作为一种生物制剂,临床上常见的不良反应是轻微的过敏反应,其次为中性粒细胞减少、血小板减少、头痛、腹痛、心律失常及乙肝病毒的再激活等[1]。在RTX的早期应用中,鲜见关于其治疗过程中导致间质性肺病(interstitial lung disease,ILD)的报道,但近年来,关于RTX相关的间质性肺病(RTX-ILD)报道越来越多,RTX-ILD起病隐匿,临床症状不典型,一旦出现症状往往病情急、重,病情进展快,病死率高[2],早期诊断和治疗显得尤其重要。本文作者对本院治疗的1例RTX-ILD患者的临床资料进行报道,并对相关文献进行回顾性分析,以提高临床医师对RTX-ILD的认识。
1 临床资料患者,男性,19岁,2年多前因“低热、盗汗”于本院发现颈部淋巴结肿大,经淋巴结活检等相关检查确诊为经典型霍奇金淋巴瘤,富淋巴细胞性,Ⅱ期B组。给予ABVD方案化疗后肿大的淋巴结缩小并消失,共行ABVD方案化疗共12个疗程。1年前再次因颈部包块入本院,行颈部包块活检提示淋巴瘤复发,因活检提示CD20(+),给予CHOP+MTX方案化疗2次后遂行R-MOED方案动员并给予R-AEAC方案预处理后于2016年1月12日和2016年1月13日行自体造血干细胞移植(HSCT)。移植过程顺利,恢复情况尚可,移植后2个月开始每月以375 mg·m-2RTX维持化疗,给予2次RTX维持治疗后,胸部CT显示:纵隔肿大淋巴结大小约为18 mm×17 mm,考虑纵隔复发,于肿瘤科行纵隔残留病灶放疗(30 Gy/15 F),放射治疗1次后再次行RTX维持治疗,3次RTX维持治疗后继续行纵隔放射治疗。放射治疗后10 d,第3次RTX维持治疗后第8天,患者出现活动后呼吸困难,伴发热、咳嗽、胸闷、乏力,最高体温39℃,胸部CT显示:双肺多发斑片状磨玻璃影(图 1A和B)。患者化疗后、放疗过程中,抵抗力低,考虑肺部感染可能性大,遂终止放疗,立即给予亚胺培南/西司他丁钠+万古霉素抗感染,患者症状无明显改善,结合患者胸部CT检查结果提示双肺弥漫磨玻璃影,真菌感染及肺孢子菌肺炎(PCP)亦不能完全除外,遂经验性地加用卡泊芬净抗真菌、磺胺抗PCP治疗,之后患者体温为38℃左右,较之前有下降趋势,但呼吸困难症状改善不明显,并呈进行性加重,于抗真菌治疗3 d后行支气管镜检查,提示各支气管黏膜稍充血,灌洗液送检抗酸染色为阴性,癌细胞为阴性,一般细菌及真菌培养、病毒DNA定量均为阴性,真菌G试验及GM试验均阴性,肺孢子菌检查阴性。随访胸部CT显示:双肺斑片状磨玻璃样影迅速增加,且呈游走性改变,即起病时双肺磨玻璃病灶以下肺为主,现下肺病灶好转,上肺病灶增加(图 1C和D)。血气分析提示:低氧血症,氧合指数<200。多次痰培养均未见典型致病菌以及真菌。血病毒DNA阴性,支原体和衣原体抗体正常。各项检查均无明显感染证据,结合患者明确的RTX使用史,双肺病灶呈游走性改变,考虑为RTX-ILD,立即停用上述抗菌药物,给予40 mg·d-1甲基强的松龙治疗,5 d后患者症状明显改善,复查胸部CT提示双肺病灶吸收(图 1E和F),故激素减量为口服30 mg·d-1强的松,后激素逐渐减量,直至8周后停用,复查胸部CT提示病灶完全吸收。目前患者一般状态良好,停用RTX,动态随访中,疾病仍处于完全缓解状态。
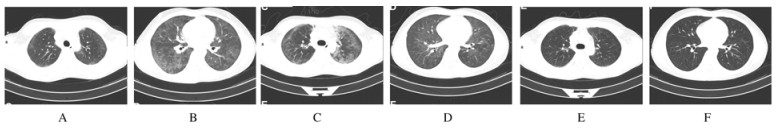
|
| A, C, E: Upper lung; B, D, F: Lower lung; A, B: Initial; C, D: After 1 week anti-infection therapy; E, F: After 5 d hormonotherapy. 图 1 RTX-ILD患者胸部CT图像 Figure 1 CT images of chest of RTX-ILD patient |
|
|
RTX是由鼠抗CD20单克隆抗体288的可变区和人源IgGlγ1重链及κ轻链的恒定区组成的人鼠嵌合型单克隆抗体[3],是最先被用于治疗肿瘤的单抗。RTX可以和成熟B淋巴细胞和前B细胞膜表面的CD20抗原特异性结合,引起免疫反应,抑制B细胞增殖,诱导B细胞凋亡,而不与成熟后的B淋巴细胞、浆细胞、造血干细胞以及造血细胞系结合。RTX通过补体依赖的细胞毒作用和抗体依赖的细胞毒作用以及启动细胞凋亡信号通路、增加肿瘤细胞对药物的敏感性等多种途径杀伤B细胞,产生抗肿瘤效应[4],RTX与化疗联合使用可提高疗效且耐受性好。
RTX至上市以来,其不仅可使CD20(+)的B细胞淋巴瘤缓解率明显提高,在免疫相关疾病中亦显示出良好的疗效,其安全性和疗效均得到了临床的广泛认可。但近年来,RTX-ILD报道逐渐增多,既往研究报道RTX-ILD发病率不到0.03%,而目前统计[2-3, 5-7]其发病率为3.5%~16.7%。RTX-ILD可发生于任何年龄,多数为RTX联合其他化疗药物,少数为RTX单药化疗,RTX-ILD多出现在RTX治疗后的2~6个周期,最多见于治疗后的4周期,累及剂量达1 500 mg·m-2,或总量达到2 595 mg [8],多发生于最后一次RTX输注后2周左右。基础疾病绝大多数为B细胞肿瘤,尤其是弥漫大B细胞淋巴瘤更为常见,其他少见的有华氏巨球蛋白血症、特发性血小板减少性紫癜、系统性红斑狼疮、类风湿关节炎和局灶节段性肾小球硬化等自身免疫病。
2.2 RTX-ILD的发病机制RTX-ILD的发病机制目前尚不完全清楚。目前认为其可能是由多种机制共同作用,包括B细胞信号通路激活、补体活化、直接启动细胞凋亡和补体依赖的细胞毒作用等[9]。有学者[10]提出“细胞毒T细胞二次激活学说”,该学说认为RTX-ILD是由RTX输注后介导了B细胞凋亡,继发细胞毒性T淋巴细胞激活、细胞因子释放和补体激活引起。RTX输注后补体C3b/c、C4b/c和细胞因子(肿瘤坏死因子、白细胞介素6、白细胞介素8)水平明显升高,其中肿瘤坏死因子是产生RTX-ILD的主要细胞因子[3]。Liu等[6]发现:日本和中国人群RTX-ILD的发病率呈逐渐升高趋势,并提出该人群具有药物诱导性ILD的遗传易感性假说,因此RTX-ILD可能还存在一定的遗传易感性。此外,还有学者[11]认为RTX-ILD的发生与细胞刺激因子的使用有关。2014年,Kong等[12]报道了Nod样受体蛋白3(NLRP3)炎性体、凋亡相关斑点样蛋白和半胱氨酸天冬氨酸蛋白酶1和CD19阳性在肺间质浸润细胞中呈高表达,表明RTX-ILD可能与NLRP3炎性体有关,具体原因有待进一步研究。
2.3 RTX-ILD的临床特点RTX-ILD临床表现并无明显特异性,最常见的临床症状为呼吸困难、发热和咳嗽,肺部听诊部分可闻及爆裂音。Hadjinicolaou等[7]报道:RTX-ILD患者呼吸困难发生率约为70.7%,发热发生率为40.2%,咳嗽发生率为32.6%,其他症状还包括喘息、咯血、胸痛、皮疹和乏力等,20.7%的患者临床症状不明显,主要是通过CT或PET-CT确诊,肺部听诊只有13%的患者有弥漫性啰音。胸部影像学检查结果显示弥漫性磨玻璃样浸润影,且多呈游走性表现,多数患者应用广谱类抗生素治疗无效。肺功能检查结果显示为限制性通气功能障碍、弥散功能降低及低氧血症。肺活组织检查主要表现为毛细支气管机化性肺炎、间质性肺炎、肺纤维化、弥漫性肺泡损伤和肺泡出血等[3]。该患者于使用RTX3个疗程后出现呼吸困难、发热、咳嗽、胸闷、乏力,胸部CT提示双肺弥漫性磨玻璃样改变,气管镜下提示黏膜充血,与文献[2-3, 5-8]报道结果一致。
2.4 RTX-ILD的诊断和鉴别诊断RTX-ILD的诊断属于排除性诊断,尚无确诊的诊断标准,主要依据患者有明确的RTX用药史,约4个疗程后出现无明确诱因的发热、呼吸困难、咳嗽和疲乏等典型的临床表现,血气分析提示无肺栓塞等其他病因所致的低氧血症,肺功能检查结果提示:限制性通气功能障碍、弥散功能降低;肺部影像学检查提示双肺弥漫性磨玻璃样改变。此外还需重点排除肺部感染、肿瘤的肺部浸润等引起ILD的其他病因。支气管镜检查并肺泡灌洗和肺活检,在排除感染和肿瘤浸润时是必要的。该患者有明确的RTX用药史,于RTX使用3个疗程后出现呼吸困难、发热、咳嗽、胸闷、乏力,胸部CT影像提示双肺弥漫性磨玻璃样改变,血气分析结果提示低氧血症,因患者处于放疗中,但放疗剂量较小且时间较短,暂不考虑放射性肺炎,同时因放化疗后抵抗力低,首先考虑特殊菌群感染,先后给予抗细菌及抗真菌治疗效果均不理想。后续反复多次行病原学检查均阴性,支气管镜检查仍未见明显异常,胸部CT提示双肺磨玻璃病变,且呈现游走性改变,故考虑诊断为RTX-ILD。
2.5 RTX-ILD的治疗方法一旦高度怀疑或明确RTX-ILD,需立即停用RTX,应用糖皮质激素,严重者需行机械辅助通气等对症支持。患者症状改善后激素应逐渐减量。关于激素用量,通常是选择相当于1 mg ·kg-1·d-1泼尼松,更大剂量的激素并不能增加疗效[9]。对于药物引起的ILD一般治疗原则可遵循[13]:①对于轻微症状患者(PaO2 ≥80 mmHg),立刻停止使用可疑药物。②对于中等症状患者(60 mmHg<PaO2<80 mmHg),除暂停使用可疑药物及其他能引起肺损伤的药物和条件外,应接受相当于0.5~1.0 mg·kg-1·d-1泼尼松剂量的皮质类固醇类药物治疗,2~4周后逐渐减量为20 mg·d-1,快速减量剂量或停止治疗可能使病情出现复发及加重。③对于严重症状患者(PaO2<60 mmHg),不仅要停止使用可疑药物,还可使用糖皮质激素冲击疗法,如甲泼尼龙500~1000 mg·d-1,持续3d,待病情稳定后改为相当于0.5~1.0 mg·kg-1·d-1泼尼松剂量的类固醇类药物口服治疗,2~4周后逐渐减量。对激素反应差者,Leon等[14]提出:由于部分患者肺活检病理提示有广泛的肺小血管血栓形成和大量T淋巴细胞浸润,故抗凝剂和抗T细胞的免疫抑制剂,如环孢素、他克莫司等可作为临床治疗的选择。此外,肿瘤坏死因子在RTX-ILD中起主导作用,故使用抗肿瘤坏死因子的抗体亦有一定的有效率,且一般治疗越早,预后越好。该患者确诊为RTX-ITD后,因PaO2=70 mmHg,按照中等症状患者(60 mmHg<PaO2<80 mmHg)的治疗方案,立即停用RTX并静脉予以甲强龙40 mg·d-1治疗5 d,激素用量约等同于1 mg·kg-1·d-1的泼尼松,后症状好转,5 d后激素减量为强的松30 mg·d-1,后每周减量5 mg,直至3周后减量为20 mg·d-1,逐渐减量,直至8周后停用。现患者一般情况尚可,病情稳定。
2.6 RTX-ILD患者的预后RTX-ILD患者的预后差异较大。部分患者对激素治疗有效,临床症状及影像学表现均改善明显,预后较好,对激素反应不良者预后差。Bitzan等[15]研究发现:机械通气是死亡结局的显著预测因子。
RTX-ILD是一种临床相对罕见但有可能致命的肺部病变,其临床表现缺乏特异性。本文作者报道了本院收治的1例RTX-ILD患者的诊治过程,并通过文献回顾进行学习和总结,以提高临床医师对RTX-ILD的认识,减少漏诊及误诊,对该疾病做到早发现、早诊断和早治疗。
| [1] | Kasi PM, Tawbi HA, Oddis CV, et al. Clinical review:serious adverse events associated with the use of rituximab-a critical care perspective[J]. Crit Care, 2012, 16(4): 231. DOI:10.1186/cc11304 |
| [2] | 平宝红, 岳春燕, 朱阳敏, 等. 利妥昔单抗相关的间质性肺炎文献复习:附2例报告[J]. 南方医科大学学报, 2015, 35(1): 129–132. |
| [3] | Naqibullah M, Shaker SB, Bach KS, et al. Rituximab-induced interstitial lung disease:five case reports[J]. Eur Clin Respir J, 2015, 2(1): 27178. DOI:10.3402/ecrj.v2.27178 |
| [4] | Zhou X, Hu W, Qin X. The role of complement in the mechanism of action of rituximab for B-cell lymphoma:implications for therapy[J]. Oncologist, 2008, 13(9): 954–966. DOI:10.1634/theoncologist.2008-0089 |
| [5] | 吕慧娟, 董玲, 李维, 等. 利妥昔单抗相关间质性肺炎的临床分析[J]. 中国肿瘤临床, 2016, 43(7): 291–297. |
| [6] | Liu X, Hong XN, Gu YJ, et al. Interstitial pneumonitis during rituximab-containing chemotherapy for non-Hodgkin lymphoma[J]. Leuk Lymphoma, 2008, 49(9): 1778–1783. DOI:10.1080/10428190802270886 |
| [7] | Hadjinicolaou AV, Nisar MK, Parfrey H, et al. Non-infectious pulmonary toxicity of rituximab:a systematic review[J]. Rheumatology(Oxford), 2012, 51(4): 653–662. DOI:10.1093/rheumatology/ker290 |
| [8] | Fernández Casares M, Espósito G, González A, et al. Rituximab-induced interstitial lung disease[J]. Medicina (B Aires), 2013, 73(4): 343–345. |
| [9] | Wagner SA, Mehta AC, Laber DA. Rituximab-induced interstitial lung disease[J]. Am J Hematol, 2007, 82(10): 916–919. DOI:10.1002/(ISSN)1096-8652 |
| [10] | Subramanian M, Manjunath R, Kilara N, et al. Rituximab-induced subacute interstitial pneumonitis:a case report and review of literature[J]. J Cancer Res Ther, 2010, 6(3): 344–346. DOI:10.4103/0973-1482.73356 |
| [11] | Katsuya H, Suzumiya J, Sasaki H, et al. Addition of rituximab to cyclophosphamide, doxorubicin, vincristine, and prednisolone therapy has a high risk of developing interstitial pneumonia in patients with non-Hodgkin lymphoma[J]. Leuk Lymphoma, 2009, 50(11): 1818–1823. DOI:10.3109/10428190903258780 |
| [12] | Kong H, Wang Y, Zeng X, et al. Involvement of NLRP3 inflammasome in rituximab-induced interstitial lung disease:a case report[J]. J Clin Pharm Ther, 2014, 39(6): 691–694. DOI:10.1111/jcpt.12198 |
| [13] | Kubo K, Azuma A, Kanazawa M, et al. Consensus statement for the diagnosis and treatment of drug-induced lung injuries[J]. Respir Investig, 2013, 51(4): 260–277. DOI:10.1016/j.resinv.2013.09.001 |
| [14] | Leon RJ, Gonsalvo A, Salas R, et al. Rituxmab-induced acute pulmonary fibrosis[J]. Mayo Clin Proc, 2004, 79(7): 949–953. DOI:10.4065/79.7.949 |
| [15] | Bitzan M, Anselmo M, Carpineta L. Rituxmab(B-cell depleting antibody) associated lung injury(RALI):a pediatric case and systematic review of the literature[J]. Pediatr Pulmonol, 2009, 44(9): 922–934. DOI:10.1002/ppul.v44:9 |
 2017, Vol. 43
2017, Vol. 43


