扩展功能
文章信息
- 金凯, 赵刚, 王育波, 张帅, 王东东
- JIN Kai, ZHAO Gang, WANG Yubo, ZHANG Shuai, WANG Dongdong
- 原发性颅内软骨肉瘤2例报告及文献复习
- Primary intracranial chondrosarcoma:A report of 2 cases and literature review
- 吉林大学学报(医学版), 2017, 43(06): 1256-1259
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1256-1259
- 10.13481/j.1671-587x.20170635
-
文章历史
- 收稿日期: 2017-03-22
软骨肉瘤是一种起源于软骨细胞的恶性肿瘤,常发生于青少年,好发部位为四肢长管骨,以股骨、胫骨和肱骨多见。原发于颅内的软骨肉瘤罕见,临床诊断较困难,与脊索瘤和颅咽管瘤等不易鉴别,多需要依据病理结果给予确诊。该病首选的治疗方案是通过手术尽可能将肿瘤全部切除,术后辅以放疗可取得较好的疗效。1899年由Mott[1]首次报道颅内软骨肉瘤。目前该病的临床报道较少,对其认识尚不足。本文作者报道2例原发性颅内软骨肉瘤患者的临床资料,并结合文献复习对其临床特点进行分析。
1 临床资料患者1,男性,年龄36岁,无明显诱因头疼半年,左眼上睑下垂6d入院。查体见左眼动眼神经瘫,右眼正常,双眼视力粗测正常。头部CT:鞍上区见散在分布的钙化影;头部MRI:鞍上区见类椭圆形长T1长T2信号影,大小为3.20cm×2.23cm,与周围正常脑组织边界较清,增强扫描见不均匀强化,其间可见类似分隔样结构(图 1A~D)。术前考虑颅咽管瘤可能性大,完善术前于全麻下行幕上开颅肿瘤切除术,术中见肿瘤位于岩斜区,质地较硬,侵蚀周围骨组织,将肿瘤分块切除,但部分肿瘤侵蚀基底动脉壁,将肿瘤给予次全切(图 1E)。术后病理:灰白色不整形组织数块,总体积为3.0cm×2.3cm×0.6 cm,部分组织呈半透明样,部分组织呈骨样硬。免疫组织化学检测:CK-pan(-), EMA(-), Vimentin(+), S-100(部分+), CK19(-), CK5(-), Lysozyme(部分+),Ki-67(+<2%),CD68(-)。诊断:软骨肉瘤(低级别)。因肿瘤无法全部切除,遂术后针对瘤床及残存病灶给予放疗(放疗前复查头部MRI,见图 1F);放疗后复查头部核磁未见复发及进展迹象(图 1G),1个月后复查头部MRI显示病灶较放疗前缩小(图 1H)。随访1年未见明显进展且患者动眼神经瘫症状已经基本缓解。
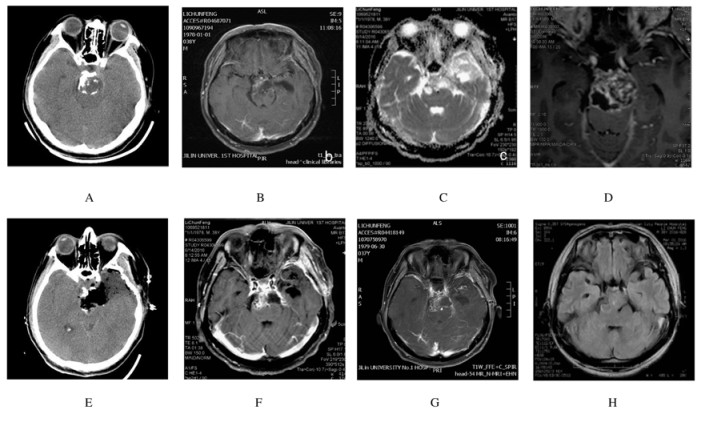
|
| A:Calcification in preoperative CT; B-D:Hypointense on T1WI, hyperintense on T2WI and inhomogeneous enhancement of T1WI following gadolinium infusion in preoperative MRI; E: Postoperative CT; F: MRI after 3 months; G:MRI after radiotherapy; H: MRI 1 month after radiotherapy. 图 1 原发性颅内软骨肉瘤患者(病例1)的CT和MRI影像表现 Figure 1 Image performance of CT and MRI of primary interacranial chondrosarcoma patient(case 1) |
|
|
患者2, 男性,年龄54岁,于1年前因无明显诱因出现视物不清而行头部MRI发现中颅凹占位病变,因手术风险较大,患者及家属拟定期复查,暂缓手术治疗。但4个月后症状加重,双目失明,复查头部MRI显示病变区域面积增大,遂来本科欲手术治疗。查体见双眼无光感。头部CT:中颅凹见略低密度影,中间散在钙化点,周围骨质被侵蚀。头部MRI:中颅凹见团片状形状欠规则异常信号,长T1长T2信号,增强扫描见不均匀轻中度强化,大小为6.2 cm×6.0 cm×8.1 cm,病变向上凸向鞍内和鞍上,左侧海绵窦受累,可见左侧颈内动脉被包绕,向下、后侵及中后颅窝底,可见周围骨质破坏(图 2A~D)。术前诊断为脊索瘤。完善术前检查后于全麻下行幕上开颅肿瘤切除术,术中见肿瘤质地较脆(图 2E),与周围组织分界不清,将肿瘤分块切除并将侵蚀的骨质最大程度地清除。术后病理:灰白色不整形组织数块,总体积7.0 cm×6.0 cm×2.0 cm,切面灰白色、实性、质脆、有黏液感。免疫组织化学:Ki-67(+1%), CK-pan(-), EMA(-), Vimentin(+), S-100(+),CK19(-), CK5(-), CK7(-)。诊断:高分化软骨肉瘤。术后复查头部CT显示肿瘤基本全部切除(图 2F),患者神清语明,四肢无瘫;术后第3天开始出现高热,脑脊液化验结果提示颅内感染,给予积极抗感染治疗,但效果不佳,术后第10天患者因严重颅内感染而死亡。

|
| A: Soft tissue mass with calcification in preoperative CT; B-D: Hypointense on T1WI, hyperintense on T2WI and inhomogeneous enhancement of T1WI following gadolinium infusion in preoperative MRI; E: Tumor revealed fragile during operation; F: Postoperative CT. 图 2 原发性颅内软骨肉瘤患者(病例2)的影像表现和术中所见 Figure 2 Image performance and intraoperative finding of primary interacranial chondrosarcoma patient(case 2) |
|
|
原发性颅内软骨肉瘤是颅内一种罕见的恶性肿瘤[2-3],占颅底肿瘤发病率的6%,占颅内所有肿瘤发病率的0.15%。软骨肉瘤在组织学上按照WHO分级分为3级[4]:Ⅰ级(高分化)、Ⅱ级(中分化)和Ⅲ级(低分化),其预后与分级相关。Ⅰ-Ⅱ级一般为低度恶性,而Ⅲ级为高度恶性,临床上极其少见,本文作者报道的2例患者均为低度恶性。Korten等[5]报道颅内各部位肿瘤的发生率:岩骨37%,枕骨和斜坡23%,蝶骨20%,额骨、筛骨和顶骨14%,硬膜组织6%。由于该病发生率低,所以临床上对该病的诊断较为困难,本组2例患者术前均未做出正确诊断,1例患者术前考虑颅咽管瘤,另1例患者考虑脊索瘤。该病的诊断主要是依据临床表现和影像学结果,最终根据病理结果可做出明确诊断,病理诊断是金标准。
颅内软骨肉瘤多发生于40~50岁的中年人,无性别差异[6],其临床表现不典型,主要与肿瘤起源的部位及大小密切相关。该病的首发症状多表现为头痛和与颅内压增高相关的症状;还可表现为肿瘤对周围颅神经或脑组织产生压迫或侵犯而引起的症状,本组2例患者中,1例表现为视力下降,另1例表现为动眼神经瘫。CT影像多表现为等或略低密度的软组织肿块,伴有钙化并可见肿瘤对周围骨质的侵蚀,可侵及颅内外,蝶骨和斜坡等部位亦常常受累。MRI影像多表现为长T1长T2信号,增强扫描后不均匀强化,其间可见分隔样结构;肿瘤内钙化区域表现为低信号,可见肿瘤对周围骨质的侵袭。在影像学上与脊索瘤和颅咽管瘤鉴别困难。
颅内软骨肉瘤的诊断金标准是病理结果[7]。肿瘤大体上呈灰白色半透明状并富含黏液样物质。镜下可见结节内瘤细胞排列成条索状、网状或小巢状,可见透明软骨分化。瘤细胞形态多样,细胞核呈圆形或椭圆形,细胞核大小不等,胞质呈空泡状,可见软骨陷窝。细胞间间质血管稀少;肿瘤组织中可伴有出血及坏死等继发性改变。电镜下可见软骨源性的特征,并发现在粗面内质网中有罕见的层状包涵体。S-100、Vimentin阳性和胶原蛋白Ⅱ型有利于鉴别软骨细胞来源的肿瘤。根据病理结果其可与脊索瘤、脑膜瘤、颅咽管瘤和少突胶质细胞瘤等进行鉴别诊断。
颅内软骨肉瘤同其他部位的软骨肉瘤一样,治疗上首选手术治疗。根据2017年NCCN指南[8],对于低度恶性患者采取病灶内切除术为主,术后给予辅助放疗;对于高度恶性患者建议采取扩大切除并给予放疗;对于复发的软骨肉瘤,不管是低度还是高度恶性,也是首选手术治疗,再次手术如果切缘阳性,则考虑再次切除以获得阴性切缘(阳性指切除肿瘤周边可见肿瘤细胞,阴性则为正常组织而未见肿瘤);如果无法手术者则采取放疗。Bloch等[9]报道患者术后给予辅助放疗的死亡率比单纯手术治疗明显降低。目前有学者[10-11]报道软骨肉瘤患者术后给予质子治疗也可获得很好的疗效;也有学者[12]报道碳离子治疗对软骨肉瘤亦有很好的控制作用。本组患者1术后针对瘤床及残存病灶给予54 Gy/27F立体定向放疗并且疗效明确;患者2因对周围骨质侵蚀严重,术后出现严重的颅内感染而死亡。虽然软骨肉瘤对化疗不敏感,但针对恶性程度高的软骨肉瘤,建议将环磷酰胺和西罗莫司作为推荐治疗药物。由于软骨肉瘤的治疗手段单一,因此现阶段有很多针对分子靶向的研究,有学者[13]报道Bcl-2抑制剂BH-3 mimetics对软骨肉瘤有治疗作用,也有学者[14]报道针对趋化因子4(CXCR4)的靶向药对软骨肉瘤也有治疗作用。随着病例数的积累和对该病的深入研究,临床上对该病的治疗手段也越来越多。该病的预后往往并不理想且容易复发,因此需要长期随访以掌握疾病的进展并选择治疗方案。
综上所述,颅内软骨肉瘤临床表现和影像学表现特异性不高,确诊还需依据组织病理学检查结果。治疗上首选手术治疗,术后给予辅助放疗可取得较好疗效。
| [1] | Mott FW. Chondrosarcoma springing from the sella turcica[J]. Arch Neurol Psychiat, 1899, 1: 432–433. |
| [2] | Coltrera MD, Googe PB, Harrist TJ, et al. Chondrosarcoma of the temporal bone:diagnosis and treatment of 13 cases and review of the literature[J]. Cancer, 1986, 58(12): 2689–2696. DOI:10.1002/(ISSN)1097-0142 |
| [3] | Seidman MD, Nichols RD, Raju UB, et al. Extracranial skull base chondrosarcoma[J]. Ear Nose Throat J, 1989, 68(8): 626–632. |
| [4] | Jo VY, Doyle LA. Refinements in sarcoma classification in the current 2013 world health organization classification of tumours of soft tissue and bone[J]. Surg Oncol Clin N Am, 2016, 25(4): 621–643. DOI:10.1016/j.soc.2016.05.001 |
| [5] | Korten AG, ter Berg HJ, Spincemaille GH, et al. Intracranial chondrosarcoma:review of the literature and report of 15 cases[J]. J Neurol Neurosurg Psychiatry, 1998, 65(1): 88–92. DOI:10.1136/jnnp.65.1.88 |
| [6] | Chi J, Zhang M, Kang J. Classical intracranial chondrosarcoma:a case report[J]. Oncol Lett, 2016, 12(5): 4051–4053. |
| [7] | 梁娟, 钱璐, 薛凤麟, 等. 颅内间叶性软骨肉瘤2例临床病理分析[J]. 临床与实验病理学杂志, 2016, 32(10): 1171–1173. |
| [8] | 牛晓辉. 2017版NCCN《骨肿瘤临床实践指南》更新与解读[J]. 中华外科杂志, 2017, 55(1): 41–43. |
| [9] | Bloch OG, Jian BJ, Yang I, et al. A systematic review of intracranial chondrosarcoma and survival[J]. J Clin Neurosci, 2009, 16(12): 1547–1551. DOI:10.1016/j.jocn.2009.05.003 |
| [10] | Weber DC, Malyapa R, Albertini F, et al. Long term outcomes of patients with skull-base low-grade chondrosarcoma and chordoma patients treated with pencil beam scanning proton therapy[J]. Radiother Oncol, 2016, 120(1): 169–174. DOI:10.1016/j.radonc.2016.05.011 |
| [11] | Feuvret L, Bracci S, Calugaru V, et al. Efficacy and safety of adjuvant proton therapy combined with surgery for chondrosarcoma of the skull base:a retrospective, population-based study[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 312–321. DOI:10.1016/j.ijrobp.2015.12.016 |
| [12] | Uhl M, Mattke M, Welzel T, et al. High control rate in patients with chondrosarcoma of the skull base after carbon ion therapy:first report of long-term results[J]. Cancer, 2014, 120(10): 1579–1585. DOI:10.1002/cncr.28606 |
| [13] | Morii T, Ohtsuka K, Ohnishi H, et al. BH3 mimetics inhibit growth of chondrosarcoma-a novel targeted-therapy for candidate models[J]. Anticancer Res, 2014, 34(11): 6423–6430. |
| [14] | Sun X, Charbonneau C, Wei L, et al. CXCR4-targeted therapy inhibits VEGF expression and chondrosarcoma angiogenesis and metastasis[J]. Mol Cancer Ther, 2013, 12(7): 1163–1170. DOI:10.1158/1535-7163.MCT-12-1092 |
 2017, Vol. 43
2017, Vol. 43


