扩展功能
文章信息
- 朱刚, 孙海斌, 汪浒, 徐刚
- ZHU Gang, SUN Haibin, WANG Hu, XU Gang
- MRI、CT和病理检查对肢体脂肪肉瘤诊断价值的比较
- Comparison of diagnosis value of MRI, CT and histopathological features on liposarcoma of extremities
- 吉林大学学报(医学版), 2017, 43(06): 1215-1219
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1215-1219
- 10.13481/j.1671-587x.20170627
-
文章历史
- 收稿日期: 2017-03-28
2. 郑州大学第五附属医院病理科, 河南 郑州 450052;
3. 郑州大学第五附属医院放射影像科, 河南 郑州 450052;
4. 河北医科大学第二医院烧伤整形科, 河北 石家庄 053600
2. Department of Pathology, Fifth Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
3. Department of Radiology, Fifth Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
4. Department of Burn and Plastic Surgery, Second Hospital, Hebei Medical University, Shijiazhuang 053600, China
在成人的软组织肉瘤中,脂肪肉瘤的发病率居第2位,占恶性软组织肿瘤的10%~35%[1],是原发性软组织恶性肿瘤最常见的类型。该肿瘤起源于原始间充质细胞,向脂肪细胞分化而最终形成间叶源性恶性肿瘤。脂肪肉瘤并不直接来源于成熟的脂肪细胞,但具有中间恶性生物学行为特征[2]。脂肪肉瘤的大小、形态及对周围组织的侵犯情况可通过MRI及CT检查进行确定,可为拟定手术方案等提供依据[3]。脂肪肉瘤又可以进一步分为高分化型脂肪肉瘤、黏液型脂肪肉瘤、去分化型脂肪肉瘤及混合型脂肪肉瘤,分型判定对指导临床治疗及疗效评价方面有重要价值[4]。脂肪肉瘤的病理类型需在术后获得病变组织进行病理检查后才能确定,影响治疗方案的制订。关于影像学与脂肪肉瘤的病理分型相关性的研究为数不多。本研究对2006年以来于郑州大学第五附属医院就诊的脂肪肉瘤患者的影像学及病理学检查结果进行对比研究,为临床诊断提供参考依据。
1 资料与方法 1.1 一般资料选择2006年1月-2016年1月于郑州大学第五附属医院经手术病理证实以及外院术后来院进行病理会诊证实的肢体脂肪肉瘤患者43例,其中男性23例,女性20例;年龄为26~72岁,中位年龄61岁,平均年龄为(54.0±6.4)岁。发病部位:上肢者13例,下肢者30例。收集患者手术前MRI及CT检查资料,结合病理诊断进行分析。首发症状均为可触及的软组织肿块。34例患者发现病变肢肿大、大小不均匀、按压疼痛,6例患者在其他疾病治疗过程中检查发现或在体检中发现,另外3例患者为手术治疗1年后复查发现病变部位局部复发。
1.2 诊断方法18例患者于手术前行MRI平扫及增强扫描辅助诊断,使用超导磁共振扫描仪,层厚4 mm,常规采用扫描序列:T1WI (TR 500~700 ms,TE为10~20 ms)以及脂肪抑制T2WI (TR 4 000~5 000 ms,TE 80~120 ms),扫描方位为矢状位、横轴位及冠状位,增强扫描;16例患者于手术前行CT平扫及增强扫描辅助诊断,使用CT双层螺旋扫描仪,层厚及间距为5~8 mm,螺距为1.375,管电压为120 kV,电流为30~90 mA,增强扫描的扫描范围根据患者情况而定;另外9例患者术前行MRI及CT平扫及增强扫描辅助诊断,所有患者均行手术切除肿瘤,术中取病变组织行病理检查。诊断结果由2名或以上经验丰富的病理医师根据世界卫生组织(WTO)对脂肪肉瘤的5种分型进行评定(分别为高分化型脂肪肉瘤、黏液型脂肪肉瘤、多形性型脂肪肉瘤、去分化型脂肪肉瘤和混合型脂肪肉瘤)。
1.3 CT检查采用飞利浦Brilliance16双层螺旋扫描仪,图像层厚为5~8 mm,采集层厚为1~2 mm,用于多平面重组;电压为120 kV,电流为30~90 mA。增强扫描采用300 g·L-1非离子碘对比剂静脉注射,注射剂量为1.0~1.2 mL·kg-1。
1.4 MRI检查采用飞利浦Achieva 1.5T超导型磁共振仪,层厚4 mm,层间距为0.5~1.0 mm,数字矩阵为256×256,扫描方位包括矢状位、横轴位、冠状位以及增强扫描。扫描序列:T1WI (TR 500~700 ms,TE为10~20 ms)以及脂肪抑制T2WI (TR 4 000~5 000 ms,TE 80~120 ms)。以钆双胺(gadodiamide injection, GE healthcare)为对比剂,剂量与体质量的比例为0.1 mmol·kg-1。
1.5 病理检查术后标本采用10%中性甲醛固定, 石蜡包埋切片,分别行HE染色及免疫组织化学检测,免疫组织化学采用标记物鼠双微基因2(MDM2)进行检查,采用常规方法进行一抗孵育,PBS代替一抗孵育作为阴性对照,并于显微镜下观察。
2 结果 2.1 肿瘤的尺寸、形态和病灶位置纳入研究的所有患者中,发病部位在上肢者13例,其中左臂7例,右臂6例;在下肢者30例,其中左大腿10例,右大腿11例,左小腿4例,右小腿5例。病灶直径为6.3~21.7 cm,平均直径为(14.6 ± 6.1)cm。手术切除病灶体积最小为7.3 cm×6.1 cm×4.1 cm,最大体积为21.7 cm×12.4 cm×7.1 cm。肿瘤形态呈圆形者7例,卵圆形者5例,长梭形者6例,多个结节状者7例,不规则者5例。
2.2 脂肪肉瘤的类型和诊断纳入研究的患者均行手术切除治疗,术中取病变组织证实为脂肪肉瘤,其中17例属于分化良好型脂肪肉瘤,12例为黏液型脂肪肉瘤,10例为去分化型脂肪肉瘤,4例为混合型脂肪肉瘤。术前行MRI检查的18例患者中,12例诊断为脂肪肉瘤,3例误诊为脂肪瘤,1例误诊为肉芽肿性病变,2例为手术治疗1年后复查原病变部位局部复发。术前行CT检查的16例患者中,10例诊断为脂肪肉瘤,3例误诊为脂肪瘤,1例误诊为小静脉曲张畸形,1例误诊为肉芽肿性病变,1例为手术治疗1年后复查原病变部位局部复发。9例行MRI及CT检查的患者中,7例诊断为脂肪肉瘤,1例误诊为脂肪瘤,1例误诊为肉芽肿性病变。以上结果经术后病理诊断确认。
2.3 各类型脂肪肉瘤的形态表现和影像学表现 2.3.1 分化良好型脂肪肉瘤所有患者均行手术切除,取切除的肿瘤组织进行病理检查。高分化型脂肪肉瘤患者的病变组织均见大小不同的脂肪细胞,病理学特征基本可见脂肪细胞与脂母细胞混合存在,伴有可被深染的多形性细胞。17例高分化型脂肪肉瘤中12例包膜完整,5例包膜不完整;外观呈淡黄色至黄色,也有呈暗红色或红黄混杂;送病理检查,镜下多见脂肪细胞已分化好,部分细胞核深染且较大,部分见异形性细胞核,可见部分组织硬化。CT检查结果显示:病灶显示为不规则低密度阴影,边界清晰,CT增强扫描显示病变部位分隔明显增强。分化良好型脂肪肉瘤CT检查可见丰富的脂肪细胞、不均匀分布的云絮状或片状软组织阴影,增强扫描后未见脂肪组织强化。MRI检查结果显示:T1短信号、T2长信号及短时间反转恢复序列成像等信号,肿块内可见条索状和线状阴影,病变组织周围神经和血管受到挤压,骨质结构相对完整。分化良好型脂肪肉瘤MRI平扫可见T1WI稍高信号而T2WI明显高信号,内见低信号条索状间隔,T2抑脂序列呈混杂高信号,偶见增强扫描后轻中度延迟强化,而中央低密度区无变化。见图 1(插页六)。
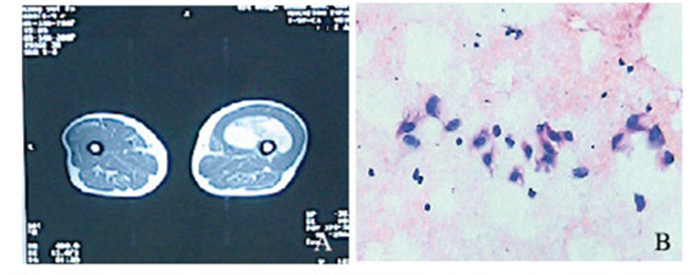
|
| 图 1 右大腿髙分化型脂肪肉瘤的MRI扫描图(A)和HE染色图(В,×400) Figure 1 Photos of MRI scanning (A) and HE staining (В, ×400) of right thigh high differentiated liposarcoma |
|
|
12例黏液型脂肪肉瘤组织中,表观可见10例包膜不完整,2例包膜较完整;黄色脂肪少见;送病理检查,镜下可见背景为疏散的黏液,短梭形细胞散在,偶见细胞核分裂以及空泡状胞浆,可见血管存在于间充质;黏液型脂肪肉瘤主要为水样低密度组织,CT检查可见点状、地图状分布的脂肪密度影及排列不规则、粗细不均匀的分隔,增强扫描后可见轻度渐进网格状、云絮状或片状强化,可见分叉状血管行走内部。见图 2(插页六)。
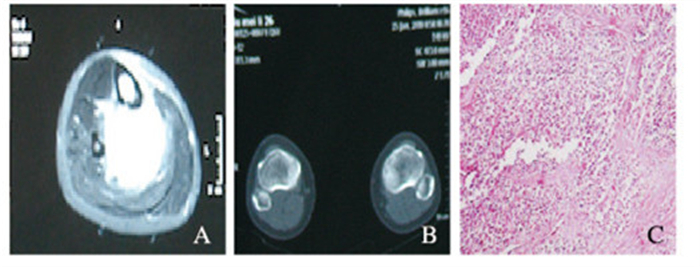
|
| 图 2 右小腿黏液型(圆细胞型)脂肪肉痛的MRI(A)和CT扫描图(B)及HE染色图(C,×400) Figure 2 Photos of MRI scanning(A), CT scaning(B) and HEstaining (C, ×400) of right calf mucin type (round cell)liposarcom |
|
|
10例去分化型脂肪肉瘤表现为多结节性黄色肿物, 含有散在的、实性、常为灰褐色的非脂肪性区域,CT和MRI以脂肪信号为主,增强后轻度强化;去分化型脂肪肉瘤主要呈巨大铸形肿块,CT检查可见组织密度不均匀,脂肪灶、实性肿块及高密度钙化影等呈不均匀分布,增强扫描后肿块明显强化,内见分支血管分布其中。混合型脂肪肉瘤组织通常形态混杂,多发混合性脂肪肉瘤可见脂肪与软组织肿块混杂,分界模糊,肿块实质明显延迟强化,其他可见低密度脂肪组织,略低于肌肉,增强扫描可见云絮状、斑片状延迟强化,可见分支血管分布其中。
2.3.4 混合型脂肪肉瘤4例混合型脂肪肉瘤的类型主要为高分化型-黏液性脂肪肉瘤以及去分化型-黏液型脂肪肉瘤。黏液型脂肪肉瘤MRI扫描结果可见信号类似囊性,T2WI信号明显增强,T1WI则为低信号;纤维间隔反映为短T2WI信号,抑脂瘤体T2WI为高信号,增强扫描后呈不均匀渐进性轻中度强化,见图 2(插页六)。去分化型脂肪肉瘤可见信号类似囊性,T2WI信号明显增强,T1WI则为低信号;纤维间隔反映为短T2WI信号,抑脂瘤体T2WI为高信号,增强扫描后呈不均匀渐进性轻中度强化,见图 3(插页六);混合型脂肪肉瘤MRI扫描信号多不均匀,某些可见T2WI信号增强而T1WI为等信号,T1WI信号上可见云絮状信号稍高或条索状等信号。见图 4(插页六)。
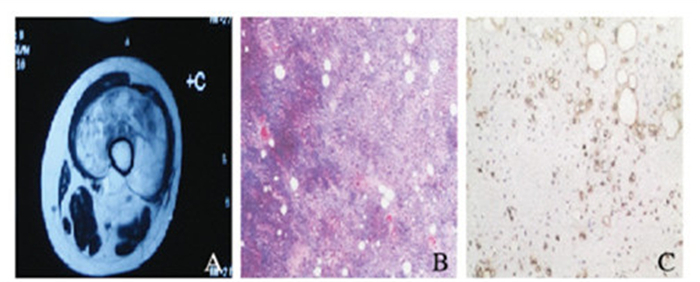
|
| 图 3 右大腿去分化型脂肪肉瘤的MRI扫描图(A)、HE染色图(R,×400)和免疫组织化学染色图(C,×400) Figure 3 Photos of MRI scanning(A), HE staining(R, ×400)and immunohistochemistry staining(C, ×400) of right thigh dedifferential liposarcoma |
|
|
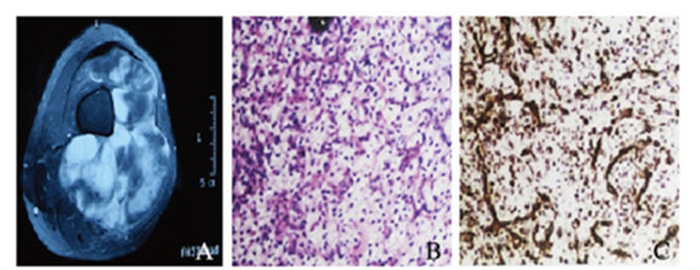
|
| 图 4 右大腿混合型脂肪肉痛的MRI扫描图(A)、HE染色图化,×400)和免疫组织化学染色图(C,×400) Figure 4 Photos of MRI scanning(A), HE staining(R, ×400)and immunohistochemistry staining(C, ×400) of right thigh mixed liposarcoma |
|
|
脂肪肉瘤主要累及人体的四肢和躯体的深层软组织,且以下肢和腹膜后的发病情况尤为普遍[5-6],而眼眶、鼻窦、甲状腺、唇、舌、喉、咽和食管较为少见,是临床一种常见的来源于原始间充质细胞的恶性肿瘤。世界卫生组织(WHO)将脂肪肉瘤重新分为5种类型:高分化型脂肪肉瘤、黏液型脂肪肉瘤、多形性型脂肪肉瘤、去分化型脂肪肉瘤及混合型脂肪肉瘤。其中高分化型及黏液型最为常见,约占70%[7]。纳入本研究的43例患者中,年龄为26~72岁,以中老年患者居多,其中17例属于高分化型脂肪肉瘤,12例属于黏液型脂肪肉瘤,10例属于去分化型脂肪肉瘤,4例属于混合型脂肪肉瘤。与既往报道[7]基本相似。20世纪70年代,脂肪肉瘤的恶化程度偏高,虽然病灶转移情况相对乐观,但对邻近周围组织具有侵袭性,经常发现手术治疗后复发的情况,因此临床中应重点观察研究该恶性肿瘤的诊断准确性并加强治疗预后[8-9]。
该类软组织脂肪肉瘤的病理特征一般有几方面[10]:①病灶内部大部分由不同大小的脂肪细胞构成,临床术后对肿瘤进行观察,巨大且边界清晰的分叶状肿块较为常见,病理检查时镜下可见瘤体内部呈现出大量脂肪组织,形态特征类似于脂肪瘤[11-12];②肿块内部散布脂母细胞,并具有大且深染的细胞核,该特征可使其与其他肿瘤区分[13-14];③脂肪肉瘤本身也会存在分隔的情况,有些患者可见钙化或内部出血的情况[15];病理检查方法除了HE染色外,免疫组织化学法也是常用的方法,可通过观察标本有2型鼠双微基因(MDM2)、周期蛋白依赖性激酶4和高迁移率蛋白Ⅰ等产生染色来进行鉴别诊断以明确疾病情况[16-18]。
本研究收集了2006年1月—2016年1月43例四肢脂肪肉瘤患者的资料,所有患者中,发病部位在上肢者13例,在下肢者30例。病灶直径为6.3~21.7 cm。手术切除病灶体积由7.3 cm×6.1 cm×4.1 cm至21.7 cm×12.4 cm×7.1 cm。肿瘤形态多变,呈圆形的有7例,卵圆形的有5例,长梭形的有6例,多个结节状的有7例,不规则的有5例。所有患者的病变组织均见不同大小的脂肪细胞,病理学特征基本可见脂肪细胞与脂母细胞混合存在,伴有可被深染的多形性细胞;CT检查基本特征为病灶显示为不规则低密度阴影,边界清晰,CT增强扫描显示病变部位分隔明显增强;MRI检查基本特征为可见T1短信号、T2长信号及短时间反转恢复序列成像等信号,肿块内存在条索状和线状阴影,病变组织周围神经与血管呈被挤压样,但骨质结构相对完整。
17例高分化型脂肪肉瘤大部分包膜完整,外观多为淡黄色至黄色;镜下多见脂肪细胞,分化好,部分细胞核深染且较大,部分见异型性细胞核,可见部分组织硬化;CT检查可见不均匀分布的云絮状或片状软组织阴影,增强扫描后未见脂肪组织强化;MRI平扫可见T1WI稍高信号而T2WI明显高信号,内见低信号条索状间隔,T2抑脂序列呈混杂高信号,偶见增强扫描后轻中度延迟强化,而中央低密度区无变化。12例黏液型脂肪肉瘤中大部分包膜不完整,少有黄色脂肪,镜下可见疏散黏液背景下短梭形细胞散在,血管存在于间充质中;黏液型脂肪肉瘤主要为水样低密度组织,CT检查可见点状、地图状分布的脂肪密度影及排列不规则、粗细不均匀的分隔,增强扫描后可见轻度渐进强化以及分叉状血管行走内部。MRI扫描特征常见T2WI信号明显增强而T1WI则为低信号,短T2WI信号的纤维间隔,高T2WI信号的抑脂瘤体,增强后呈不均匀渐进性轻中度强化。10例去分化型脂肪肉瘤表现为多结节性黄色肿物, 含有散在的、实性、常为灰褐色的非脂肪性区域,CT和MRI检查显示多以脂肪信号为主,增强后轻度强化,纤维间隔反映为短T2WI信号,抑脂瘤体T2WI为高信号,增强扫描后呈不均匀渐进性轻中度强化;混合型脂肪肉瘤组织形态混杂,多发混合性脂肪肉瘤可见脂肪与软组织肿块混杂,CT检查结果常见病灶与周围组织分界模糊,肿块实质明显延迟强化,增强扫描后见延迟强化,分支血管分布其中;其MRI扫描信号多不均匀,某些可见高T2WI信号及等T1WI信号,T1WI信号上可见云絮状信号稍高或条索状等信号。
综上所述,不同病理亚型的脂肪肉瘤其特征影像表现各不相同,本研究通过收集病例资料,对各亚型脂肪肉瘤的CT和MRI影像表现以及病理检查结果进行总结分析,病理检查可为确诊提供确切依据,而CT和MRI影像学检查可为判断肿瘤大小提供依据,且MRI造影增强后扫描,对明确肿瘤边界有重要作用。3种检查方法联合使用可为脂肪肉瘤患者特别是中老年患者术前影像学检查的定位定性诊断提供参考,对临床制订治疗方案和明确手术范围等具有重要参考价值。
| [1] | Murphey MD, Arcara LK, Fanburg-Smith J. From the archives of the AFIP:imaging of musculokeletal liposarcoma with radiologic-pathologic correlation[J]. Radiographics, 2005, 25(5): 1371. DOI:10.1148/rg.255055106 |
| [2] | Jo VY, Fletcher CD. WHO classification of soft tissue tumours:an update based on the 2013(4th) edition[J]. Pathology, 2014, 46(2): 95–104. DOI:10.1097/PAT.0000000000000050 |
| [3] | van Vliet M, Kliffen M, Krestin GP, et al. Soft tissue sarcomas at a glance:clinical, histological, and MR imaging features of malignant extremity soft tissue tumors[J]. Eur Radiol, 2009, 19(6): 1499–1511. DOI:10.1007/s00330-008-1292-3 |
| [4] | Misra A, Mistry N, Grimer R, et al. The management of soft tissue sarcoma[J]. J Plast Reconstr Aesthet Surg, 2009, 62(2): 161–174. DOI:10.1016/j.bjps.2008.08.018 |
| [5] | Mullen JT, Hornicek FJ, Harmon DC, et al. Prognostic signi cance of treatment-induced pathologic necrosis in extremity and truncal so tissue sarcoma a er neoadjuvant chemoradiotherapy[J]. Cancer, 2014, 120(23): 3676–3682. DOI:10.1002/cncr.28945 |
| [6] | Reshadi H, Rouhani A, Mohajerzadeh S, et al. Prevalence of malignant soft tissue tumors in extremities:an epidemiological study in syria[J]. Arch Bone Jt Surg, 2014, 2(2): 106–110. |
| [7] | le Grange F, Cassoni AM, Seddon BM. Tumour volume changes following pre-operative radiotherapy in borderline resectable limb and trunk soft tissue sarcoma[J]. Eur J Surg Oncol, 2014, 40(4): 394–401. DOI:10.1016/j.ejso.2014.01.011 |
| [8] | Kang S, Han I, Lee S, et al. Clinicopathological characteristics and prognostic factors of T1(≤ 5 cm) soft tissue sarcoma-a comparative study with T2(>5 cm) soft tissue sarcoma[J]. Eur J Surg Oncol, 2014, 40(4): 406–411. DOI:10.1016/j.ejso.2013.12.010 |
| [9] | Schmitt T, Kosely F, Wuchter P, et al. Gemcitabine and docetaxel for metastatic soft tissue sarcoma-a single center experience[J]. Onkologie, 2013, 36(7/8): 415–420. |
| [10] | 吴照宇. 四肢软组织脂肪肉瘤的影像学表现和病理组织学特征[J]. 中南大学学报:医学版, 2015, 40(8): 928–932. |
| [11] | Betgen A, Haas RL, Sonke JJ. Volume changes in soft tissue sarcomas during preoperative radiotherapy of extremities evaluated using cone-beam CT[J]. J Radiat Oncol, 2013, 2(1): 55–62. DOI:10.1007/s13566-012-0085-0 |
| [12] | Chou YS, Liu CY, Chen WM, et al. Follow-up after primary treatment of soft tissue sarcoma of extremities:impact of frequency of follow-up imaging on disease-specific survival[J]. J Surg Oncol, 2012, 106(2): 155–161. DOI:10.1002/jso.v106.2 |
| [13] | El Ouni F, Jemni H, Trabelsi A, et al. Liposarcoma of the extremities:MR imaging features and their correlation with pathologic data[J]. Orthop Traumatol Surg Res, 2010, 96(8): 876–883. DOI:10.1016/j.otsr.2010.05.010 |
| [14] | 李健, 谢凯, 龚洪翰, 等. 腹部巨大脂肪肉瘤CT、MRI表现及病理对照分析[J]. 实用放射学杂志, 2016, 32(2): 224–227. |
| [15] | Drevelegas A, Pilavaki M, Chourmouzi D. Lipomatous tumors of soft tissue:MR appearance with histological correlation[J]. Eur J Radiol, 2004, 50(3): 257–267. DOI:10.1016/j.ejrad.2004.01.022 |
| [16] | Sung MS, Kang HS, Suh JS, et al. Myxoid liposarcoma:appearance at MR imaging with histologic correlation[J]. Radiographics, 2000, 20(4): 1007–1019. DOI:10.1148/radiographics.20.4.g00jl021007 |
| [17] | 赵琳, 张军, 张新宇, 等. CT和MRI诊断脑神经胶质瘤52例分析[J]. 中国医学物理学杂志, 2015, 32(4): 464–467. |
| [18] | 王焱辉, 贺毅, 刘国亮. 腹部CT检查在结肠肿瘤性肠梗阻患者中的应用价值[J]. 中国医学物理学杂志, 2017, 34(9): 920–923. |
 2017, Vol. 43
2017, Vol. 43


