扩展功能
文章信息
- 焦洋, 杨冬野, 杨晶, 刘飞, 康喜荣, 张建生
- JIAO Yang, YANG Dongye, YANG Jing, LIU Fei, KANG Xirong, ZHANG Jiansheng
- Krüppel样转录因子12在结直肠癌患者肿瘤组织和血清中的表达及其意义
- Expressions of Krüppel-like factor 12 in cancer tissue and serum of patients with colorectal cancer and their significances
- 吉林大学学报(医学版), 2017, 43(06): 1204-1208
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1204-1208
- 10.13481/j.1671-587x.20170625
-
文章历史
- 收稿日期: 2017-06-18
2. 河北省人民医院普外四科, 河北 石家庄 050051
2. Fourth Department of General Surgery, Hebei General Hospital, Hebei Province, Shijiazhuang 050051, China
结直肠癌是我国常见的恶性肿瘤,近年来发病率不断升高,危害极大。结直肠癌的发生与饮食精细化、结构不合理及基因异常表达有关[1-2]。目前结直肠癌的治疗以手术为主,结合放化疗、中药以及免疫治疗,但只有部分患者能得到根治,许多患者的病情进展快、预后差。结直肠癌的发病原因与多种因素有关,基因在肿瘤的形成进展中发挥了重要作用[3],但相关的机制尚未完全阐明,因此找到与结直肠癌关系密切的基因对病情评价有重要价值。Krüppel样转录因子12 (Krüppel-like factor 12,KLF12)是转录因子家族成员之一,也被称为活化因子蛋白2(AP-2),参与肿瘤细胞的增殖、分化和凋亡等过程[4-5],但KLF12在结直肠癌中的作用尚不明确。本研究旨在探讨结直肠癌患者肿瘤组织和血清中KLF12表达情况及意义,为结直肠癌综合诊断和治疗水平的提高提供依据。
1 材料与方法 1.1 研究对象选取2016年2月—2017年2月于本院普外科就诊并行手术切除的结直肠癌患者120例作为研究对象(病例组),根据卫生部颁布的《结直肠癌诊疗规范》(2015版),入组患者均有结肠镜检查结果、肿瘤标志物、腹部CT、术前活检和术后肿瘤病理报告等资料。患者术前均未接受过放疗、化疗、靶向治疗和生物治疗等针对结直肠癌的治疗措施。患者于手术中均完全切除原发肿瘤。入选患者中男性78例,女性42例;年龄35~77岁,平均年龄为(56.25±10.34)岁,同时选取性别和年龄相匹配的同期门诊体检者100人(对照组),与病例组患者年龄和性别比较差异无统计学意义。所有入选者均签署知情同意文件,本研究得到本院医学伦理委员会批准。按照淋巴结转移程度,将病例组患者分为N0、N1、N2和N3共4组,其中N0组16例、N1组22例、N2组38例和N3组44例。
1.2 主要试剂和仪器KLF12、nm23、周期素E1(CyclinE1)、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)和MMP-9蛋白的兔抗人多克隆抗体为美国Sigma公司产品,二抗及免疫组织化学试剂盒购自北京中杉生物公司,用于ELISA检测的KLF12试剂盒为美国Cusabio公司产品。瑞士HAMILTON酶免之星全自动分析仪。
1.3 标本采集病例组患者分别于术前1天和术后1个月晨起空腹抽取静脉血5 mL,室温静置30min,3500 r·min-1离心15 min,分离血清,-20℃保存备用。手术过程中取出结直肠癌组织和癌旁组织(距离肿瘤组织≥3 cm,镜下未发现癌及不典型增生组织),漂洗后以中性甲醛固定。
1.4 免疫组织化学分析石蜡组织标本按照要求切片、脱蜡和水化,按照免疫组织化学试剂盒要求进行免疫组织化学染色。结果由病理专业人员进行判读。KLF12、nm23、CyclinE1、MMP-2和MMP-9蛋白均以在黄色或棕黄色颗粒出现在细胞核或细胞浆为染色阳性。应用二次计分法按阳性细胞数和染色强度记录免疫组织化学结果。①按染色强度计分:无色计为0分,淡黄色计为1分,棕黄色计为2分,褐色计为3分;②按阳性细胞比例计分:无阳性细胞计为0分,阳性细胞率<10%计为1分,10%≤阳性细胞率≤50%计为2分,50%<阳性细胞率≤75%计为3分,阳性细胞率>75%计为4分。细胞染色强度及阳性细胞计分相加,0~1分计为(-),2~3分计为(+),4~5分计为(++),6~7分计为(+++)。
1.5 ELISA法检测2组研究对象血清KLF12水平采用双抗体夹心ELISA法,所有试剂和标本使用前充分摇匀,平衡至室温,严格按照说明书要求的时间、加液量及顺序进行温育操作。板内和板间变异系数均<10%。检测范围:0.156~10.000 μg·L-1,灵敏度:0.059 μg·L-1,准确性:标准品线性回归与预期浓度相关系数R≥0.990。450 nm处全自动酶标仪检测吸光度(A)值。按淋巴结转移的程度(N0~N3)将病例组患者分为N0、N1、N2和N3组,比较各组患者血清KLF12水平。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。患者结直肠癌组织和癌旁组织中KLF12、nm23、CyclinE1、MMP-2和MMP-9蛋白的阳性表达率以百分比表示,组间比较采用χ2检验;2组研究对象血清中KLF12水平以x±s表示并进行正态性检验,组间比较采用t检验及单因素方差分析。Spearman秩相关分析法分析患者结直肠癌组织中各蛋白表达的相关性和结直肠癌组织与血清中KLF12表达的相关性;受试者工作特征曲线(ROC)分析血清中KLF12水平曲线最佳临界值(cut-off值)。以P<0.05为差异有统计学意义。
2 结果 2.1 结直肠癌组织和癌旁组织中KLF12、nm23、CyclinE1、MMP-2和MMP-9蛋白表达情况免疫组织化学检测,结直肠癌肿瘤组织中KLF12、CyclinE1、MMP-2和MMP-9蛋白阳性表达率高于癌旁组织(χ2=66.155, 52.795, 64.515, 52.632; P<0.001),结直肠癌组织中nm23蛋白的阳性表达率低于癌旁组织(χ2=13.019,P<0.001)。见表 1和图 1(插页六)。
| [n=120, n(η/%)] | ||||||||||||||
| Group | KLF12 | nm23 | CyclinE1 | MMP-2 | MMP-9 | |||||||||
| Negative | Positive | Negative | Positive | Negative | Positive | Negative | Positive | Negative | Positive | |||||
| Colorectal cancer tissue | 29(24.2) | 91(75.8) | 58(48.3) | 62(51.7) | 38(31.7) | 82(68.3) | 34(28.3) | 86(71.7) | 37(30.8) | 83(69.2) | ||||
| Adjacent non-cancer tissue | 92(76.7) | 28(23.3) | 31(25.8) | 89(74.2) | 94(78.3) | 26(21.7) | 96(80.0) | 24(20.0) | 93(77.5) | 27(22.5) | ||||
| χ2 | 66.155 | 13.019 | 52.795 | 64.515 | 52.632 | |||||||||
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |||||||||

|
| 图 1 结宜肠癌组织中KLF12(A)、nm23(B)、CyclinEl(C)、MMP-2(D)和MMP-9(E)蛋白的表达(免疫组织化学,×200) Figure 1 Expressions of KLF12CA), nm23(R), CyclinEl(C), MMP-2 (D), and MMP-9(E) proteins in colorectal cancer tissue (Immunohistochemistry, ×200) |
|
|
手术前病例组患者血清中KLF12水平[(4.042±1.410) μg·L-1]高于对照组[(2.301± 1.021) μg·L-1](t=8.281, P<0.001);手术后病例组患者血清中KLF12水平[(2.691±1.098) μg·L-1]明显低于手术前[(4.042±1.410) μg·L-1](t=10.299, P<0.001);手术后病例组患者血清中KLF12的水平[(2.691±1.098) μg·L-1]高于对照组[(2.301±1.021) μg·L-1](t=2.708, P=0.007)。
2.3 淋巴结转移程度不同的结直肠癌患者血清中KLF12水平N0组、N1组、N2组和N3组结直肠癌患者血清中KLF12水平分别为(2.097±0.780)、(3.752±0.763)、(4.219±1.469)和(4.742±1.074) μg·L-1。N0组患者血清中KLF12水平最低,N3组患者血清中KLF12水平最高,组间比较差异有统计学意义(F=21.731, P<0.001)。
2.4 结直肠癌组织中KLF12表达水平不同患者的血清KLF12水平结直肠癌组织KLF12表达水平为“-”、“+”、“++”、“+++”的患者血清中KLF12水平分别为(2.921±0.979)、(3.471±0.970)、(4.238±1.074)和(5.029±1.448) μg·L-1。随着肿瘤组织中KLF12水平的升高,血清中KLF12水平逐渐升高(F=19.302, P<0.001)。
2.5 结直肠癌组织中KLF12表达与nm23、CyclinE1、MMP-2和MMP-9蛋白表达的关系Spearman相关分析,结直肠癌组织中KLF12与MMP-2蛋白、KLF12表达与MMP-9蛋白、MMP-2与MMP-9蛋白的表达均呈正相关关系(r=0.396 3,P<0.001; r=0.326 4,P<0.001;r=0.297 6,P<0.001),结直肠癌组织中KLF12与nm23蛋白的表达呈负相关关系(r=-0.227 3,P=0.013);MMP-2与nm23蛋白、MMP-9与nm23蛋白的表达呈负相关关系(r=-0.348 2,P<0.001; r=-0.312 5,P<0.001)。Spearmann相关分析,病例组患者血清中KLF12与肿瘤组织中KLF12的表达呈正相关关系(r=0.4069,P<0.001)。
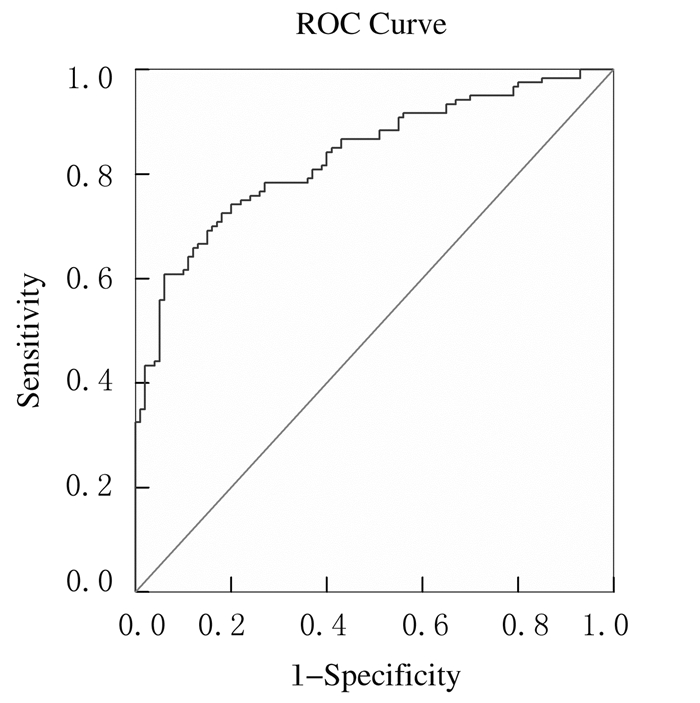
2.6 结直肠癌患者血清中KLF12水平的ROC曲线结直肠癌患者手术前血清KLF12水平高于对照组,其ROC曲线的最佳cut-off值为3.795μg·L-1,曲线下面积为0.834,对诊断结直肠癌的敏感度和特异度分别为60.8%和94.0%。见图 2。
|
| 图 2 结直肠癌患者血清中KLF12水平的ROC曲线 Figure 2 ROC of levels of serum KLF12 of colorectal cancer patients |
|
|
研究[6-7]显示:KLF12是微小RNA(microRNA)205、microRNA-137等的靶基因,这些microRNA通过调控KLF12表达而参与了宫颈癌和乳腺癌等肿瘤的进展。研究[4]显示:KLF12能够通过激活早期生长反应蛋白1(early growth response protein 1, EGR1)而促进结直肠癌细胞的生长。但KLF12与结直肠癌的具体关系尚不明确,KLF12调控下游基因发挥作用的具体机制也不清楚。在本研究中,结直肠癌肿瘤组织中KLF12阳性表达率明显高于癌旁组织,可见KLF12与肿瘤的发生有密切关联,可能是促进肿瘤发生发展的重要因素。
为分析KLF12可能的作用机制,本研究检测了结直肠癌组织中与肿瘤侵袭迁移关系密切的蛋白的表达,并分析了KLF12与这些蛋白的关系。nm23属于抑癌基因,可通过调控myc基因而参与抑制肿瘤的侵袭[8-9]。CyclinE1具有导致细胞周期失调的功能,从而增加癌组织的侵袭性,促进肿瘤的进展转移[10-11]。MMP-2具有调控细胞迁移能力的作用,其表达异常时参与肿瘤细胞转移和侵袭[12-13]。MMP-9基因的主要功能是保持细胞外基质降解和重塑之间的动态平衡,调节其他蛋白酶及细胞因子的活性,参与肿瘤进展[14-15]。本研究结果显示:肿瘤组织中CyclinE1、MMP-2和MMP-9蛋白的阳性表达率明显高于癌旁组织,nm23蛋白在癌组织中的阳性表达率低于癌旁组织,KLF12蛋白与MMP-2和MMP-9蛋白表达水平呈正相关关系,与nm23蛋白表达水平呈负相关关系,提示KLF12可能通过调控nm23、MMP-2和MMP-9蛋白的表达促进肿瘤的增殖和进展。本研究结果显示:KLF12水平与CyclinE1并无明显的相关性,提示KLF12作用机制可能与CyclinE1调控无关,但具体机制尚需体外及体内实验予以证实。
本研究结果显示:病例组患者肿瘤组织中KLF12水平与血清中KLF12水平存在相关性,证实血清中KLF12水平可以反映患者体内肿瘤负荷,检测血清中KLF12水平对评价结直肠癌的病情有一定参考作用。
病例组和对照组受试者血清中KLF12水平比较结果显示:病例组患者手术前血清中KLF12水平明显高于对照组, 手术后血清中KLF12水平明显降至对照组水平,提示血清中KLF12水平可能作为新的肿瘤标志物。随着淋巴结转移程度的升高,血清中KLF12水平也逐渐升高,以N0组患者血清中KLF12水平最低,N3组患者血清中KLF12水平最高,提示KLF12水平与肿瘤的淋巴结转移关系密切,检测KLF12水平可以预测淋巴结转移。
ROC曲线分析结果显示:曲线最佳cut-off值为3.795 μg·L-1,曲线下面积为0.834,对诊断结直肠癌的敏感度和特异度分别为60.8%和94.0%。随着结直肠癌组织中KLF12表达增强,血清中KLF12水平也明显升高,且结直肠癌组织和血清中KLF12表达水平具有相关性。说明KLF12对于结直肠癌的诊断有价值,可能成为新的肿瘤标志物。
本研究结果显示:结直肠癌组织中KLF12表达水平异常升高,血清KLF12水平升高,两者呈明显相关性,且血清KLF12水平与淋巴结转移的严重程度、结直肠癌组织中KLF12表达水平呈现正向一致性,说明KLF12水平变化与结直肠癌的发生发展和远处转移有密切关联。但本研究中纳入患者例数较少,未进行相关机制探讨,还需要更多实验进一步验证该结论。
| [1] | Chen W, Zheng R, Zhang S, et al. Cancer incidence and mortality in China in 2013:an analysis based on urbanization level[J]. Chin J Cancer Res, 2017, 29(1): 1–10. DOI:10.21147/j.issn.1000-9604.2017.01.01 |
| [2] | Bode AM, Dong Z, Wang H. Cancer prevention and control:alarming challenges in China[J]. Natl Sci Rev, 2016, 3(1): 117–127. DOI:10.1093/nsr/nwv054 |
| [3] | Sepulveda AR, Hamilton SR, Allegra CJ, et al. Molecular biomarkers for the evaluation of colorectal cancer:guideline from the American society for clinical pathology, college of American pathologists, association for molecular pathology, and American society of clinical oncology[J]. J Mol Diagn, 2017, 19(2): 187–225. DOI:10.1016/j.jmoldx.2016.11.001 |
| [4] | Kim SH, Park YY, Cho SN, et al. Krüppel-like factor 12 promotes colorectal cancer growth through early growth response protein 1[J]. PLoS One, 2016, 11(7): e0159899. DOI:10.1371/journal.pone.0159899 |
| [5] | Guan B, Li Q, Shen L, et al. MicroRNA-205 directly targets Krüppel-like factor 12 and is involved in invasion and apoptosis in basal-like breast carcinoma[J]. Int J Oncol, 2016, 49(2): 720–734. DOI:10.3892/ijo.2016.3573 |
| [6] | 官兵, 李青, 李晓红, 等. 基底样乳腺癌中微小RNA-205靶向调控KLF12以及对MDA-MB-468细胞凋亡的影响[J]. 中华医学杂志, 2016, 96(26): 2070–2075. DOI:10.3760/cma.j.issn.0376-2491.2016.26.007 |
| [7] | Du Y, Chen Y, Wang F, et al. miR-137 plays tumor suppressor roles in gastric cancer cell lines by targeting KLF12 and MYO1C[J]. Tumour Biol, 2016, 37(10): 13557–13569. DOI:10.1007/s13277-016-5199-3 |
| [8] | Han W, Zhang C, Cao FY, et al. Prognostic and clinicopathological value of NM23 expression in patients with breast cancer:A systematic review and meta-analysis[J]. Curr Probl Cancer, 2017, 41(1): 80–93. DOI:10.1016/j.currproblcancer.2016.11.007 |
| [9] | Wu Y, Li Y, Zhao X, et al. Combined detection of the expression of Nm23-H1 and p53 is correlated with survival rates of patients with stage Ⅱ and Ⅲ colorectal cancer[J]. Oncol Lett, 2017, 13(1): 129–136. |
| [10] | Zhao S, Yi M, Yuan Y, et al. Expression of AKAP95, Cx43, CyclinE1 and CyclinD1 in esophageal cancer and their association with the clinical and pathological parameters[J]. Int J Clin Exp Med, 2015, 8(5): 7324–7332. |
| [11] | 钟伟枫, 刘思平, 潘斌, 等. 龙葵素通过诱导细胞周期G1/S阻滞抑制裸鼠前列腺癌细胞Du145移植瘤生长[J]. 南方医科大学学报, 2016, 36(5): 665–670. |
| [12] | He G, Yang L, Qian X, et al. A coumarin-based fluorescence resonance energy transfer probe targeting matrix metalloproteinase-2 for the detection of cervical cancer[J]. Int J Mol Med, 2017, 39(6): 1571–1579. DOI:10.3892/ijmm.2017.2974 |
| [13] | 张金龙, 孙鹏达, 张辉. 血清标志物MMP-2、MMP-9含量表达与结直肠癌转移相关性分析[J]. 中国实验诊断学, 2017, 21(4): 638–639. |
| [14] | Kunte M, Desai K. The Inhibitory effect of c-phycocyanin containing protein extract (c-pc extract) on human matrix metalloproteinases (MMP-2 and MMP-9) in hepatocellular cancer cell line (HepG2)[J]. Protein J, 2017, 36(3): 186–195. DOI:10.1007/s10930-017-9707-0 |
| [15] | 王庆生, 陆航, 陈汉蕊, 等. IL-17A通过NF-κB通路介导MMP-2/9表达促进结肠癌SW480细胞迁移和侵袭[J]. 中国肿瘤生物治疗杂志, 2017, 24(5): 516–520. DOI:10.3872/j.issn.1007-385X.2017.05.010 |
 2017, Vol. 43
2017, Vol. 43


