扩展功能
文章信息
- 时猛, 陈雪芹, 孔丽丽, 金青松, 张凌云, 金勇君
- SHI Meng, CHEN Xueqin, KONG Lili, JIN Qingsong, ZHANG Lingyun, JIN Yongjun
- 白细胞亚型和甲状腺功能检测在甲状腺毒症鉴别诊断中的意义
- Significance of leukocyte subtypes and thyroid function tests in differential diagnosis of thyrotoxicosis
- 吉林大学学报(医学版), 2017, 43(06): 1199-1203
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1199-1203
- 10.13481/j.1671-587x.20170624
-
文章历史
- 收稿日期: 2017-04-26
2. 山东省临沂市中医院内分泌科, 山东 临沂 276003
2. Department of Endocrinology, Chinese Medicine Hospital of Linyi City, Linyi 276003, China
甲状腺毒症是常见的一组临床综合征,随着生活和工作节奏的不断加快,Graves病甲状腺毒症和破坏性甲状腺毒症发病率逐年升高[1],严重影响人们的生活质量,成为国内外众多学者关注的课题。对于患者来说,能够明确诊断和得到恰当治疗对于缓解病情甚至挽救生命有积极意义[2]。目前关于Graves病甲状腺毒症和破坏性甲状腺毒症的鉴别方法和相关研究较多,吕祝英等[3]认为:通过彩色多普勒超声和甲状腺上动脉频谱参数综合比较能简便、快速和准确地鉴别桥本氏甲状腺炎和甲状腺功能亢进症。这些方法虽然为甲状腺毒症的鉴别诊断提供了有力的证据,但是比较适合技术雄厚的大医院开展检查诊断。临床上常使用甲状腺摄碘率检查法对弥漫性毒性甲状腺肿和亚急性甲状腺炎进行鉴别诊断,但该检查方法在许多基层医院中尚未普及[4]。基层医院可能无法完成甲状腺穿刺或摄碘率检查,因此在基层医院进行鉴别诊断十分困难。研究[5]显示:一定浓度范围内甲状腺激素可促进骨髓单个核细胞增殖,超大剂量的甲状腺激素则可能引起骨髓单个核细胞凋亡及生长抑制进而引起血细胞生成减少,过多的甲状腺激素可能直接抑制骨髓造血功能[6]。Graves病发生时甲状腺毒症表现更严重,持续时间更长。本研究旨在比较2种疾病患者白细胞亚型和甲状腺功能各个参数的变化,寻找一种简单实用且准确的鉴别方法。
1 资料与方法 1.1 一般资料选取2015年2月—2016年8月在滨州医学院烟台附属医院内分泌科诊疗的甲状腺毒症患者63例,根据病因分为Graves病组(n=33)和破坏性甲状腺毒症组(n=30)。
1.2 纳入标准Graves病组:①高代谢症状和体征;②甲状腺肿大;③总甲状腺素(血清TT4)、游离甲状腺素(FT4)值升高,甲状腺刺激激素(TSH)值降低和(或)高水平放射碘吸收率;④甲状腺弥漫性肿大(触诊和B超证实),少数病例可以无甲状腺肿大;⑤眼球突出和其他浸润性眼征;⑥胫前黏液性水肿;⑦促甲状腺素受体抗体(TRAb)、TSH受体刺激性抗体(TSAb)和甲状腺过氧化物酶抗体(TPOAb)阳性。以上标准中,①②③④项为诊断必备条件,⑤⑥⑦项为诊断辅助条件。破坏性甲状腺毒症组:①无痛性甲状腺炎诊断依据是临床症状和少于3个月的高水平TT4、FT4和(或)发展为甲状腺功能减退症和(或)同时有低水平放射碘吸收率。②亚急性甲状腺炎的诊断是在甲状腺毒症临床特征的基础上,伴有颈部疼痛、压痛、发热和颈部肿胀;实验室检查结果显示:C反应蛋白(CRP)水平升高、高水平TT4、FT4和(或)低水平放射碘吸收率。因亚急性甲状腺炎患者的高代谢症状持续多在1个月内,为避免病程对甲状腺功能的影响,本研究选择的亚急性甲状腺炎患者皆为发病1个月内的患者。③甲亢型桥本氏甲状腺炎诊断依据是甲状腺毒症临床症状、弥漫性甲状腺肿大(特别是伴峡部锥体叶肿大)、血清甲状腺过氧化物酶抗体(TPOAb)和甲状腺球蛋白抗体(TgAb)水平明显升高,诊断即可成立。
1.3 排除标准① 患有急性感染性疾病、发热性疾病、肿瘤、血液性疾病、肝病、肾病和过敏免疫性疾病等影响检查结果的疾病;②服用影响血常规和甲状腺功能检查结果的药物;③既往患有甲亢且接受过治疗。
1.4 2组患者白细胞亚型百分数和甲状腺功能指标的测定所有样本收集是在患者治疗前的甲状腺毒症期间,采集上午8:00~10:00空腹肘静脉血标本。血常规检查仪器购自深圳迈瑞生物医疗公司(型号:迈瑞BC-6800),M-68血常规分析试剂购自迈瑞南京生物技术公司。血白细胞亚型参考值范围:嗜中性粒细胞(Ne)40%~75%,嗜碱性粒细胞(Ba)0~1%,淋巴细胞(Ly)20%~50%,嗜酸性粒细胞(Eo)0.4%~8%,单核细胞(Mo)3%~10%。甲状腺功能检测采用化学发光法,检测仪器购自美国贝克曼库尔特公司,型号:DXI-800;参考值范围:TSH:0.27~4.20 mIU·L-1,FT3:3.10~6.80 pmol·L-1,FT4:12.00~22.00 pmol·L-1。
1.5 统计学分析采用SPSS19.0统计软件进行统计学分析。2组患者性别比较采用χ2检验;2组患者年龄、Ly、Mo、TSH值组间比较采用t检验;Ne、Ba、Eo、游离三碘甲状腺原氨酸(FT3)、FT4、Eo/Mo、FT3/FT4和Eo×FT3/Mo组间比较采用Mann-Whitney U检验。以P<0.05为差异有统计学意义。应用受试者工作特征(ROC)曲线评价有统计学意义的检验指标对2种疾病的鉴别诊断价值,计算曲线下面积(AUC),将离曲线左上角(0,1)直线距离最近的点确定为最佳诊断界点。
2 结果 2.1 2组患者一般情况2种疾病均明显多发于女性,Graves病组共33例患者,男性12例,女性21例,平均年龄为(40±7)岁;破坏性甲状腺毒症组共30例患者,男性9例,女性21例,平均年龄为(44±6)岁;Graves病组与破坏性甲状腺毒症组患者年龄和性别比较差异无统计学意义(P>0.05)。
2.2 2组患者白细胞亚型百分数2组患者Ly、Ne和Ba百分数比较差异无统计学意义(P>0.05)。Graves病组患者Eo百分数高于破坏性甲状腺毒症组患者,Mo百分数低于破坏性甲状腺毒症组(P<0.05)。见表 1。
| (η/%) | ||||||
| Group | n | Ne | Bas | Eo | Ly | Mo |
| Graves disease | 33 | 45.38(38.13, 48.91) | 0.42(0.24, 0.66) | 2.84(1.80, 3.88) | 45.99±9.53 | 4.79±2.44 |
| Destructive thyrotoxicosis | 30 | 42.40(37.58, 48.00) | 0.60(0.40, 0.71) | 1.03(0.70, 1.40)* | 48.99±9.08 | 6.27±1.63* |
| *P < 0.01 vs Graves disease group. | ||||||
Graves病组患者TSH值低于破坏性甲状腺毒症组(P<0.05);Graves病组患者FT4与FT3值高于破坏性甲状腺毒症组(P<0.05)。见表 2。
| Group | n | TSH [λB/(mIU·L-1)] | FT3[cB/(pmol·L-1)] | FT4 [cB/(pmol·L-1)] |
| Graves disease | 33 | 0.13±0.05 | 15.47(12.57, 29.37) | 45.37(38.58, 59.00) |
| Destructive thyrotoxicosis | 30 | 0.17±0.05* | 11.58(9.84, 3.40)* | 37.86(34.05, 43.82)* |
| *P < 0.01 vs Graves disease group. | ||||
2组患者Eo和Mo百分数、TSH、FT3和FT4值比较差异有统计学意义(P<0.01),但这些指标在Graves病和破坏性甲状腺毒症患者之间差异较小,存在重合情况,对于指导临床鉴别诊断有些困难。从有统计学意义的指标中选取数值改进结果的可比性,新的参考指标为Eo/Mo、FT3/FT4和Eo×FT3/Mo。2组患者Eo/Mo、Eo×FT3/Mo比较差异有统计学意义(P<0.05),且Eo×FT3/Mo数值在2种疾病中差异较大,可用于鉴别诊断。见表 3。
| [M(P25,P75)] | ||||
| Group | n | Eo/Mo | FT3/FT4 | Eo×FT3/Mo |
| Graves disease | 33 | 0.67(0.63, 0.70) | 0.31(0.24, 0.58) | 10.21(8.96, 19.31) |
| Destructive thyrotoxicosis | 30 | 0.18(0.16, 0.20)* | 0.33(0.26, 0.39) | 2.05(1.56, 3.40)* |
| *P < 0.01 vs Graves disease group. | ||||
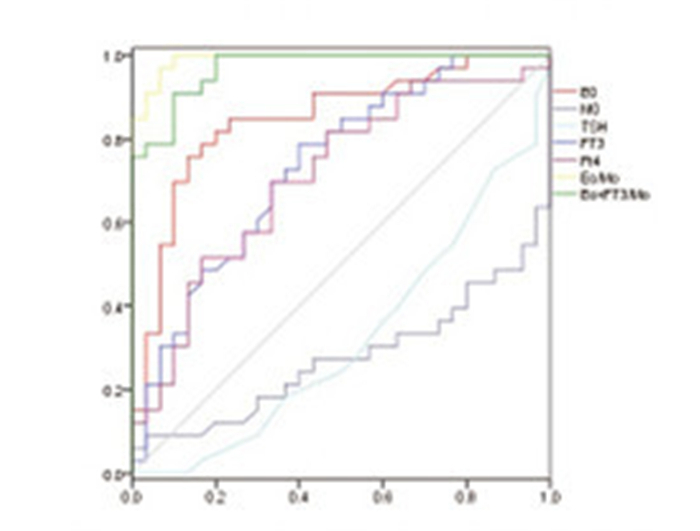
Eo的AUC为0.85,FT3的AUC为0.74,FT4的AUC为0.71,Eo/Mo的AUC为0.99,Eo×FT3/Mo的AUC为0.97。见表 4和图 1(插页六)。
| Item | AUC | Best diagnostic boundary | Sensitivity | Specificity |
| Eo | 0.85 | 1.54 | 0.82 | 0.80 |
| FT3 | 0.74 | 11.56 | 0.85 | 0.50 |
| FT4 | 0.71 | 38.23 | 0.82 | 0.53 |
| Eo/Mo | 0.99 | 0.34 | 1.00 | 0.90 |
| Eo×FT3/Mo | 0.97 | 3.94 | 1.00 | 0.80 |
|
| 图 1 2组患者各指标的 Figure 1 ROC of indexes of patients in two groups |
|
|
本研究结果显示:白细胞亚型中,2组患者的Eo和Mo比较差异有统计学意义。本文作者认为:该结果可能与2种疾病的发病机制不同有关,也与2种疾病甲状腺激素对骨髓造血机制的影响有关。产生自身抗体和自身免疫反应性T细胞被认为是Graves病的可能发病机制之一[7]。免疫功能紊乱时机体产生白细胞抗体,骨髓中各阶段幼稚细胞受到破坏,该白细胞抗体抑制骨髓中粒系定向干细胞的生长和成熟,从而导致粒细胞减少[8]。刘新民[9]报道:Graves病患者白细胞数减少与甲状腺功能亢进的严重程度有关。甲状腺功能亢进患者并发血细胞数减少的机制尚不清楚,有学者[10]认为其主要通过免疫途径,但是也有学者[11]认为这是通过甲状腺激素的直接作用。在一定浓度范围内甲状腺激素可促进骨髓单个核细胞增殖,超大剂量的甲状腺激素则可能引起骨髓单个核细胞凋亡及生长抑制进而引起血细胞数生成减少。过多的甲状腺激素可能直接抑制骨髓造血功能[6]。
Kawa等[12]的研究证实:甲状腺功能亢进状态可引起骨髓中造血细胞凋亡。低浓度甲状腺素促进骨髓单个核细胞增殖的具体机制和途径、高浓度甲状腺素引起骨髓单个核细胞凋亡的机制是否与Fas或T3受体或其他途径有关尚需进一步研究。高绪文等[13]认为:Graves病并发血白细胞数减少与甲状腺功能亢进病情的严重程度有关,白细胞数减少与甲状腺功能亢进症状严重性成正比。廖永日[14]认为:Graves组患者血清T3和T4值明显高于亚急性甲状腺炎患者。这些因素可能是2种疾病Eo和Mo分布情况出现变化的原因,故对Eo和Mo分布情况的研究有助于2种疾病鉴别诊断。
1956年,Adams和Purves从Graves病患者血清中发现长效甲状腺刺激物(LATS)[15],由LATS引起的甲状腺激素值升高以需碘量少而活性高的T3值升高为主,一般T4值高于正常人的2倍,而T3值可高至正常人4倍;所以本文作者猜测:Graves病患者T3和T4值高于破坏性甲状腺毒症患者。发生甲状腺毒症时,总T3和T4值受到甲状腺球蛋白数量的影响,较游离T3和T4值更稳定。Graves病的主要病理过程是自身免疫功能异常状态下甲状腺激素分泌增多,促甲状腺激素受体抗体调节络氨酸脱碘酶活性增强,使T4转化为T3增多,致使血液中FT3值升高比例大于FT4。张健等[16]认为:Graves病组患者FT3值升高更明显,其原因可能是Graves病患者自身甲状腺功能高于正常值。本研究结果显示:2组患者TSH、FT3和FT4比较差异有统计意义。苟静等[17]发现:Graves病患者血清T3/T4和FT3/FT4较亚急性甲状腺炎患者明显升高,与本研究结果相似。破坏性甲状腺毒症发生时,甲状腺组织遭到机体炎症或免疫反应等因素的破坏,患者血液中甲状腺激素水平升高[18],出现甲状腺毒症;破坏性甲状腺毒症患者甲状腺分泌的负反馈机制是正常的,甲状腺产生甲状腺素量先减少后逐渐恢复正常,所以该类患者甲状腺毒症临床症状相对较轻。Graves病较甲状腺炎起病隐匿,确诊时往往病程较长,且Graves病患者甲状腺激素水平相对较高[19]。垂体促甲状腺激素的释放受甲状腺功能亢进严重程度的影响,也受甲状腺功能亢进持续时间的影响。发生Graves病时,甲状腺受TSH受体抗体的慢性刺激,在临床症状出现前就可存在亚临床甲状腺功能亢进,如此长时间的刺激足以对垂体产生完全抑制。破坏性甲状腺炎患者的FT3和FT4值相对较低,且该类患者就诊较早(如亚急性甲状腺炎),所以FT3和FT4对垂体TSH产生的负反馈作用较弱,TSH水平相对较高。Graves病患者甲状腺腺体受到过多TRAb刺激,甲状腺产生过多甲状腺激素,该病患者甲状腺分泌不受负反馈机制影响[20],并生成需碘量少而活性高的T3为主。在正常人群中,血清T3与T4的比值小于20,在Graves病发生时T4值增长少于T3,故T3与T4的比值也增加[21]。破坏性甲状腺毒症患者各方面表现较轻,主要表现在甲状腺功能参数方面:2组疾病患者TSH、FT3和FT4值比较差异有统计学意义,且FT3值比FT4值变化更明显。
本研究结果显示:破坏性甲状腺毒症和Graves病患者Eo、Mo、TSH、FT3、FT4、Eo/Mo和Eo×FT3/Mo比较差异均有统计学意义,均可作为2种疾病的鉴别依据。但本文作者认为:Eo、Mo、TSH、FT3、FT4和Eo/Mo均值相差较近,取值范围存在重合情况,对于指导临床鉴别诊断还有些困难。本研究结果显示:Eo、Eo/Mo和Eo×FT3/Mo对于Graves病和破坏性甲状腺毒症的鉴别诊断实用意义更大。在大多数基层医院,血细胞检查和甲状腺激素测定较为普及,且其检验结果快捷,可尽早判断甲状腺毒症的病因。
| [1] | 陈治龙, 霍克新. 甲亢合并桥本氏甲状腺炎24例治疗体会[J]. 吉林医学, 2011, 17(1): 22–23. |
| [2] | 易芳, 王晓书, 陈淑文. 彩超在诊断桥本氏甲状腺炎伴亚临床甲状腺功能减退中的应用价值[J]. 西部医学, 2012, 24(1): 144–145, 148. |
| [3] | 吕祝英, 雷志锴, 楼军. 超声弹性成像与常规超声对桥本氏甲状腺炎及Graves病的鉴别诊断价值分析[J]. 中国现代医生, 2016, 54(26): 109–112. |
| [4] | 毛学文. 284例甲状腺毒症病因分析[J]. 中国民族民间医药, 2010, 6(5): 56–57. |
| [5] | 马军. 甲状腺激素T3对骨髓单个核细胞增殖及凋亡的影响[D]. 郑州: 郑州大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10459-1011017646.htm |
| [6] | 邹大进, 李娟. 甲状腺功能亢进症伴粒细胞减少的诊断与处理[J]. 中国实用内科杂志, 2006, 26(9): 645–646. |
| [7] | Weetman AP. Autoimmune thyroid disease[J]. Autoimmunity, 2004, 37(4): 337–340. DOI:10.1080/08916930410001705394 |
| [8] | 王家伦. Graves'病合并粒细胞减少症的临床分析[J]. 实用医技杂志, 2003, 10(12): 1466–1467. DOI:10.3969/j.issn.1671-5098.2003.12.141 |
| [9] | 刘新民. 使用内分泌诊疗手册[M]. 北京: 人民军医出版社,1996: 621-622. |
| [10] | Vaiana R, Cappelli C, Rerini P, et al. Ⅰ-Iyperthyroidism and concurrent thyroid cancer[J]. Tumori, 1999, 85(4): 247–252. |
| [11] | Cooper DS, Ladenson PW, Nisula BC, et al. Familial thyroid hormone resistance[J]. Metabolism, 1982, 31(5): 504–509. DOI:10.1016/0026-0495(82)90242-6 |
| [12] | Kawa MP, Grymula K, Paczkowska E, et al. Clinical relevance of thyroid dysfunction on human haematopoiesis-biochemical and molecular studies[J]. Eur J Endocrinol, 2010, 162(2): 295–305. DOI:10.1530/EJE-09-0875 |
| [13] | 高绪文, 李继莲. 甲状腺疾病[M]. 北京: 人民卫生出版社,1999: 18-19. |
| [14] | 廖永日. 进行血清T3、T4检测对弥漫性毒性甲状腺肿和亚急性甲状腺炎进行鉴别诊断的效果研究[J]. 当代医药论丛, 2016, 14(5): 131–132. |
| [15] | 马萍. Craves病患者血清TRAb的检测及其临床意义[D]. 石家庄: 河北医科大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-11919-2010248411.htm |
| [16] | 张健, 刘彦明, 管振祺, 等. 甲状腺毒症患者单个核细胞Foxp3检测分析[J]. 微循环学杂志, 2015, 25(2): 49–51. |
| [17] | 苟静, 靳瑾, 阿布力克木·吐尔地. 血清T3/T4值对Graves病甲亢与亚甲炎引起的甲状腺毒症的分析[J]. 新疆医科大学学报, 2010, 33(10): 1229–1231. DOI:10.3969/j.issn.1009-5551.2010.10.021 |
| [18] | Nishihara E, Ohye H, Amino N, et al. Clinical characteristics of 852 patients with subacute thyroiditis before treatment[J]. Intern Med, 2008, 47(8): 725–729. DOI:10.2169/internalmedicine.47.0740 |
| [19] | 宁宁, 张杰, 何长武, 等. T3/T4值、TRAb和ALP在育龄期女性甲状腺毒症中的鉴别价值[J]. 西北国防医学杂志, 2015, 36(9): 585–588. |
| [20] | 蔡梅, 郭华林. 血清TpoAb、TRAb检测在亚急性甲状腺炎与Graves'病鉴别诊断中的意义[J]. 山东医药, 2013, 53(39): 62–63. DOI:10.3969/j.issn.1002-266X.2013.39.024 |
| [21] | 吴盛海, 魏振利. T3/T4、TSH、AKP对无痛性甲状腺炎及Graves'病的鉴别诊断价值[J]. 放射免疫学杂志, 2006, 19(1): 71–72. |
 2017, Vol. 43
2017, Vol. 43


