扩展功能
文章信息
- 高新雅, 张伟杰, 崔黎, 周学良, 马志俊, 吕转, 池艳艳, 王留兴
- GAO Xinya, ZHANG Weijie, CUI Li, ZHOU Xueliang, MA Zhijun, LYU Zhuan, CHI Yanyan, WANG Liuxing
- TM4SF1在乳腺癌组织中的表达及其临床意义
- Expression of TM4SF1 in breast cancer tissue and its clinical significance
- 吉林大学学报(医学版), 2017, 43(06): 1186-1192
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1186-1192
- 10.13481/j.1671-587x.20170622
-
文章历史
- 收稿日期: 2017-05-16
2. 郑州大学第一附属医院病理科, 河南 郑州 450052
2. Department of Pathology, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China
乳腺癌是一种世界性的女性恶性肿瘤,约占女性恶性肿瘤18%,严重影响了患者身心健康。统计数据[1]表明:乳腺癌患者5年生存率为50%~60%。乳腺癌的传统治疗方法有手术、化疗、放疗和内分泌治疗,但侵袭和转移是临床治疗乳腺癌面临的主要挑战[2]。乳腺癌侵袭转移机制尚不完全清楚,因此探讨乳腺癌侵袭转移的深层机制及靶向治疗的靶基因十分必要。四次跨膜蛋白1(transmembrane4super family1, TM4SF1)是四次跨膜蛋白L6超家族成员之一,TM4SF1广泛表达于上皮来源的恶性肿瘤,近年来国内外已有研究证实TM4SF1在胰腺癌[3]、肝癌[4]和食管癌[5]等组织中有异常高表达,与常见恶性肿瘤的血管形成有密切关联,并可促进肿瘤的侵袭与转移,但TM4SF1在乳腺癌组织中的表达及其临床意义鲜有报道,因此本研究采用免疫组织化学法、RT-PCR法和Western blotting法检测乳腺癌组织、癌旁组织及正常乳腺组织中TM4SF1表达的差异,探讨TM4SF1在乳腺癌发生发展中的作用及其意义,提高乳腺癌早期诊断率,降低乳腺癌浸润转移率,提供有效的靶向治疗措施,为治疗乳腺癌浸润转移提供一种新的治疗思路和方法。
1 材料与方法 1.1 一般资料收集2016年1—6月在本院外科行手术治疗的190例乳腺癌患者的组织标本;另收集乳腺癌旁组织(取自上述乳腺癌标本肿块边缘距离肿块2~5 cm)110例及正常乳腺组织(取自上述乳腺癌标本肿块边缘距离肿块5 cm或以上的正常乳腺组织标本并经病理证实无癌浸润)110例。在手术切除标本后,每例组织立即分为2份,一份置于10%甲醛中固定,另一份置于2 mL无菌冻存管并立即投至液氮罐中保存。所有患者均为女性,均为初诊原发性乳腺癌患者,术前均未行放疗和化疗。患者年龄25~81岁,中位年龄55岁;肿块直径<2 cm者61例,2~5 cm者114例,>5 cm者15例;无淋巴结转移者122例,有淋巴结转移者68例;病理分级:高分化者27例,中分化者115例,低分化者48例;按美国癌症联合委员会AJCC分期标准:Ⅰ期56例,Ⅱ期79例,Ⅲ期55例。Luminal A型75例,Luminal B型47例,Her-2过表达型29例,基底样型39例。本研究获得本院伦理委员会批准,研究对象均对本研究知情同意。
1.2 主要试剂和仪器兔抗人TM4SF1多克隆一抗(ab113504)购自美国Abcam公司,SP试剂盒和DAB试剂盒均购自中杉金桥生物技术有限公司,TRIzol试剂购自美国Invitrogen公司,cDNA试剂盒购自日本TaKaRa公司,RT-PCR试剂盒购自美国罗氏生物制药有限公司,Westernblotting裂解液、5×SDS蛋白上样缓冲液、SDS、PVDF膜均购自中国碧云天有限公司,PCR引物由生工生物工程(上海)股份有限公司设计并合成; TM4SF1引物Forward: 5′-CAGCCCTTGGCTTAGCAGA-3′,Reverse: 5′-CCACAATGCTTGGGTTCA-3′,GAPDH引物Forward: 5′-GAGTCAACGG ATTTGGTCGT-3′,Reverse: 5′-GACAAGCTTCCCGTTCTCAG-3′。紫外分光光度仪购自Thermo Spectronic公司,MX3000P荧光定量PCR仪购自美国安捷伦公司,化学发光成像系统购自美国UVP公司,DYY-Ⅲ电泳仪购自北京市六一仪器厂,台式低温高速离心机购自德国Heraeus公司。
1.3 免疫组织化学法检测乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1的表达将石蜡切片进行烤片、脱蜡、水化;于0.01 mol·L-1柠檬酸钠缓冲修复液中微波热抗原修复20 min;加3% H2O2室温反应30 min消除内源性过氧化物酶;滴加山羊血清封闭液室温封闭30 min;滴加1:200稀释后的TM4SF1多克隆一抗4℃反应过夜;次日滴加羊抗兔二抗,37℃孵育1 h;DAB显色1 min,苏木精浅染细胞核;脱水风干,用中性树胶封固,显微镜下观察染色结果。
免疫组织化学评分标准:在光学显微镜下,每张切片随机观察5~10个高倍视野(×400),每个视野至少计数100个细胞,根据阳性细胞的细胞核或细胞质颗粒染色强度和阳性细胞所占百分率综合判断染色结果。按染色强度评分:无细胞染色为0分,淡黄色颗粒或团块(+)为1分,棕黄色颗粒或团块(++)为2分,棕褐色颗粒或团块(+++)为3分;按阳性细胞所占百分率评分:≤5%为0分,5%<百分率≤25%为1分,25%<百分率≤50%为2分,50%<百分率≤75%为3分,>75%为4分。以上2项分数的乘积为综合评分:>3者为阳性表达。
1.4 Western blotting法检测乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1的表达水平3种组织均用蛋白裂解液裂解,提取细胞总蛋白,采用BCA法检测蛋白质浓度。进行10%SDS-PAGE分离蛋白,电泳结束后将蛋白条带转移至PVDF膜上,5%脱脂奶粉封闭后,分别加入TM4SF1多克隆一抗和β-actin单克隆一抗(工作液体积稀释比例均为1:1000),4℃反应过夜;洗膜后加入二抗(工作液体积稀释比例为1:1 000),室温反应1 h,洗膜后,ECL发光法显影、定影和曝光。采用ImageJ2X软件系统分析蛋白表达水平。TM4SF1蛋白相对表达水平=目的基因引物条带的灰度值/内参β-actin条带的灰度值。每组实验均独立重复3次。
1.5 RT-PCR法检测乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1mRNA的表达水平取50 mg乳腺癌组织、癌旁组织及正常乳腺组织, 经液氮研磨后加入TRIzol试剂裂解液提取3种组织总RNA,紫外分光光度计检测RNA的浓度及纯度,采用cDNA试剂盒在冰上进行反转录,42℃、2 min去除基因组DNA反应,37℃、15 min, 85℃、5 s反转录反应。行RT-PCR反应,以cDNA为模板,采用SYBR@Premix ExTaqTMⅡ进行PCR。先配制20μL反应体系:上下游引物各4 μL,cDNA2 μL,SYBR@Premix Ex TaqTM Ⅱ 10 μL;反应条件为:95℃预变性10 min、95℃变性10 s、60℃退火与延伸10 s、72℃、10 s,40个循环;以GAPDH表达水平作为内参照。TM4SF1引物:Forward, 5′-CAGCCCTTGGCTTAGCAGA-3′; Reverse,5′-CCACAATGCTTGGGTTCA-3′; GAPDH引物:Forward,5′-GAGTCAACGGATTTGGTCGT-3′;Reverse,5′-GACAAGCTTCCCGTTCTCAG-3′。采用2-ΔΔCt法定量计算3种组织中TM4SF1相对表达水平。每组均设置3个复孔,计算平均值。实验独立重复3次。
1.6 统计学分析采用SPSS17.0统计软件进行统计学分析。乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1和TM4SF1 mRNA表达水平组间比较采用t检验;不同临床病理类型乳腺癌患者乳腺癌组织中TM4SF1的阳性表达率以x±s表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 免疫组织化学法检测正常乳腺组织、癌旁组织和乳腺癌组织中TM4SF1的表达乳腺癌组织中TM4SF1主要表达于细胞膜和细胞质,少数表达于细胞核;乳腺癌组织中TM4SF1的阳性表达率(64.7%)高于癌旁组织(26.4%)及正常乳腺组织(22.7%)(P<0.05);癌旁组织与正常乳腺组织中TM4SF1的阳性表达率比较差异无统计学意义(P>0.05)。见图 1(插页六)和表 1。
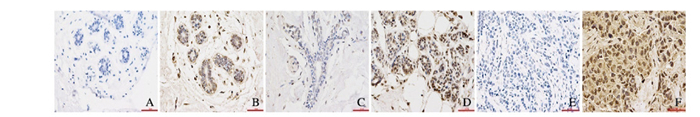
|
| A, C, E: Negative expression of TM4SF1 protein; В, D, F: Positive expression of TM4SF1 protein; A-B: Normal breast tissue; C-D:Paracancerous tissue; E, F: Breast cancer tissue. 图 1 免疫组织化学法检测正常乳腺组织、癌旁组织和乳腺癌组织中TM4SF1蛋白的表达(SP, ×400) Figure 1 Expressions of TM4SF1 protein in normal breast tissue, paracanccrous tissue and breast cancer tissue detected by immunohistochemistry (SP, ×400) |
|
|
| Group | n | TM4SF1 expresion [n(η/%)] | χ2 | P | |
| Positive | Negative | ||||
| Normal breast tissue | 110 | 25(22.7) | 85(77.3) | 0.393 | 0.531 |
| Paracancerous tissue | 110 | 29(26.4) | 81(73.6) | 41.041 | 0.000 |
| Breast cancer tissue | 190 | 123(64.7) | 67(35.3) | 49.188 | 0.000 |
TM4SF1表达与乳腺癌患者年龄无明显关联,与肿瘤大小、分化程度、淋巴结转移、肿瘤分期、病理分子分型有密切关联(P<0.001);肿块越大、分化程度越低、淋巴结转移越多、分期越晚,TM4SF1表达水平越高(P<0.05)。见表 2。
| Clinicopathological parameter | n | TM4SF1 expression[n(η/%)] | χ2 | P | |
| Positive(+) | Negative(-) | ||||
| Age(year) | |||||
| <40 | 21 | 12(57.1) | 9(42.9) | 1.022 | 0.600 |
| 40-60 | 105 | 67(63.8) | 38(36.2) | ||
| >60 | 64 | 44(68.8) | 20(31.2) | ||
| Tumor size(cm) | |||||
| ≤2 | 61 | 24(39.3) | 37(60.7) | 25.455 | 0.000 |
| >2 and≤5 | 114 | 87(76.3) | 27(23.7) | ||
| >5 | 15 | 12(80.0) | 3(20.0) | ||
| Differentiation | |||||
| Well | 27 | 11(40.7) | 16(59.3) | 10.027 | 0.007 |
| Moderate | 115 | 75(65.2) | 40(34.8) | ||
| Poor | 48 | 37(77.0) | 11(22.9) | ||
| Lymph node metastasis | |||||
| Yes | 68 | 56(82.4) | 12(17.6) | 14.396 | 0.000 |
| No | 122 | 67(54.9) | 55(45.1) | ||
| AJCC stage | |||||
| Ⅰ | 56 | 24(42.9) | 32(57.1) | 22.126 | 0.000 |
| Ⅱ | 79 | 52(65.8) | 27(34.2) | ||
| Ⅲ | 55 | 47(85.4) | 8(14.5) | ||
| Molecular type | |||||
| Luminal A | 75 | 41(54.7) | 34(45.3) | 9.269 | 0.026 |
| Luminal B | 47 | 29(61.7) | 18(62.1) | ||
| Her-2 overexpression | 29 | 19(65.5) | 10(34.5) | ||
| Basal-like | 39 | 34(87.2) | 5(12.8) | ||
由表 2可知,不同病理类型乳腺癌患者乳腺癌组织中TM4SF1阳性表达率存在差异,故继续进行两两比较,结果显示:基底样型乳腺癌组织中TM4SF1阳性表达率最高为87.2%(34/39),与其他3种病理类型比较差异有统计学意义(P<0.05)。见表 3。
| Group | TM4SF1 expression | χ2 | P | |
| Positive | Negative | |||
| Luminal A Luminal B |
41 29 |
34 18 |
0.585 | 0.444 |
| Luminal A Her-2 overexpression |
41 19 |
34 10 |
1.009 | 0.315 |
| Luminal A Basal-like |
41 34 |
34 5 |
12.051 | 0.001 |
| Luminal B Her-2 overexpression |
29 19 |
18 10 |
0.112 | 0.738 |
| Luminal B Basal-like |
29 34 |
18 5 |
7.062 | 0.008 |
| Her-2 overexpression Basal-like |
19 34 |
10 5 |
4.540 | 0.034 |
乳腺癌组织、癌旁组织和正常乳腺组织中目的基因的相对灰度值分别为0.999±0.030、0.296±0.021和0.247±0.028,即乳腺癌组织中TM4SF1表达水平高于癌旁组织和正常组织,差异具有统计学意义(F=407.7,P<0.000 1);癌旁组织与正常乳腺组织的表达水平比较差异无统计学意义(t=0.49, P>0.05)。见图 2。
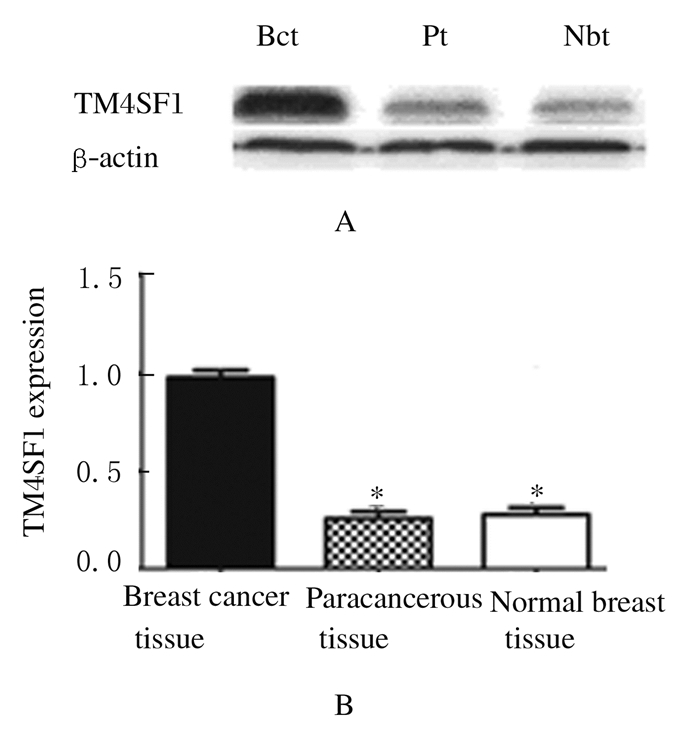
|
| *P < 0.05vs breast cancer tissue.Bct: Breast cancer tissue;Pt:Paracancerous tissue;Nbt:Normal breast tissue. 图 2 Western blotting法检测乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1的表达电泳图(A)和直条图(B) Figure 2 Electrophoregram(A) and histogram(B) of expressions of TM4SF1 protein in breast cancer tissue, paracancerous tissue and normal breast tissue detected by Western blotting method |
|
|
乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1 mRNA相对表达水平为5.06±0.65、1.14±0.67和1.02±0.17(F=32.79,P<0.01),即乳腺癌组织中TM4SF1mRNA相对表达水平高于癌旁组织和正常乳腺组织(P<0.01),癌旁组织与正常乳腺组织中TM4SF1 mRNA的表达水平比较差异无统计学意义(t=0.48,P>0.05)。见图 3。

|
| *P < 0.05 vs breast cancer tissue. 图 3 RT-PCR法检测乳腺癌组织、癌旁组织和正常乳腺组织中TM4SF1 mRNA表达直条图 Figure 3 Histogram of expressions of TM4SF1 mRNA in breast cancer tissue, paracancerous tissue and normal breast tissue detected by RT-PCR method |
|
|
近年来我国乳腺癌发病率呈逐年升高趋势,乳腺癌具有侵袭性强和难治愈的特点,因此,深入研究乳腺癌相关基因及其分子生物学机制对于临床诊断、治疗及预防非常重要。
TM4SF1属于跨膜蛋白家族成员之一,又称为肿瘤相关抗原L6(tumor-associated antigen L6),TM4SF1基因位于人体3号染色体(3q21~3q25),其编码的TM4SF1是一种低相对分子质量糖蛋白,相对分子质量为21 000 ~28 000,1992年由Marken克隆并鉴定,全长为202个氨基酸。TM4SF1是四次跨膜蛋白超家族成员之一,该家族的跨膜蛋白拥有高度保守的跨膜区, 这些跨膜区可能参与了多种信号传导通路,可以调控细胞的增殖、活化、黏附及肿瘤侵袭转移,其家族成员还包含TM4SF4、TM4SF5、TM4SF18、TM4SF19和TM4SF20[6],TM4SF1是首次发现于肺癌的免疫治疗的一种抗原, 目前在多种上皮性肿瘤细胞中已发现其高表达,如肺癌、卵巢癌、甲状腺癌和结肠癌等[7],而且TM4SF1可参与多种肿瘤的发生发展。
本研究采用免疫组织化学法、Western blotting及RT-PCR法证实在乳腺癌组织中TM4SF1表达水平明显高于癌旁组织及正常乳腺组织,并且肿块越大、分化程度越低、淋巴结转移越多、分期越晚,TM4SF1表达水平越高;在AJCC分期中Ⅲ期TM4SF1阳性表达率高于Ⅰ期和Ⅱ期,基底样型乳腺癌组织中TM4SF1阳性表达率最高,基底样型乳腺癌恶性程度高,容易较早出现转移,提示乳腺癌组织中TM4SF1可能参与了肿瘤的发生发展、侵袭与转移,但目前TM4SF1的生物学作用机制尚未完全明确。研究[8]显示:TM4SF1可通过以下途径促进肿瘤的侵袭与转移。首先,TM4SF1可通过促进肿瘤血管内皮细胞的迁移,诱导血管新生而间接促进肿瘤侵袭与转移;其次,TM4SF1可增强肿瘤细胞与细胞外基质间的相互作用而促进肿瘤细胞的侵袭和转移。Zukauskas等[9]发现:高表达的TM4SF1参与肿瘤细胞的伪足形成,从而促进肿瘤侵袭和转移。Gao等[10]指出:TM4SF1能够激活Rho信号通路从而介导上皮间质转化(EMT),进而参与肿瘤细胞的浸润转移。研究[11-12]证明:PI3K/Akt/mTOR信号通路活化是肿瘤细胞增殖、转移及抗凋亡的重要环节,mTOR阳性表达明显增加了乳腺癌患者复发、转移及死亡的风险,与单药依西美坦比较,使用mTOR抑制剂依维莫司联合依西美坦患者中位无进展生存时间(PFS)明显延长,TM4SF1对乳腺癌MDA-MB-231细胞侵袭和凋亡的影响及其机制通过PI3K/Akt/mTOR信号通路实现的[13]。研究[14-17]显示:TM4SF1是间皮瘤细胞凋亡的负调控因子,表明其具有成为治疗肿瘤靶点的潜力。本课题组前期实验[15]已经证实:TM4SF1在人乳腺癌MCF-7和MDA-MB-231细胞中呈高表达,并可增强乳腺癌细胞的迁移能力。因此,本文作者推测:TM4SF1可能是乳腺癌细胞凋亡的负调节因子,TM4SF1过表达可能与晚期乳腺癌转移有密切关联。另外,本研究通过miRNA预测软件TargetScan6.2预测TM4SF1可能是miR-141的直接靶基因之一,TM4SF1在乳腺癌中被miR-141调控的过程可能在乳腺癌的发生发展中起重要作用。
综上所述,TM4SF1在乳腺癌组织中呈高表达,基底样型乳腺癌组织中TM4SF1蛋白阳性表达率最高,TM4SF1可能通过多种机制影响乳腺癌的发生发展及转移,TM4SF1可能成为乳腺癌治疗潜在的靶点。TM4SF1可成为乳腺癌一个新的分子干预靶点和肿瘤进展的早期标志, 也为治疗乳腺癌浸润转移提供一种新的治疗思路和方法。但TM4SF1在乳腺癌中的深层作用机制仍需要进一步研究。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | Aceto N, Bardia A, Miyamoto DT, et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis[J]. Cell, 2014, 158(5): 1110–1122. DOI:10.1016/j.cell.2014.07.013 |
| [3] | Cao J, Yang JC, Ramachandran V, et al. TM4SF1 regulates pancreatic cancer migration and invasion in vitro and in vivo[J]. Cell Physiol Biochem, 2016, 39(2): 740–750. DOI:10.1159/000445664 |
| [4] | Huang YK, Fan XG, Qiu F. TM4SF1 promotes proliferation, invasion, and metastasis in human liver cancer cells[J]. Int J Mol Sci, 2016, 17(5): 661–680. DOI:10.3390/ijms17050661 |
| [5] | Xue L, Yu X, Jiang X, et al. TM4SF1 promotes the self-renewal of esophageal cancer stem-like cells and is regulated by miR-141[J]. Oncotarget, 2017, 8(12): 19274–19284. |
| [6] | Lin CI, Merley A, Sciuto TE, et al. TM4SF1:a new vascular therapeutic target in cancer[J]. Angiogenesis, 2014, 17(4): 897–907. DOI:10.1007/s10456-014-9437-2 |
| [7] | Yang H, Shen C, Zhang B, et al. Expression and clinicopathological significance of CD9 in gastrointestinal stromal tumor[J]. J Korean Med Sci, 2013, 28(10): 1443–1448. DOI:10.3346/jkms.2013.28.10.1443 |
| [8] | Lekishvili T, Fromm E, Mujoomdar M, et al. The tumour-associated antigen L6(L6-Ag) is recruited to the tetraspanin-enriched microdomains:implication for tumour cell motility[J]. J Cell Sci, 2008, 121(Pt 5): 685–694. |
| [9] | Zukauskas A, Merley A, Li D, et al. TM4SF1:a tetraspanin-like protein necessary for nanopodia formation and endothelial cell migration[J]. Angiogenesis, 2011, 14(3): 345–354. DOI:10.1007/s10456-011-9218-0 |
| [10] | Gao H, Chakraborty G, Lee-Lim AP, et al. Forward genetic screens in mice uncover mediators and suppressors of metastatic reactivation[J]. Proc Natl Acad Sci USA, 2014, 111(46): 16532–16537. DOI:10.1073/pnas.1403234111 |
| [11] | 丁显飞, 周学良, 豆萌萌, 等. 哺乳动物雷帕霉素靶蛋白的表达及其与乳腺癌预后关系的Meta分析[J]. 吉林大学学报:医学版, 2016, 42(4): 783–788. |
| [12] | 何悦铭, 康丽花, 王倩, 等. 雌激素受体阳性乳腺癌患者内分泌耐药机制的研究进展[J]. 吉林大学学报:医学版, 2017, 43(2): 454–458. |
| [13] | Sun Y, Xu Y, Xu J, et al. Role of TM4SF1 in regulating breast cancer cell migration and apoptosis through PI3K/AKT/mTOR pathway[J]. Int J Clin Exp Pathol, 2015, 8(8): 9081–9088. |
| [14] | Gordon GJ, Bueno R, Sugarbaker DJ. Genes associated with prognosis after surgery for malignant pleural mesothelioma promote tumor cell survival in vitro[J]. BMC Cancer, 2011, 11(1): 169–170. DOI:10.1186/1471-2407-11-169 |
| [15] | 张卫芳, 孙燕, 张伟杰, 等. TM4SF1在人乳腺癌细胞MCF-7和MDA-MB-231中的表达及其对细胞增殖、迁移能力的影响[J]. 郑州大学学报:医学版, 2016, 51(2): 240–244. |
| [16] | 王若冰, 叶思杨, 李董董, 等. AKT、LDH及NMHCⅡA在乳腺组织中的表达及相关性研究[J]. 中国实验诊断学, 2017, 21(10): 1687–1689. DOI:10.3969/j.issn.1007-4287.2017.10.004 |
| [17] | 赵俊军, 吕娇, 李平. Cripto-1蛋白、E-钙粘蛋白和波形蛋白在乳腺癌中的表达及其意义[J]. 中国实验诊断学, 2017, 21(1): 17–21. |
 2017, Vol. 43
2017, Vol. 43


