扩展功能
文章信息
- 曹艳莎, 李婳, 陈明红, 刘宝琴, 王华芹, 李宁
- CAO Yansha, LI Hua, CHEN Minghong, LIU Baoqin, WANG Huaqin, LI Ning
- 组织芯片技术检测BAG3蛋白在结肠癌组织中的表达及其临床意义
- Expression of BAG3 protein in colon cancer tissue detected by tissue microarray method and its clinical significance
- 吉林大学学报(医学版), 2017, 43(06): 1177-1181
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1177-1181
- 10.13481/j.1671-587x.20170620
-
文章历史
- 收稿日期: 2017-03-13
2. 中国医科大学生物化学教研室, 辽宁 沈阳 110000
2. Department of Biochemistry, Chinese Medical University, Shenyang 110000, China
Bcl相关抗凋亡蛋白3又称BAG3蛋白,是抗凋亡家族BAG蛋白家族中的重要成员,其羧基端进化上高度保守,该区域和热休克蛋白HSP70是共分子伴侣,具有共同调节分子伴侣的功能。研究[1]显示:BAG3蛋白可以控制错误折叠蛋白质进行选择性降解的自噬过程。BAG3蛋白参与多种肿瘤细胞的增殖、凋亡、迁移、侵袭和上皮间质转换(epithelial-mesenchymal transition, EMT)等一系列生物行为。另外BAG3蛋白在人类多种原发恶性肿瘤组织中呈高表达,如白血病、前列腺癌、神经胶质瘤和神经母细胞瘤等[2-3],但是其在结肠癌组织中表达及其与患者临床病理参数关系、对预后影响的报道却很少。本研究利用结肠癌组织芯片检测BAG3蛋白在结肠癌组织中的表达,探讨BAG3蛋白与结肠癌发生发展及预后的关系。
1 资料与方法 1.1 一般资料结肠癌组织芯片(Hcol-Ade180Sur-04)购自上海芯超生物科技有限公司。收集90例结肠癌患者结肠癌组织和癌旁组织标本,其中女性43例,男性47例,年龄24~90岁,平均年龄(68.875±10.843)岁。所有患者术前均未行放、化疗,诊断均经术后病理结果证实。结肠癌和癌旁组织统一经10%甲醛固定,石蜡包埋,置于4℃保存[4]。
1.2 免疫组织化学染色观察结肠癌和癌旁组织中BAG3蛋白表达二甲苯和梯度乙醇进行脱蜡、水化,枸橼酸钠缓冲液高压修复2 min,3%过氧化氢孵育封闭内源性过氧化氢酶,BAG3抗体1:200稀释(美国NBP1公司),加入辣根过氧化物酶标记的二抗,DAB显色(二抗和DAB显色试剂盒均购置于北京中杉金桥公司),苏木精复染、脱水、封片,拍照;由2名临床和病理专家对染色结果进行判定。BAG3蛋白在细胞质中表达,以抗体在细胞质中出现棕黄色或棕褐色颗粒判定为阳性反应,对结果进行半定量分析。染色强度评分:0分(阴性),1分(+),2分(++),3分(+++);染色阳性率评分:0分(阴性),1分(1%~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)[5-6];以“染色强度评分”和“染色阳性率评分”的乘积作为总评分并进行分组,0~5分为抗体低表达组,6~12分为抗体高表达组。
1.3 统计学分析采用SPSS17.0统计软件进行统计学分析。结肠癌和癌旁组织中BAG3蛋白的阳性表达率比较采用χ2检验;不同临床病理参数患者结肠癌组织和癌旁组织中BAG3蛋白阳性表达率比较采用χ2检验;生存曲线分析采用Kaplan-Meier法,单因素生存分析采用Log-rank检验,多因素生存分析采用Cox风险回归模型。以P<0.05表示差异有统计学意义。
2 结果 2.1 结肠癌组织中BAG3蛋白表达组织芯片180个位点结构保存良好,双芯布阵,排列较整齐,整体染色结果较好,未发现明显的坏死组织。免疫组织化学染色结果显示:阳性染色呈棕黄色颗粒,BAG3蛋白阳性染色位于在结肠癌细胞质中,见图 1(插页五)。对90例结肠癌和癌旁组织染色结果评分后进行χ2检验, 结肠癌组织中BAG3蛋白阳性表达率为37.8%, 癌旁组织中BAG3蛋白阳性表达率为0.01%,两者比较差异有统计学意义(P=0.000)。见表 1。
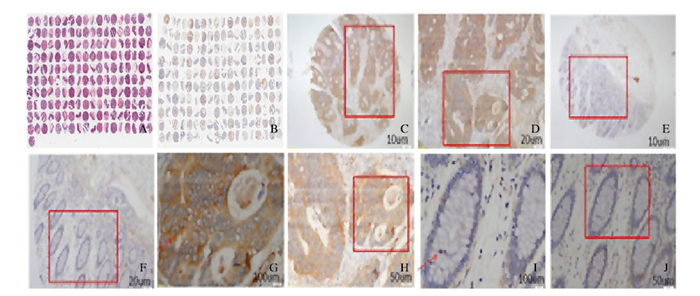
|
| A: HE; B: Immunohistochemistiy; C-F:Positive expression of BAG3 in colon cancer tissue(Bar=10, 20, 100 and 50 μm); G-J:Negative expression of BAG3 in paracancerous tissue(Bar=10, 20, 100, and 50 μm). 图 1 结肠癌组织和癌旁组织中BAG3蛋白的表达情况 Figure 1 Expressions of BAG3 protein in colon cancer and paracancerous tissues |
|
|
| (n=90) | ||||
| Tissue | Expression of BAG3 protein | χ2 | P | |
| 0-5scores | 6-12scores | |||
| Colon cancer | 56 | 34 | 38.625 | 0.000 |
| Paracancerous | 89 | 1 | ||
结肠癌组织中BAG3蛋白表达与患者性别和肿瘤直径有关联(P<0.05),女性患者BAG3蛋白阳性表达率高于男性,肿瘤直径>5cm的患者BAG3蛋白阳性表达率高于肿瘤直径≤5cm患者(P<0.05);结肠癌组织中BAG3蛋白表达与年龄、病理分级、TNM分期和有无淋巴结转移无关联(P>0.05)。见表 2。
| Clinicopathological parameter | n | Expression of BAG3 | χ2 | P | |
| 0-5 scores (Low) | 6-10 scores (High) | ||||
| Gender | |||||
| Male | 47 | 34 | 13 | 4.284 | 0.038 |
| Female | 43 | 22 | 21 | ||
| Age(year) | |||||
| ≤65 | 35 | 20 | 15 | 0.379 | 0.538 |
| >65 | 55 | 35 | 20 | ||
| Tumor size(cm) | |||||
| ≤5 | 47 | 37 | 10 | 11.328 | 0.001 |
| >5 | 41 | 18 | 23 | ||
| Pathological classification | |||||
| Ⅰ | 5 | 5 | 0 | 4.600 | 0.100 |
| Ⅱ | 49 | 32 | 17 | ||
| Ⅲ | 36 | 19 | 17 | ||
| Ⅳ | 0 | 0 | 0 | ||
| TNM grade | |||||
| Ⅰ | 8 | 5 | 3 | 2.531 | 0.470 |
| Ⅱ | 47 | 33 | 14 | ||
| Ⅲ | 32 | 17 | 15 | ||
| Ⅳ | 2 | 1 | 1 | ||
| Lymph node metastasis | |||||
| Positive | 4833 | 3118 | 1715 | 0.824 | 0.364 |
| Negative | 33 | 18 | 15 | ||
单因素生存和多因素生存分析:BAG3蛋白表达水平与患者的性别、病理分级、肿瘤大小和生存率均无关联性(P=0.069,P=0.348,P=0.222,P=0.204),可能与样本数量及样本的选取有关。而年龄、TNM分期、淋巴结转移与患者的生存率存在明显关联(P<0.05)。见图 2。将单因素分析中差异有统计学意义的变量纳入COX多因素生存回归分析:TNM分期越高、年龄越大的患者预后越差,生存率越低,但由于TNM分期Ⅰ期和Ⅳ期的患者较少,尚不能说明TNM分期一定是影响患者预后的危险因素,两者有可能是影响结肠癌患者预后的危险因素(OR=2.312,OR=6.401),肿瘤TNM分期对生存率及预后的影响大于年龄,淋巴结转移可能不是影响预后的独立危险因素(P=0.112)。见表 3。
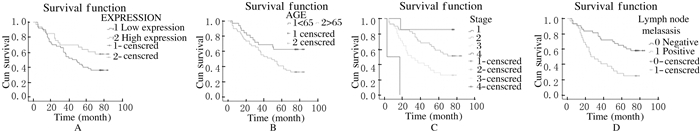
|
| A: BAG3 protein; B:Age; C: TNM grade; D: Lymph node metastasis. 图 2 结肠癌患者的Kaplan-Meier生存曲线 Figure 2 Kaplan-Meier survival curves of colon cancer patients |
|
|
| Parameter | n | Univariate regression | Multivariate regression | |||||
| HR | 95% CI | P | HR | 95% CI | P | |||
| Gender | ||||||||
| Male | 47 | 1.319 | 0.736-2.364 | 0.352 | - | - | - | |
| Female | 43 | |||||||
| Age(year) | ||||||||
| ≤65 | 35 | 0.469 | 0.242-0.910 | 0.025 | 2.312 | 1.123-4.761 | 0.023 | |
| >65 | 55 | |||||||
| Tumor size(cm) | ||||||||
| ≤ 5 | 47 | 0.689 | 0.386-1.231 | 0.209 | - | - | - | |
| >5 | 41 | |||||||
| Pathological classification | ||||||||
| Ⅰ | 5 | - | - | 0.234 | - | - | - | |
| Ⅱ | 49 | |||||||
| Ⅲ | 36 | |||||||
| Ⅳ | 0 | |||||||
| TNM grade | ||||||||
| Ⅰ | 8 | - | - | 0.001 | 6.401 | 1.994-20.552 | 0.002 | |
| Ⅱ | 47 | |||||||
| Ⅲ | 32 | |||||||
| Ⅳ | 2 | |||||||
| Lymph node metastasis | ||||||||
| Positive | 48 | 0.379 | 0.204-0.704 | 0.002 | 0.315 | 0.076-1.307 | 0.112 | |
| Negitive | 33 | |||||||
| BAG3 expression | ||||||||
| Low | 56 | 1.774 | 0.945-3.330 | 0.075 | - | - | - | |
| High | 34 | |||||||
| “-”:No data. | ||||||||
结肠癌发病率居胃肠道肿瘤的第3位,也是世界上癌症死亡的第四大原因[7]。恶性肿瘤的发生发展是一个多因素、多机制的复杂过程,涉及多种蛋白和因子的异常表达[8-9]。BAG3蛋白为一种抗凋亡蛋白,是BAG家族的重要成员,在进化上高度保守,大多分布于细胞浆中,其相对分子质量约为74000。研究[1-2]表明:在多种恶性肿瘤中BAG3蛋白表达量升高,如白血病、前列腺癌、神经母细胞瘤和卵巢癌等,BAG3还参与调节很多癌细胞的生物学行为,如细胞凋亡,细胞增殖、侵袭、迁移和细胞自噬。
在某些肿瘤细胞如白血病、实体性肿瘤细胞中,BAG3蛋白表达水平较高,已经证实在多种应激条件下(如高温、重金属和蛋白酶体抑制剂等)BAG3蛋白的表达水平升高,进而促进细胞存活,抑制细胞凋亡的发生;如果降低BAG3蛋白的表达则会促进细胞凋亡。BAG3蛋白具有多种生物学功能,如参与调控生长发育、抑制细胞凋亡、促进肿瘤黏附和转移以及EMT等。研究[10-11]显示:BAG3蛋白在多种肿瘤细胞中表达上调,BAG3蛋白在某些类型白血病中具有促进生存作用,在多种不同组织来源的肿瘤细胞内,干扰或者过表达BAG3蛋白能够分别增强或者抑制抗肿瘤药物诱导的细胞凋亡,说明BAG3蛋白具有广泛的抗凋亡作用。研究[3]显示:BAG3蛋白可通过与Bcl-2相互作用增强Bcl-2的活性,从而促进细胞生存和肿瘤转移。多种肿瘤患者治疗效果较差均与之有关[12-13]。
研究[3]表明:BAG3蛋白在人髓母细胞瘤中表达量上调,且与TNM分期明显相关,BAG3蛋白表达与患者的生存率有显著相关性,BAG蛋白高表达的患者预后较差。单因素分析结果显示:患者预后与BAG3蛋白表达、是否转移、TNM分期和治疗策略有关,且差异有统计学意义。
BAG3蛋白在很多恶性肿瘤组织中表达量上调,并参与了肿瘤形成的不同进程,可能与某些肿瘤的预后存在相关性,而关于BAG3蛋白在结肠癌组织中的表达是否存在异常尚无报道。为明确BAG3蛋白在结肠癌组织中的表达情况,本文作者选择了90例结肠癌患者结肠癌和癌旁组织芯片用于免疫组织化学胞浆染色实验,结果表明:在结肠癌组织中,BAG3蛋白表达水平明显高于癌旁组织,说明BAG3蛋白与结肠癌发生发展存在关联。在90例结肠癌患者的癌组织中,BAG3蛋白表达虽然与年龄、病理分级、TNM分期和有无淋巴结转移无关联,但是与肿瘤大小和性别有关联。90例结肠癌患者COX模型多因素分析结果表明:TNM分期越高、年龄越大的患者预后越差,生存率越低,两者均是结肠癌患者预后的危险因素。≤65岁和>65岁患者的生存曲线不同,≤65岁患者的5年生存率为68.4%,>65岁患者的5年生存率为28.4%,组间比较差异有统计学意义,说明年龄≤65岁患者生存率高于年龄>65岁的患者,年龄越大,预后越差。TNM分期不同的患者生存曲线不同,TNMⅠ期、Ⅱ期、Ⅲ期和Ⅳ期患者的5年生存率分别为84.2%、58.6%、28.4%和0%,组间比较差异有统计学意义,但由于TNM分期Ⅰ期和Ⅳ期的患者数较少,尚不能说明TNM分期一定是影响患者预后的危险因素,但是也可以看出TNM分期Ⅱ期患者的5年生存率明显高于Ⅲ期,说明加大样本量则可以进一步阐明TNM分期与生存的关系。有淋巴结转移的患者5年生存率为35.5%,而无淋巴结转移的患者5年生存率则为62.8%,组间比较差异有统计学意义,说明无淋巴结转移患者的生存率高于有淋巴结转移的患者,淋巴结转移是影响预后的因素。
本研究结果显示:结肠癌组织中BAG3蛋白表达水平升高,且BAG3蛋白表达与肿瘤大小有关联,TNM分期和年龄有可能是影响结肠癌患者预后的影响因素,提示BAG3蛋白可能是结肠癌的生物学标志物,参与了结肠癌的发生发展,为结肠癌的生物靶向治疗提供了新的思路。
| [1] | Rodríguez AE, López-Crisosto C, Peña-Oyarzún D, et al. BAG3 regulates total MAP1LC3B protein levels through a translational but nottranscriptional mechanism[J]. Autophagy, 2016, 12(2): 287–296. DOI:10.1080/15548627.2015.1124225 |
| [2] | Shi H, Xu H, Li Z, et al. BAG3 regulates cell proliferation, migration, and invasion in human colorectal cancer[J]. Tumour Biol, 2016, 37(4): 5591–5597. DOI:10.1007/s13277-015-4403-1 |
| [3] | Rosati A, Graziano V, De Laurenzi V, et al. BAG3:a multifaceted protein that regulates major cell pathways[J]. Cell Death Dis, 2011, 2: e141. DOI:10.1038/cddis.2011.24 |
| [4] | 强欣, 霍文艳, 杨灿, 等. p16INK4a蛋白在蒙古族患者宫颈病变组织中的表达及其意义[J]. 吉林大学学报:医学版, 2017, 43(3): 353–355. |
| [5] | Zhu L, Tian GG, Yang Q, et al. Thyroid hormone receptor β1 suppresses proliferation and migration by inhibiting PI3K/Akt signaling in human colorectal cancer cells[J]. Oncol Rep, 2016, 36(3): 1419–1426. DOI:10.3892/or.2016.4931 |
| [6] | Li Q, Wei P, Huang B, et al. MAEL expression links epithelial-mesenchymal transition and stem cell properties in colorectal cancer[J]. Int J Cancer, 2016, 139(11): 2502–2511. DOI:10.1002/ijc.30388 |
| [7] | 张宇, 卫子然, 杨德君, 等. Ras相关区域家族10蛋白在胃癌中的表达及其临床意义[J]. 第二军医大学学报, 2016, 37(5). |
| [8] | Oliver Metzig M, Fuchs D, Tagscherer KE, et al. Inhibition of caspases primes colon cancer cells for 5-fluorouracil-induced TNF-α-dependent necroptosis driven by RIP1 kinase and NF-κB[J]. Oncogene, 2016, 35(26): 3399–3409. DOI:10.1038/onc.2015.398 |
| [9] | Lee MY, Kim SY, Choi JS, et al. Induction of Bis, a Bcl-2-binding protein, in reactive astrocytes of the rat hippocampus following kainic acid-induced seizure[J]. Exp Mol Med, 2002, 34(2): 167–171. DOI:10.1038/emm.2002.24 |
| [10] | Arndt V, Dick N, Tawo R, et al. Chaperone-assisted selective autophagy is essential for muscle maintenance[J]. Curr Biol, 2010, 20(2): 143–148. DOI:10.1016/j.cub.2009.11.022 |
| [11] | Gamerdinger M, Hajieva P, Kaya AM, et al. Protein quality control during aging involves recruitment of the macroautophagy pathway by BAG3[J]. EMBO J, 2009, 28(7): 889–901. DOI:10.1038/emboj.2009.29 |
| [12] | Gamerdinger M, Carra S, Behl C. Emerging roles of molecular chaperones and co-chaperones in selective autophagy:focus on BAG proteins[J]. J Mol Med, 2011, 89(12): 1175–1182. DOI:10.1007/s00109-011-0795-6 |
| [13] | Yang D, Zhou J, Wang H, et al. High expression of BAG3 predicts a poor prognosis in human medulloblastoma[J]. Tumour Biol, 2016, 37(10): 13215–13224. DOI:10.1007/s13277-016-5197-5 |
 2017, Vol. 43
2017, Vol. 43


