扩展功能
文章信息
- 牛会坤, 曲洋明, 李美奇, 李璐, 吕欣, 宋媛媛, 高春时, 李波
- NIU Huikun, QU Yangming, LI Meiqi, LI Lu, LYU Xin, SONG Yuanyuan, GAO Chunshi, LI Bo
- 新辅助化疗联合卡培他滨治疗乳腺癌疗效和不良反应的Meta分析
- Meta-analysis on efficacy and adverse effects of neoadjuvant chemotherapy combined with capecitabine in treatment of breast cancer
- 吉林大学学报(医学版), 2017, 43(06): 1171-1176
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1171-1176
- 10.13481/j.1671-587x.20170619
-
文章历史
- 收稿日期: 2017-06-08
乳腺癌是妇女中最为常见的恶性肿瘤,是癌症死亡的第2大原因[1]。乳腺癌患者接受手术或放疗等局部治疗前,应用新辅助化疗可以减小肿瘤体积,降低肿瘤的临床分期,消除小的转移病灶[2-3]。目前使用最广泛的新辅助化疗药物为蒽环类或紫杉类[4]。多西他赛作为紫杉类新辅助化疗药物,是抗乳腺癌最有效的细胞毒性剂之一[5]。卡培他滨作为口服氟尿嘧啶类药物,在2006年已经被用于治疗晚期乳腺癌[6]。目前,已有多项关于新辅助化疗联合卡培他滨与单用新辅助化疗治疗乳腺癌疗效比较的研究[6-15],但研究结果不一致。本研究采用Cochrane系统评价方法,在蒽环类药物治疗基础上,对卡培他滨联合多西他赛与单用多西他赛的疗效进行客观评价,以期为卡培他滨在乳腺癌治疗中的应用提供参考依据。
1 资料与方法 1.1 文献纳入和排除标准纳入标准:①研究对象:经组织学或细胞学确诊为未治的、可手术的各期原发且未发生远处转移的乳腺癌患者;②干预措施:乳腺癌手术前,在蒽环类药物治疗基础上采用卡培他滨联合多西他赛或单用多西他赛(蒽环类药物的用药种类、疗程和剂量不限,卡培他滨和多西他赛疗程、剂量和添加顺序不限,蒽环类药物、卡培他滨和多西他赛的用药顺序不限);③结局指标:主要结局指标为完全病理缓解率(pCR)、无复发生存率(RFS)和无病生存率(DFS),次要结局指标为各种不良反应发生情况;④研究类型:随机对照试验。
排除标准:①事先接受过其他药物治疗或化疗方案;②有严重的心血管系统疾病或身体一般状况不佳者;③使用蒽环类药物后根据患者的反应将患者分组给予多西他赛联合卡培他滨或单用多西他赛。
1.2 检索策略计算机检索PubMed、EMBase、CNKI、VIP和万方数据库中已发表的文献,检索关键词为“卡培他滨”、“多西他赛”、“乳腺癌”。语种限制为英文和中文。检索时间截至2017年4月。
1.3 文献筛选由2名经过培训的评价员独立完成,意见不一致时讨论解决或交由第三方判定。阅读初步检索出的所有文献的题目和摘要,找出可能符合要求的文献。若是难以通过题目和摘要判断文献是否符合要求,则通读全文。
1.4 文献质量评价根据改良Jadad量表,从随机序列的产生(2分:恰当;1分:不清楚;0分:不恰当)、随机化隐藏(2分:恰当;1分:不清楚;0分:不恰当或未使用)、盲法(2分:恰当;1分:不清楚;0分:不恰当)和撤退与退出(1分:描述了撤退或退出的数目和理由;0分:未描述撤退或退出的数目和理由)4个方面对所纳入的文献进行质量评价。1~3分为低质量文献,4~7分为高质量文献。
1.5 统计学分析采用Cochrane协作网提供的RevMan5.3统计软件进行Meta分析。对所纳入的文献进行异质性检验,采用I2对异质性的大小进行定量分析,其显著性水平设定为50%,即当I2<50%时,认为结果间存在的异质性较小,采用固定效应模型进行Meta分析;当I2>50%时,认为结果间存在着较大的异质性,则采用随机效应模型进行Meta分析,同时分析异质性来源。采用漏斗图对发表偏倚进行分析。
2 结果 2.1 文献检索共检出相关文献660篇,通过阅读文献题目和摘要,得到可能符合要求的文献37篇,进一步阅读全文后,排除不符合纳入标准的文献27篇,最终有10篇[6-15]文献纳入本研究,共12 012例患者。纳入文献的基本特征见表 1。
| Study | Age(years) | N(T/C) | Drug regimen | Outcome | |
| T | C | ||||
| Joensuu, et al[6] | 18-65 | 744/741 | TX+CEX | T+ FEC | ② |
| Steger, et al [7] | 18-70 | 270/266 | TX+E | X+E | ① |
| Ohno, et al [8] | 20-70 | 239/238 | TX+ FEC | T+ FEC | ①③ |
| Joensuu, et al [9] | 18-65 | 751/744 | TX+CEX | T+ FEC | ② |
| Bear, et al [10] | >18 | 204/199 | TX+AC | T+AC | ③ |
| O’Shaughnessy, et al [11] | 18-70 | 1 307/1 304 | TX+AC | T+AC | ③ |
| von Minckwitz, et al [12] | Not given | 950/471 | T/X+ EC | T+ EC | ① |
| Joensuu, et al [13] | 18-65 | 753/747 | TX+CEX | T+CEF | ② |
| Kelly, et al [14] | Not given | 300/301 | TX+FEC | T+FEC | ①② |
| Bear, et al [15] | Not given | 204/201 | TX+AC | T+AC | ① |
| ①pCR;②RFS;③DFS; T: Docetaxel; X:Capecitabine; C:Cyclophosphamide; E: Epirubicin; F: 5-Fluorouracil; A: Doxorubicin. | |||||
根据改良Jadad量表对所纳入的文献进行质量评价。本研究纳入的10篇文献中高质量文献5篇,低质量文献5篇。
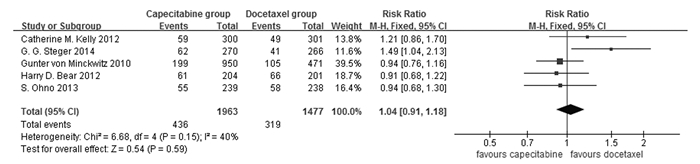
2.3 Meta分析 2.3.1 pCR5篇文献报道了pCR,包括3 440例患者。异质性检验结果为I2 = 40%,因此,pCR采用固定效应模型进行合并分析。Meta分析结果显示:2组pCR比较差异无统计学意义(RR=1.04, 95%CI: 0.91~1.18, P=0.59),提示基于蒽环类药物治疗基础上多西他赛与卡培他滨联合用药组(联合组)患者的pCR与基于蒽环类药物治疗基础上多西他赛组(多西他赛组)比较PCR差异无统计学意义。见图 1。
|
| 图 1 联合组和多西他赛组患者pCR比较森林图 Figure 1 Forest plot of comparison of pCR of patients between combination group and docetaxel group |
|
|
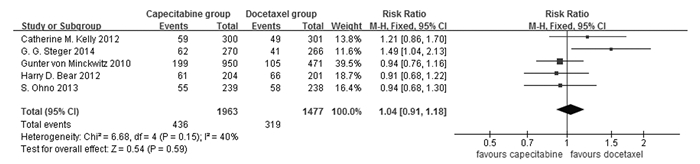
4篇研究报道了RFS,包括5 081例患者。异质性检验结果为I2 = 76%,因此,RFS采用随机效应模型进行合并分析。Meta分析结果显示:实验组与对照组的RFS比较差异无统计学意义(RR=0.86, 95%CI: 0.71~1.03,P=0.10),提示目前尚无证据表明联合组患者RFS优于多西他赛组。见图 2。
|
| 图 2 联合组和多西他赛组患者RFS比较森林图 Figure 2 Forest plot of comparison of RFS of patients between combination group and docetaxel group |
|
|
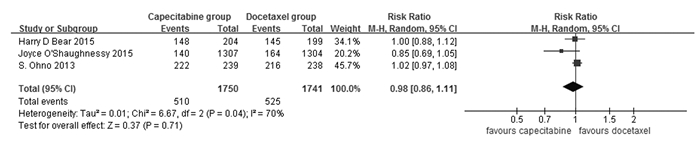
3篇文献报道了DFS,包括3 491例患者。异质性检验结果为I2 = 70%,因此,DFS采用随机效应模型进行合并分析。Meta分析结果显示:2组患者DFS比较差异无统计学意义(RR=0.98, 95%CI: 0.86~1.11,P=0.71),即尚不能认为联合组患者DFS与多西他赛组的差异有统计学意义。见图 3。
|
| 图 3 联合组和多西他赛组患者DFS比较森林图 Figure 3 Forest plot of comparison of DFS of patients between combination group and docetaxel group |
|
|
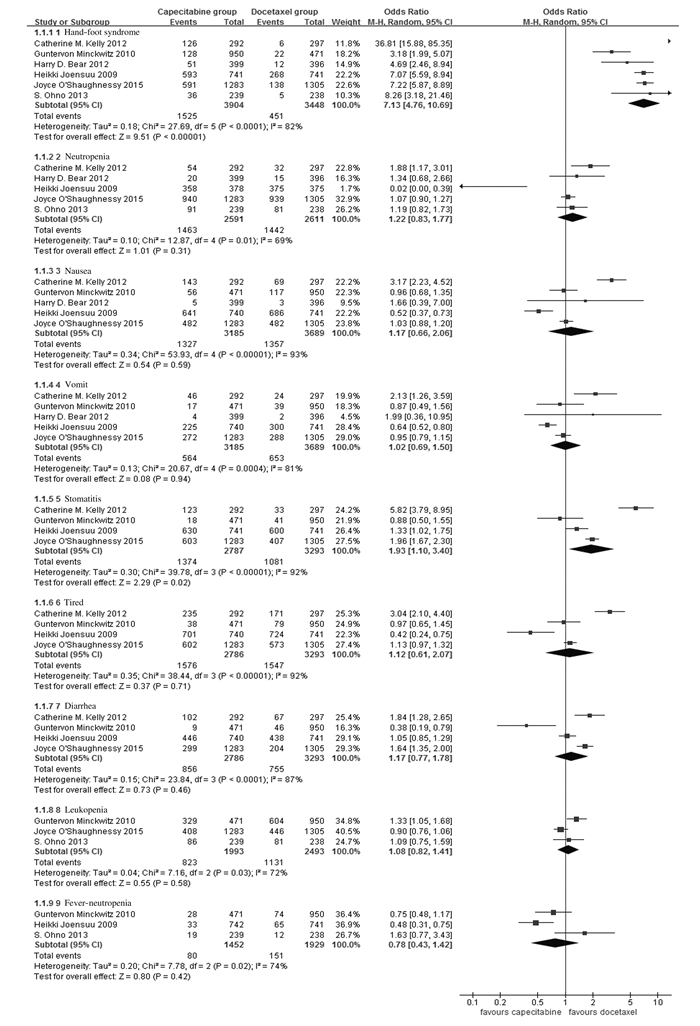
联合组与多西他赛组中性粒细胞减少、恶心、呕吐、疲劳、腹泻、白细胞减少和发热性中性粒细胞减少这些不良反应发生率比较差异无统计学意义(P>0.05)。联合组与多西他赛组患者手足综合征和口腔炎不良反应发生率比较差异有统计学意义(手足综合征:OR=7.13, 95%CI:4.76~10.69,P<0.001,口腔炎:OR=1.93, 95%CI:1.10~3.40,P<0.05)。见图 4。
|
| 图 4 联合组和多西他赛组安全性评价的亚组分析森林图 Figure 4 Forest plot of subgroup analysis of safety evaluation of combination group and docetaxel group |
|
|
以pCR为结局指标的5篇文献基本上呈现出漏斗状分布,且以漏斗图的竖线为中心,5篇文献基本均匀分布在竖线两侧。可以认为pCR为结局指标的5篇文献[7, 8, 12, 14-15]不存在发表偏倚。以RFS、DFS为结局指标的文献数目较少,通过漏斗图来分析文献的发表偏倚意义不大。因此本研究只对以pCR为结局指标的5篇文献绘制了漏斗图。见图 5。
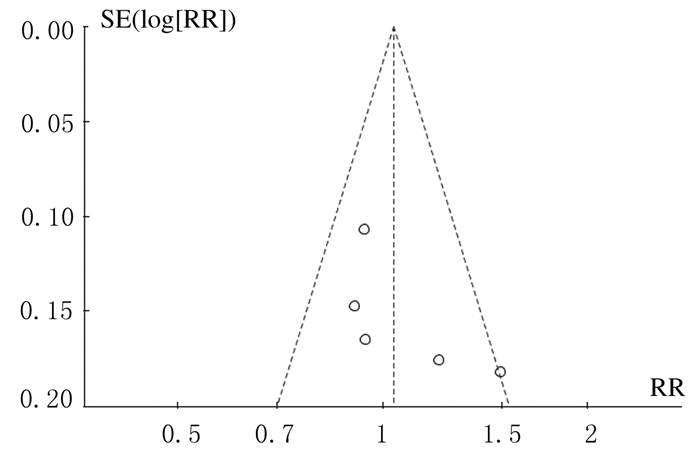
|
| 图 5 联合组和多西他赛组患者pCR漏斗图 Figure 5 Funnel plot of pCR of patients in combination group and docetaxel group |
|
|
本研究结果显示:在蒽环类药物的基础上添加卡培他滨和多西他赛与单用多西他赛的疗效相比并未增加乳腺癌患者的pCR、RFS和DFS。联合组患者中性粒细胞减少、恶心、呕吐、疲劳、腹泻、白细胞减少以及发热性中性粒细胞减少不良反应的发生与多西他赛组比较差异无统计学意义,但是手足综合征和口腔炎不良反应的发生率较高。
尽管在文献纳入标准中有一些不同,但是Li等[4]的Meta分析结果表明:在新辅助化疗中添加卡培他滨并未明显改善乳腺癌患者的pCR,与本研究所得结果相同。研究[16-17]显示:卡培他滨与多西紫杉醇联合使用与单用多西紫杉醇治疗转移性乳腺癌时,卡培他滨与多西紫杉醇联合使用者总生存期与疾病进展时间均优于单用多西紫杉醇者,但是其所纳入的研究对象为转移性乳腺癌患者,与本研究所纳入的研究对象存在较大的差异,可能与将用于治疗转移性乳腺癌的卡培他滨用于治疗初治乳腺癌还存在着一些理论或研究设计或处置上的不足有关。出现这种情况的可能原因:①对于无远处转移也未接受过化疗的,NCCN指南推荐使用蒽环类药物或者紫杉类药物,因此卡培他滨的加入并不能明显提升效果;②卡培他滨的药物毒性使得人们不得不减少其使用剂量,甚至放弃使用卡培他滨[4]。本研究结果证明:与多西他赛组比较,联合组患者手足综合征和口腔炎的发生率升高。
本研究的局限性:①由于乳腺癌化疗药物的多样性,虽然本研究在纳入标准中做了说明,但是对各类药物在使用剂量、施用顺序上并未做相关要求;②本研究所纳入的文献篇数较少,虽然并未具体限制蒽环类药物,但是相关研究的数量并不多。且该类治疗不适合采用盲法。
本研究纳入文献数量较少,但是本研究所纳入的文献均为英文,相对于中文文献质量较高,其中参考文献[6, 7, 10, 13, 15]对随机序列的产生做了相关描述,且大部分文献均采用了意向性分析。本研究结果对今后的临床工作具有重要的指导意义。
| [1] | Bonotto M, Bozza C, Di Loreto C, et al. Making capecitabine targeted therapy for breast cancer:which is the role of thymidine phosphorylase?[J]. Clin Breast Cancer, 2013, 13(3): 167–172. DOI:10.1016/j.clbc.2012.10.002 |
| [2] | 孙强. 对乳腺癌新辅助化疗的理解与遵循原则[J]. 临床药物治疗杂志, 2010, 8(6): 3–8. |
| [3] | Zhang M, Wei W, Liu JL, et al. Comparison of the effectiveness and toxicity of neoadjuvant chemotherapy regimens, capecitabine/epirubicin/cyclophosphamide vs 5-fluorouracil/epirubicin/cyclophosphamide, followed by adjuvant, capecitabine/docetaxel vs docetaxel, in patients with operable breast cancer[J]. Onco Target Ther, 2016, 9: 3443–3450. |
| [4] | Li QY, Jiang Y, Wei W, et al. Clinical efficacy of including capecitabine in neoadjuvant chemotherapy for breast cancer:a systematic review and meta-analysis of randomized controlled trials[J]. PLoS One, 2013, 8(1): e53403. DOI:10.1371/journal.pone.0053403 |
| [5] | Lu YS, Chen DR, Tseng LM, et al. Phase Ⅱ study of docetaxel, capecitabine, and cisplatin as neoadjuvant chemotherapy for locally advanced breast cancer[J]. Cancer Chemother Pharmacol, 2011, 67(6): 1257–1263. DOI:10.1007/s00280-010-1401-2 |
| [6] | Joensuu H, Kellokumpu-Lehtinen PL, Huovinen R, et al. Adjuvant capecitabine in combination with docetaxel and cyclophosphamide plus epirubicin for breast cancer:an open-label, randomised controlled trial[J]. Lancet Oncol, 2009, 10(12): 1145–1151. DOI:10.1016/S1470-2045(09)70307-9 |
| [7] | Steger GG, Greil R, Lang A, et al. Epirubicin and docetaxel with or without capecitabine as neoadjuvant treatment for early breast cancer:final results of a randomized phase Ⅲ study (ABCSG-24)[J]. Ann Oncol, 2014, 25(2): 366–371. DOI:10.1093/annonc/mdt508 |
| [8] | Ohno S, Chow LW, Sato N, et al. Randomized trial of preoperative docetaxel with or without capecitabine after 4 cycles of 5-fluorouracil-epirubicin-cyclophosphamid(FEC) in early-stage breast cancer:exploratory analyses identify Ki67 as a predictive biomarker for response to neoadjuvant chemotherapy[J]. Breast Cancer Res Treat, 2013, 142(1): 69–80. DOI:10.1007/s10549-013-2691-y |
| [9] | Joensuu H, Kellokumpu-Lehtinen PL, Huovinen R, et al. Adjuvant capecitabine in combination with docetaxel, epirubicin, and cyclophosphamide for early breast cancer:the randomized clinical finXX trial[J]. JAMA Oncol, 2017, 3(6): 793–800. DOI:10.1001/jamaoncol.2016.6120 |
| [10] | Beary HD, Tang G, Rastogi P, et al. Neoadjuvant plus adjuvant bevacizumab in early breast cancer (NSABP B-40[NRG Oncology]):secondary outcomes of a phase 3, randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1037–1048. DOI:10.1016/S1470-2045(15)00041-8 |
| [11] | O'Shaughnessy J, Koeppen H, Xiao Y, et al. Patients with slowly proliferative early breast cancer have low five-year recurrence rates in a phase Ⅲ adjuvant trial of capecitabine[J]. Clin Cancer Res, 2015, 21(19): 4305–4311. DOI:10.1158/1078-0432.CCR-15-0636 |
| [12] | von Minckwitz G, Rezai M, Loibl S, et al. Capecitabine in addition to anthracycline-and taxane-based neoadjuvant treatment in patients with primary breast cancer:phase Ⅲ Gepar Quattro study[J]. J Clin Oncol, 2010, 28(12): 2015–2023. DOI:10.1200/JCO.2009.23.8303 |
| [13] | Joensuu H, Kellokumpu-Lehtinen PL, Huovinen R, et al. Adjuvant capecitabine, docetaxel, cyclophosphamide, and epirubicin for early breast cancer:final analysis of the randomized FinXX trial[J]. J Clin Oncol, 2012, 30(1): 11–18. DOI:10.1200/JCO.2011.35.4639 |
| [14] | Kelly CM, Green MC, Broglio K, et al. Phase Ⅲ trial evaluating weekly paclitaxel versus docetaxel in combination with capecitabine in operable breast cancer[J]. J Clin Oncol, 2012, 30(9): 930–935. DOI:10.1200/JCO.2011.36.2079 |
| [15] | Bear HD, Tang G, Rastogi P, et al. Bevacizumab Added to Neoadjuvant Chemotherapy for Breast Cancer[J]. N Engl J Med, 2012, 366(4): 310–320. DOI:10.1056/NEJMoa1111097 |
| [16] | 李亚丽, 肖佳灵, 杨克虎, 等. 卡培他滨联合多烯紫杉醇治疗转移性乳腺癌的系统评价[J]. 中国循证医学杂志, 2009, 9(8): 893–898. DOI:10.7507/1672-2531.20090157 |
| [17] | 黄雅娟, 杜峰, 魏玲丽. 老年乳腺癌的流行病学研究及其对行根治性手术治疗患者生存期的影响[J]. 中国老年学杂志, 2015, 35(13): 3653–3655. DOI:10.3969/j.issn.1005-9202.2015.13.078 |
 2017, Vol. 43
2017, Vol. 43


