扩展功能
文章信息
- 宋见喜, 任婷, 满枋霖, 冯丽娟, 孙新, 佟海滨
- SONG Jianxi, REN Ting, MAN Fanglin, FENG Lijuan, SUN Xin, TONG Haibin
- 柴胡多糖硫酸化修饰条件的优化及其修饰前后抗氧化能力比较
- Optimization of sulfated modification conditions of polysaccharide from Bupleurum Chinense and comparison of their antioxidant abilities between before and after modification
- 吉林大学学报(医学版), 2017, 43(06): 1165-1170
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1165-1170
- 10.13481/j.1671-587x.20170618
-
文章历史
- 收稿日期: 2017-07-05
2. 北华大学生命科学中心 吉林省分子老年医学重点实验室, 吉林 吉林 132013;
3. 中国中医科学院博士后科研流动站 中药资源中心, 北京 100700
2. Life Science Research Center, Jilin Provincial Key Laboratory of Molecular Geriatric Medicine, Beihua University, Jilin 132013, China;
3. Resource Center for Chinese Materia Medica, Center for Post-Doctoral Research, China Academy of Chinese Medical Sciences, Beijing 100700, China
柴胡是我国的传统中药和常用中药,《中华人民共和国药典》(2015年版)记载伞形科多年生草本植物北柴胡(Bupleurum chinense DC.)和狭叶柴胡(南柴胡,Bupleurum scorzonerifolium Willd.)的干燥根为柴胡的药用部位,北柴胡是商品柴胡的主流品种,在我国已有2 000多年的应用历史[1]。柴胡味苦,性微寒,归肝、胆、肺经,具有和解表里、疏肝解郁、升阳举陷和退热截疟之功效,常用于治疗感冒发热、寒热往来、胸满胁痛、肝郁气滞和疟疾等。柴胡含有丰富的活性化学成分,主要包括柴胡皂苷、甾醇、挥发油(柴胡醇、丁香酚等)和多糖等[2]。近些年来国内外的研究主要集中在柴胡皂苷的药效学功能,而关于柴胡多糖(Bupleurum chinense polysaccharides, BCP)的研究报道较少。
天然植物多糖是重要的高分子化合物,除了作为植物的贮藏养料和骨架成分外,其在抗氧化、抗肿瘤和抗心血管疾病等方面也具有独特的生理活性[3]。近年来,对多糖进行化学修饰是一个研究热点[4]。随着人们对多糖化学修饰认知度的提高,多糖的硫酸化修饰越来越受到重视,这主要是因为硫酸酯化后的多糖具有非常突出的生物学功能,Beress等[5]和Hayashi等[6]发现:许多原本具有微弱抗病毒、抗肿瘤活性的多糖,经过硫酸化修饰后,其抗病毒和抗肿瘤活性得到了明显提高。焦中高等[7]研究表明:红枣多糖经硫酸化修饰后,其抗氧化活性明显增强。与其他植物多糖类似,BCP本身具有独特的药用价值,对人体系统性红斑狼疮关节炎、类风湿关节炎和肾炎等常见疾病作用明显[8]。目前,对BCP的硫酸化修饰研究鲜有报道。因此,本实验主要优化了BCP的硫酸化修饰条件,并考察了BCP硫酸化修饰前后其抗氧化能力的变化,旨在为BCP的应用提供参考,同时也为中药柴胡资源的合理开发与利用提供科学依据。
1 材料与方法 1.1 主要试剂和仪器BCP由北华大学生命科学研究中心制备[9],N,N二甲基-甲酰胺、无水乙醇、DMSO、氢氧化钠、氯磺酸、吡啶、硫酸钾、明胶和氯化钡(均为分析纯,天津永大化学试剂有限公司)。水浴超声波(昆山市超声仪器有限公司),高温干燥箱(上海博迅实业有限公司医疗设备厂),紫外光谱(美国瓦里安公司),红外光谱(德国布鲁克公司),扫描电镜(美国FEI公司)。
1.2 硫酸化柴胡多糖(sulfated BCP, S-BCP)的制备称取300 mg BCP溶于20 mL无水甲酰胺中,加入装有酯化剂的三颈烧瓶中,加完后调节温度至60℃,反应2 h。通过加入不同比例氯磺酸与吡啶(1:2、1:4和1:8)制备的酯化试剂(15 mL)得到具有不同取代度(DS)的S-BCP(即S-BCP1-2、S-BCP1-4和S-BCP1-8组),见表 1。反应2 h后,恢复至室温,采用4 mol·L-1氢氧化钠溶液调节硫酸化多糖混合溶液的pH至7.0,离心收集上清溶液,用3倍体积的无水乙醇进行聚沉过夜,再离心收集沉淀装袋透析、冻干。氯磺酸和吡啶的反应比例见表 1。
| Sulfated polysaccharide | Rotio of chlorosulfonic acid to pyridine | Esterification reagent (V/mL) | Polysaccharide (m/mg) |
| S-BCP1-2 | 1:2 | 15 | 300 |
| S-BCP1-4 | 1:4 | 15 | 300 |
| S-BCP1-8 | 1:8 | 15 | 300 |
配制氯化钡-明胶溶液:准确称量2 g明胶溶于400 mL蒸馏水中,充分搅拌使之完全溶解,溶液完全后置入4℃冰箱保存;配制氯化钡明胶溶液:同样,准确称取4 g氯化钡溶于400 mL明胶溶液中,充分搅拌使之完全溶解,溶解完全后置入4℃冰箱保存。
硫酸基浓度标准曲线的绘制:用移液枪从0.6 g·L-1标准K2SO4溶液中称取0.02、0.06、0.10、0.14、0.18和0.20 mL溶液置于小离心管中, 离心管标号,然后向其中加入蒸馏水补至1.0 mL,按照顺序加入稀盐酸1 mL,氯化钡-明胶溶液0.5 mL,充分摇匀;在室温下静止放置20 min。采用紫外可见光光谱仪在360 nm处测定吸光度(A)值,同时做对比实验,以0.5 mL明胶溶液代替氯化钡明胶试剂,测得A1值,以硫酸基的浓度为横坐标,以(A-A1)为纵坐标绘制标准曲线。
硫酸基浓度的测定:采用电子天平准确称取5 mg S-BCP,放入反应釜,向反应釜中加入6 mL、1 mol·L-1 HCl,在烘箱中反应12 h,烘箱温度设置为105℃,使硫酸根游离。12 h后,用氮气吹干,吹干完成后加入1 mL水,制成待测样品,用移液管量取样品待测溶液0.1 mL。按照上述标准曲线的测定方法测定,按标准曲线计算样品中硫酸基团的浓度,按照以下公式转换成硫酸基团DS,并用下列公式计算硫酸基浓度。硫酸基浓度=CV/W×100%。DS=(1.62×S%)/(32-1.02×S%)。C为样品测定浓度,V为样品溶液的体积,W为称量样品质量,S%为硫的百分比。
1.4 BCP和S-BCP的结构分析红外光谱(IR)分析:分别取1~2 mg BCP和S-BCP,用溴化钾压片,在400~4000 cm-1区间内用傅里叶变换红外光谱仪扫描IR吸收。扫描电子显微镜(SEM)分析:分别采用导电胶将BCP和S-BCP样品固定在样品座上,然后用喷金仪对其表面喷金之后,直接放入电镜中进行测试。
1.5 DPPH自由基清除率的检测在96孔板中依次加入150 μL不同浓度(0.05、0.10、0.20、0.40、0.80和1.60 g·L-1)BCP溶液或S-BCP溶液(BCP组和S-BCP组)或维生素C溶液(阳性对照组),加入2×10-4 mol·L-1, 1-二苯基-2-三硝基苯肼(DPPH)无水乙醇溶液150 μL,室温反应30 min,于波长517 nm处测定A值,按照以下公式计算DPPH的清除率。清除率=[1-(A1-A2)/A0]×100%。A0为水的A值;A1为多糖溶液的A值;A2为乙醇的A值。
1.6 统计学分析采用SPSS 13.0统计软件进行统计学分析。BCP和S-BCP对DPPH自由基清除率以x±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 硫酸基浓度的标准曲线硫酸基浓度曲线线性关系良好,线性回归方程为:y = 3.025 2x,R2 = 0.997 3。见图 1。

|
| 图 1 硫酸钡浊度法测定硫酸基浓度的标准曲线 Figure 1 Standard curve of sulfate concentration detected by barium sulfate turbidity method |
|
|
以硫酸基DS为指标,可以较为直观地观察BCP的酯化情况和分析氯磺酸和吡啶的体积比对酯化反应的影响。当其体积比为1:4,反应时间为2 h,反应温度为60 ℃时,硫酸基浓度最高值为18.62%,DS最大值为2.32。见表 2。
| Sulfated polysaccharide | A value(A-A1) | Concentration of sulfate ion[ρB /(g·L-1)] | Content of sulfur(η/%) | DS |
| S-BCP1-2 | 1.424 | 0.111 | 18.576 | 2.3057 |
| S-BCP1-4 | 1.428 | 0.112 | 18.625 | 2.3206 |
| S-BCP1-8 | 0.927 | 0.073 | 12.096 | 0.9967 |
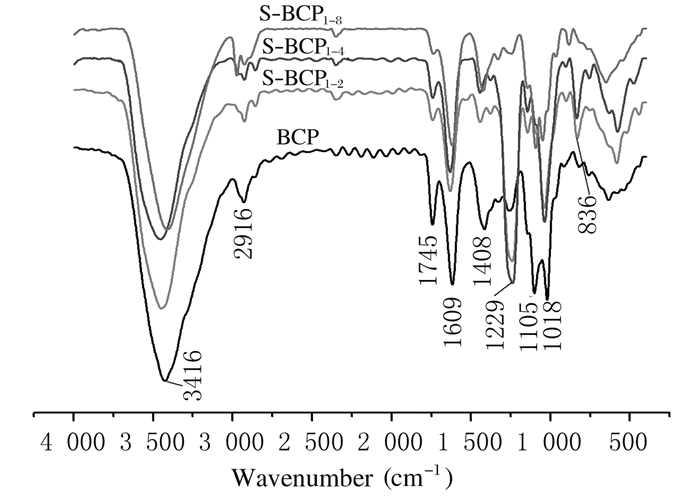
BCP的IR图显示:3 416 cm-1处为缔合O-H的伸缩振动吸收峰,也可能包含N-H伸缩振动吸收峰,2 916 cm-1处为C-H伸缩振动吸收峰,1 745 cm-1处为C=O伸缩振动吸收峰,1 609cm-1处可能为N-H变形振动吸收峰、1 105 cm-1处为C-OH中C-O的伸缩振动吸收峰,845 cm-1和890 cm-1处无吸收峰,1 100~1 010 cm-1间只有2个吸收峰,说明BCP含有呋喃糖苷键。
S-BCP1-4的IR图显示:3 416 cm-1处的吸收峰变小、1 105 cm-1处的吸收信号几乎消失,836 cm-1和1 229 cm-1处新出现了吸收峰,1 229 cm-1处是S=O的伸缩振动吸收峰,836 cm-1是C-O-S的拉伸振动吸收峰,说明BCP经硫酸化修饰后形成了硫酸酯。
对比S-BCP1-2、S-BCP1-4和S-BCP1-8的IR图显示:S-BCP1-4的IR图中在836 cm-1和1 229 cm-1处吸收峰信号最强,在3 443 cm-1吸收峰信号最弱,即氯磺酸与吡啶的比例为1:4时,BCP的硫酸化程度最高,与该条件下通过公式计算得到的DS最高的结果一致。见图 2。
|
| 图 2 BCP和S-BCP的IR图 Figure 2 IR spectrums of BCP and S-BCP |
|
|
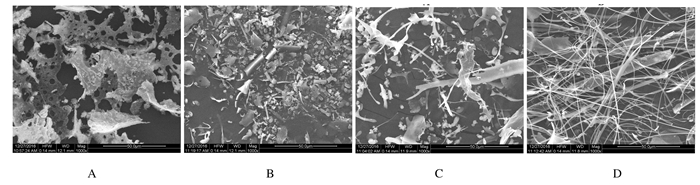
BCP表面粗糙,含有多种不同规则气孔的大片状结构;经硫酸化修饰后,BCP中的气孔几乎消失,多糖呈碎片化,表面相对平滑,而且随着所采用的酯化试剂不同,碎片之间的距离也发生了不同程度的变化。见图 3。
|
| A: BCP; B: S-BCP1-2; C: S-BCP1-4; D: S-BCP1-8. 图 3 SEM下BCP和S-BCP形态表现(Bar = 50 μm, ×1 000) Figure 3 Morphology of BCP and S-BCP under SEM (Bar = 50 μm, ×1 000) |
|
|
BCP和S-BCP均展现出对DPPH自由基清除的能力。在0.05~1.60 g·L-1时,随着浓度的增加,对DPPH自由基清除率也随之增加,呈明显量效关系。当BCP和S-BCP质量浓度≤0.2 g·L-1时,BCP和S-BCP对DPPH自由基的清除率差别不显著;当浓度大于0.2 g·L-1时,S-BCP对DPPH自由基的清除率大于BCP,并且差别逐渐增大。同时,S-BCP1-8对DPPH自由基的清除率大于S-BCP1-2和S-BCP1-4。当浓度达到1.6 g·L-1时,BCP、S-BCP1-2、S-BCP1-4和S-BCP1-8对DPPH自由基的清除率分别为66.3%、74.2%、85.5%和90.6%。见表 3。
| (x±s, η/%) | ||||||
| Group | Free radical scavenging rate | |||||
| (g·L-1)0.05 | 0.1 | 0.2 | 0.4 | 0.8 | 1.6 | |
| Control | 37.00±4.25 | 64.10±2.31 | 82.37±4.25 | 87.40±4.50 | 95.00±1.87 | 95.16±1.34 |
| BCP | 12.07±1.25 | 21.57±2.34 | 41.83±1.84 | 57.03±2.89 | 63.43±1.71 | 66.30±1.50 |
| S-BCP1-2 | 13.13±1.31 | 22.67±1.67 | 40.23±2.54 | 57.37±2.37 | 68.43±2.51 | 74.23 ± 1.95* |
| S-BCP1-4 | 15.10±1.24 | 24.00±2.70 | 43.00±2.64 | 67.43±2.79 | 78.23±2.85** | 85.50±2.55** |
| S-BCP1-8 | 19.80±0.79** | 31.23±1.32* | 49.23±2.44 | 74.27±2.74** | 89.17±0.85** | 90.60±1.21** |
| *P < 0.05,**P < 0.01 vs BCP group. | ||||||
硫酸化修饰多糖的酯化反应条件有:氯磺酸与吡啶的体积比、反应时间和反应温度。本实验在合理的反应时间和反应温度下,优化了影响酯化反应的最主要因素(磺酸与吡啶的体积比),当磺酸与吡啶的体积比分别为1:2、1:4和1:8时,制得的S-BCP的含硫百分率分别为18.57%、18.62%和12.09%,DS分别为2.30、2.32和1.00。上述结果与田庚元等[10]和张丽萍等[11]制备出的硫酸化多糖的含硫百分率和DS基本一致。本实验制备S-BCP的IR图中1 105 cm-1处的C-OH中C-O的伸缩振动吸收峰几乎消失可证明磺酸基取代了多糖羟基中的大部分的氢。S-BCP的IR图中新出现的1 229 cm-1处S=O的伸缩振动吸收峰、836 cm-1处C-O-S的拉伸振动吸收峰,说明了BCP经硫酸化修饰后形成了硫酸酯。随着氯磺酸与吡啶体积比的减小,意味着在相同体积的酯化试剂中,氯磺酸的绝对浓度一直在降低;而制得的硫酸化多糖的DS先升高再降低,这是因为当氯磺酸的绝对浓度过高时,会将部分多糖水解[12],当氯磺酸的绝对浓度比较低,磺酸基的数量又不足以取代多糖羟基中的氢时,DS又会降低。
DPPH抗氧化活性初步研究结果表明:BCP和S-BCP均具有一定的抗氧化活性,且柴胡经硫酸化修饰后抗氧化能力有所增加。这是因为BCP羟基上的氢逐渐被磺酸基取代后,使多糖分子极性增加,水溶性进一步增强,从而增强了BCP与DPPH自由基的结合能力。同时,S-BCP1-8的清除活性优于S-BCP1-2和S-BCP1-4,说明硫酸化多糖的DS与其对DPPH自由基清除能力不一定成正比。王峰等[13]研究显示:随着硫酸化海洋真菌多糖中硫酸基DS的增加,其抗氧化活性随之增强,但邓成华等[14]的研究结果显示:DS较低的硫酸化虎奶多糖的抗氧化活性优于DS高的硫酸化虎奶多糖。因此,硫酸化多糖的生物活性不仅与硫酸基DS有关,还与硫酸基的取代位置、硫酸化多糖的空间构象等有关[15-18]。BCP经硫酸化修饰后,利用SEM观察其形貌显示:与BCP表面比较,S-BCP表面更加平滑,而且呈碎片化。这种形貌有利于其与DPPH更加充分的接触,这可能也是S-BCP增强了其与DPPH自由基结合能力的原因之一。
| [1] | 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社,2015: 280. |
| [2] | 薛文峰, 刘长利, 张淑华, 等. 柴胡药材中的矿质元素与有效成分的相关性分析[J]. 中国实验方剂学杂志, 2017, 23(8): 45–49. |
| [3] | 邹胜, 徐溢, 张庆. 天然植物多糖分离纯化技术研究现状和进展[J]. 天然产物研究与开发, 2015, 27(8): 1501–1509. |
| [4] | 安乐, 赵秋云, 覃裴溪, 等. 太白蓼多糖的硫酸化修饰及其体外抑菌活性分析[J]. 西北农业学报, 2016, 25(10): 1541–1547. DOI:10.7606/j.issn.1004-1389.2016.10.018 |
| [5] | Beress A, Wassermann O, Tahhan S, et al. A new procedure for the isolation of anti-HIV compounds (polysaccharides and polyphenols) from the marine alga Fucus vesiculosus[J]. J Nat Prod, 1993, 56(4): 478–488. DOI:10.1021/np50094a005 |
| [6] | Hayashi K, Hayashi T, Kojima I. A natural sulfated polysaccharide, calcium spirulan, isolated from Spirulina platensis:in vitro and ex vivo evaluation of anti-herpes simplex virus and anti-human immunodeficiency virus activities[J]. AIDS Res Hum Retrov, 1996, 12(15): 1463–1471. DOI:10.1089/aid.1996.12.1463 |
| [7] | 焦中高, 刘杰超, 周红平, 等. 硫酸化修饰对红枣多糖自由基和亚硝基清除活性的影响[J]. 中国食品学报, 2007, 7(2): 17–22. |
| [8] | 吴国平. 浅谈柴胡的研究进展[J]. 山东畜牧兽医, 2016, 37(1): 59–61. |
| [9] | Tong H, Tian D, Li TB, et al. Inhibition of inflammatory injure by polysaccharides from Bupleurum chinense through antagonizing P-selectin[J]. Carbohydr Polym, 2014, 105(5): 20–25. |
| [10] | 田庚元, 李寿桐, 宋麦丽, 等. 牛膝多糖硫酸酯的合成及其抗病毒活性[J]. 药学学报, 1995, 30(2): 107–111. |
| [11] | 张丽萍, 汉丽萍, 王月秋, 等. 硫酸化高山红景天多糖(RSASL)的制备及鉴定[J]. 分子科学学报, 1999, 15(4): 205–209. |
| [12] | 王莉, 陈正行. 米糠多糖的硫酸酯化工艺的研究[J]. 粮食加工, 2010, 35(2): 66–69. |
| [13] | 王峰, 邵力成, 高向东. 硫酸酯化海洋真菌多糖制备及其体外抗氧化作用研究[J]. 药物生物技术, 2008, 15(1): 15–19. |
| [14] | 邓成华, 杨祥良, 王雁, 等. 取代度对硫酸酯多糖抗氧化活性的影响[J]. 华中理工大学学报, 2000, 28(5): 104–107. |
| [15] | Hochberg MC. Structure-modifying effects of chondroitin sulfate in knee osteoarthritis:an updated meta-analysis of randomized placebo-controlled trials of 2-year duration[J]. Osteoarthrit Cartilage, 2010, 18(Suppl 1): 28–31. |
| [16] | Bedke DK, Vanderwal CD. Chlorosulfolipids:structure, synthesis, and biological relevance[J]. Nat Prod Rep, 2011, 28(1): 15–25. DOI:10.1039/C0NP00044B |
| [17] | 佟双喜, 郭蔚莹. 当归多糖对糖尿病大鼠肾组织抗氧化能力及NOS、NO水平的影响[J]. 中国老年学杂志, 2015, 35(24): 7001–7002. DOI:10.3969/j.issn.1005-9202.2015.24.015 |
| [18] | 卢青毅, 刘红, 杨曦, 等. 金花茶对衰老大鼠的抗氧化和抗凋亡作用[J]. 中国老年学杂志, 2015, 35(1): 172–173. |
 2017, Vol. 43
2017, Vol. 43


