扩展功能
文章信息
- 徐丽, 张巍
- XU LI, ZHANG Wei
- 樟脑磺哑嗪对人宫颈癌HeLa细胞凋亡的诱导作用及其机制
- Induction of oxaziridine on apoptosis of human cervical cancer HeLa cells and its mechanism
- 吉林大学学报(医学版), 2017, 43(06): 1161-1164
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1161-1164
- 10.13481/j.1671-587x.20170617
-
文章历史
- 收稿日期: 2017-03-27
2. 吉林医药学院生物化学教研室, 吉林 吉林 132013
2. Department of Biochemistry, Jilin Medical University, Jilin 132013, China
哑嗪类衍生物和内源性分子的共价结合或将这些分子氧化可以引起器官损伤,如大鼠口服或注射利眠灵并暴露于紫外线下,其皮肤、肝脏和肾脏将不同程度受损,说明哑嗪类化合物具有潜在的细胞毒性[1-5]。有研究[6]显示哑嗪类化合物可抑制白血病P388细胞及黑色素瘤B16细胞增殖,但未见有关哑嗪类化合物对宫颈癌细胞影响的报道。妇科恶性肿瘤中,宫颈癌发生率仅次于乳腺癌,位居第2位,80%患者在确诊时已经发展为浸润癌[7-10]。对于宫颈癌患者,目前在治疗方式上仍以传统的治疗方法为主,副作用大,疗效差,需要引入新的治疗方法,以提高疗效或减轻患者的痛苦。樟脑磺哑嗪是哑嗪类化合物之一,本研究以樟脑磺哑嗪对人宫颈癌HeLa细胞系进行干预,观察其对HeLa细胞增殖的影响,并进一步探索其作用机制,为哑嗪类化合物的临床应用提供理论基础。
1 材料与方法 1.1 细胞、主要试剂和仪器人宫颈癌HeLa细胞系由吉林医药学院基础医学院生物化学教研室友情提供。樟脑磺哑嗪、胰蛋白酶、二甲基亚砜(DMSO)、Hochest 33258和3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)购于美国Sigma公司,10%浓度胎牛血清(FBS)和DMEM培养基购于美国Hyclone公司,兔抗人β-actin、Bcl-2、Bax单克隆抗体和抗兔二抗购于美国Santa Cruz公司。AE31倒置生物显微镜(美国麦克奥迪公司),Bio-Rad550酶标仪(美国Bio-Rad公司),Mage-ProPlus图像分析管理系统(美国Media Cybernetics公司)。
1.2 细胞培养HeLa细胞按常规方法解冻和复苏,DMEM培养基中加入胎牛血清(10%)、青霉素(100 U·mL-1)及链霉素(100 g·L-1),置于温度37℃、95%相对湿度、5% CO2环境中培养并传代。
1.3 MTT法检测HeLa细胞存活率和增殖抑制率取处于稳定对数生长期细胞,以1×105mL-1接种于96孔培养板,HeLa细胞分为对照组和不同浓度(0.5、1.0、5.0和10.0 μmol·L-1)樟脑磺哑嗪组,24 h后每孔加入20μL MTT液(5g·L-1),放入培养箱继续培养4 h,吸取上清液。每孔加入150μL DMSO,振荡使MTT完全溶解,于570 nm波长处测定吸光度(A)值。计算细胞存活率和增殖抑制率。细胞存活率=实验组A值/对照组A值×100%。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.4 倒置显微镜下观察HeLa细胞形态表现人宫颈癌HeLa细胞分为0、0.5、1.0和5.0 μmol·L-1樟脑磺哑嗪组,细胞接种于24孔板后,樟脑磺哑嗪进行处理,倒置显微镜下观察各组细胞形态表现和生长情况。
1.5 Hoechst33258法检测HeLa细胞凋亡形态表现盖玻片接种HeLa细胞,置于6孔板中培养,细胞覆盖70%~90%时,以0.5、1.0和5.0 μmol·L-1樟脑磺哑嗪处理12 h,弃上清液,采用0.5 mL固定液固定10min。吸去固定液,采用PBS洗涤3min,重复2次,加入0.5 mL Hoechst33258染色5 min。PBS清洗2次,于荧光显微镜下观察并拍照,观察HeLa细胞凋亡表现。
1.6 蛋白质印迹法检测各组HeLa细胞中Bax和Bcl-2蛋白相对表达水平按1.4方式处理细胞12 h后,离心收集细胞,加入RIPA细胞裂解液于冰浴中进行细胞裂解,离心机内14000g离心5 min,上清液收集细胞蛋白,用BCA法测蛋白质浓度,于12%聚丙烯酰胺凝胶电泳(SDS-PAGE),每孔上样10 μL,含蛋白50 μg。200 V电泳1.5 h,湿法转膜至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),200mA转膜2 h。转印后的膜用5%脱脂奶粉封闭液于37℃封闭2 h。PBST洗膜3次, 每次5 min,加入1:1000稀释的Bax和Bcl-2一抗,4℃过夜。用PBST洗膜5 min,重复3次,加入HR标记的抗兔二抗,室温下孵育2 h,用PBST洗膜5 min,重复3次,用ECL显影。以β-actin蛋白表达量作为内参,实验组与对照组表达量的比值为蛋白相对表达水平。
1.7 统计学分析采用SPSS 10.0统计软件进行统计学分析。各组HeLa细胞存活率、增殖抑制率、HeLa细胞中Bax和Bcl-2相对表达水平以x±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组HeLa细胞存活率和增殖抑制率与对照组比较,不同浓度樟脑磺哑嗪干预后HeLa细胞存活率降低(P<0.05或P<0.01),细胞增殖抑制率升高(P<0.05或P<0.01);且随着樟脑磺哑嗪浓度的增加,其变化越明显。通过标准曲线软件计算出樟脑磺哑嗪对HeLa细胞的半数抑制浓度(IC50)为2.6 μmol·L-1。见表 1。
| (n=3, x±s, η/%) | ||||||||
| Group | Dose (μmol·L-1) |
Survival rate | Inhibitory rate of proliferation | |||||
| Control | 0 | 89.0±12.4 | 0 | |||||
| Oxazirdine | ||||||||
| 0.5 | 62.0±11.2* | 30.4±3.6* | ||||||
| 1.0 | 46.0±9.4* | 48.3±4.2* | ||||||
| 5.0 | 32.0±7.8** | 64.0±4.1** | ||||||
| 10.0 | 21.0±2.1** | 76.4±3.1** | ||||||
| *P < 0.05,**P < 0.01 vs control group. | ||||||||
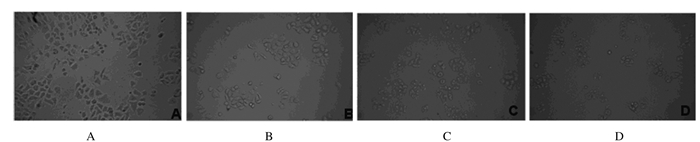
对照组(0 μmol·L-1樟脑磺哑嗪)细胞生长状态良好,0.5、1.0和5.0 μmol·L-1樟脑磺哑嗪组HeLa细胞连接消失,与周围细胞脱离明显,细胞体积缩小,生长状态变差,细胞数量逐渐减少并呈剂量依赖性。见图 1。
|
| A-D:0, 0.5, 1.0, and 5.0 μmol·L-1 oxaziridine groups. 图 1 倒置显微镜下各组HeLa细胞形态表现(×400) Figure 1 Morphology of HeLa cells in various groupsunder inverted microscope(×400) |
|
|
对照组细胞大小均一,呈弥散均匀的淡蓝色弱荧光。不同浓度樟脑磺哑嗪组HeLa细胞核明显皱缩,荧光强度明显增强,有碎裂状和凋亡小体形态等强荧光团块,且呈剂量依赖性。见图 2。

|
| A-D:0, 0.5, 1.0, and 5.0μmol·L-1 oxaziridine groups(Arrows:apoptotic cells). 图 2 各组HeLa细胞凋亡形态表现(Hoeches 33258, ×400) Figure 2 Apoptotic morphology of HeLa cells in various groups (Hoeches 33258, ×400) |
|
|
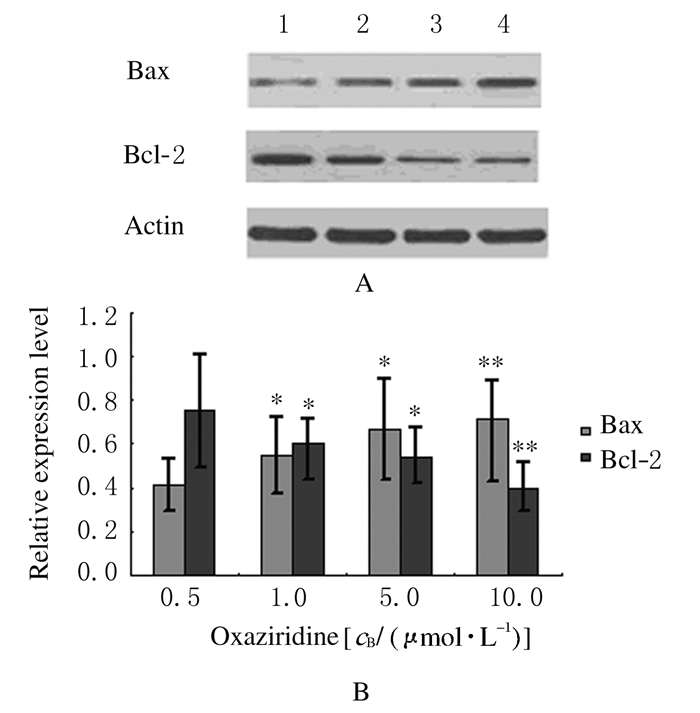
与对照组比较,0.5和1.0μmol·L-1樟脑磺哑嗪组HeLa细胞中Bcl-2蛋白相对表达水平明显降低而Bax蛋白相对表达水平明显升高(P<0.05或P<0.01),且随着樟脑磺哑嗪浓度的升高呈现一定剂量依赖性。见图 3。
|
| Lane 1-4:0, 0.5, 1.0, and 5.0 μmol·L-1 oxaziridine groups; *P < 0.05, **P < 0.01 vs control(0 μmol·L-1oxazirdine) group. 图 3 Western blotting法检测各组HeLa细胞中Bcl-2和Bax蛋白相对表达水平电泳图(A)和直条图(B) Figure 3 Electrophoregram (A) and histogram (B) of relative expression levels of Bcl-2 and Bax proteins in various groups detected by Western blotting method |
|
|
哑嗪类衍生物与内源性分子的共价结合或将这些分子氧化可以引起器官损伤,研究[6]显示:哑嗪类化合物具有抑制白血病P388细胞及黑色素瘤B16细胞增殖的作用,但未见其对宫颈癌作用的报道。本研究结果显示:樟脑磺哑嗪可抑制HeLa细胞的增殖,并导致其细胞形态发生改变,说明樟脑磺哑嗪具有抗癌细胞生长的作用。Hoechst 33258主要在活细胞中DNA聚AT序列富集区域的小沟处与DNA结合。活细胞或固定细胞均可从低浓度溶液中摄取该染料,从而使细胞核着色,本实验结果说明不同浓度樟脑磺哑嗪可导致HeLa细胞凋亡。细胞凋亡作为严格受控的能量依赖性细胞自杀程序,受多个基因的调控,其中凋亡相关蛋白在细胞凋亡中发挥着信号转导作用,并在信号通路中发挥重要作用[11]。在樟脑磺哑嗪导致的HeLa细胞凋亡中,是否有Bcl-2蛋白的参与,对探讨其作用途径是否依赖于线粒体途径以及进一步探讨其促凋亡机制具有重要意义。本课题组对樟脑磺哑嗪导致的HeLa细胞凋亡中的凋亡相关蛋白表达水平检测结果显示:樟脑磺哑嗪可使Bax蛋白表达水平升高而Bcl-2蛋白表达水平降低,说明樟脑磺哑嗪的促凋亡作用可能是通过对Bcl-2家族蛋白的调节来发挥作用。
综上所述,樟脑磺哑嗪在体外可抑制HeLa细胞的增殖,并诱导其凋亡,其凋亡的发生与Bcl-2蛋白表达水平降低及Bax蛋白表达水平升高有关,但凋亡相关基因的变化及凋亡信号的产生在诱导HeLa细胞凋亡过程中的作用尚不明确,樟脑磺哑嗪的作用机制还需进一步研究。
| [1] | Weng Q, Duoduo W, Peng G, et al. Q39, a novel synthetic quinoxaline 1, 4-di-N-oxide compound with anticancer activity in hypoxia[J]. Eur J Pharmacol, 2008, 581(3): 262–269. DOI:10.1016/j.ejphar.2007.12.006 |
| [2] | Azquetta A, Arbillaga L, Pachon G, et al. A quinoxaline 1, 4-di-N-oxide derivative induces DNA oxidative damage not attenuated by vitamin C and E treatment[J]. Chem Biol Interact, 2007, 168(2): 95–105. DOI:10.1016/j.cbi.2007.02.013 |
| [3] | Ghosh A, Mandal S, Chattaraj PK, et al. Ring expansion of donor-acceptor cyclopropane via substituent controlled selective N-transfer of (1R) -(-) -(10-camphorsulfonyl)oxaziridine:synthetic and mechanistic insights[J]. Org Lett, 2016, 18(19): 4940–4943. DOI:10.1021/acs.orglett.6b02417 |
| [4] | Aydi R, Gara AB, Chaaben R, et al. Hypolipidemic effect of dihydroisoquinoline oxaziridine in high-fat diet-fed rats[J]. Biomed Pharmacother, 2016, 82: 660–668. DOI:10.1016/j.biopha.2016.06.003 |
| [5] | Naganawa Y, Aoyama T, Nishiyama H. Cu(ii)-catalyzed enantioselective oxygen atom transfer from oxaziridine to oxindole derivatives with chiral phenanthroline[J]. Org Biomol Chem, 2015, 13(47): 11499–11506. DOI:10.1039/C5OB01840D |
| [6] | Ouédraogo M, De Maesschalck ED, Soentjens-Werts V, et al. In vitro cytotoxicity study of oxaziridines generated after chlordiazepoxide, demoxepam, and desmethylchlordiazepoxide UV irradiation[J]. Drug Chem Toxicol, 2009, 32(4): 417–423. DOI:10.1080/01480540903130666 |
| [7] | 孔赛, 韩凤娟, 张志刚. 中药抗宫颈癌HPV感染的研究进展[J]. 世界中西医结合杂志, 2014, 9(3): 319–322. |
| [8] | Pisani P, Bray F, Parkin DM. Estimates of the worldwide prevalenceof cancer for 25 sites in the adult population[J]. Int J Can cer, 2002, 97(1): 72–81. DOI:10.1002/(ISSN)1097-0215 |
| [9] | 赵峰, 刘培勋. 中药抗肿瘤及其转移机制研究进展[J]. 中国中西医结合杂志, 2007, 27(2): 178–181. |
| [10] | Tewari KS, Sill MW, Long HR, et al. Improved survival with bevacizumab in advanced cervical cancer[J]. N Engl J Med, 2014, 370(8): 734–743. DOI:10.1056/NEJMoa1309748 |
| [11] | Hengartner MO. The biochemistry of apoptosis[J]. Nature, 2000, 407(6805): 770–776. DOI:10.1038/35037710 |
 2017, Vol. 43
2017, Vol. 43


