扩展功能
文章信息
- 王玥, 刘畅, 朴仙姬, 张冬云, 孟令旗, 王浩, 王加茹, 罗英花, 孙虎男, 金成浩
- WANG Yue, LIU Chang, PIAO Xianji, ZHANG Dongyun, MENG Lingqi, WANG Hao, WANG Jiaru, LUO Yinghua, SUN Hunan, JIN Chenghao
- 四溴苯三唑对人结肠癌SW480细胞凋亡的诱导作用及其机制
- Induction effect of tetrabromobenzotriazole on apoptosis of human colon cancer SW480 cells and its mechanism
- 吉林大学学报(医学版), 2017, 43(06): 1148-1154
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1148-1154
- 10.13481/j.1671-587x.20170615
-
文章历史
- 收稿日期: 2017-02-18
2. 哈尔滨医科大学附属第五医院妇产科, 黑龙江 大庆 163319
2. Department of Gynecology and Obstetrics, Fifth Affiliated Hospital, Harbin Medical University, Daqing 163319, China
结肠癌是人类高发恶性肿瘤之一,近年来由于人们的饮食习惯和饮食结构的改变及人口老龄化速度加快,其发病率一直呈上升趋势,在我国恶性肿瘤中其发病率已上升至第4位,死亡率居恶性肿瘤的第5位[1-2]。目前,临床上常用的治疗方法是根治性肿瘤切除术,然而切除后患者的5年生存率只有50%~60% [3]。因此,寻找有效的治疗结肠癌的药物、提高患者生存率已成为研究者关注的焦点。四溴苯三唑(4, 5, 6, 7-tetrabromobenzotriazole,TBB)是苯并三唑类衍生物,对细胞的生长增殖有明显的抑制作用,其诱导细胞凋亡能力较强。研究[4-6]显示:TBB能够抑制卵巢癌细胞和甲状腺癌细胞的增殖,诱导其发生细胞凋亡,但其具体的抗肿瘤机制尚不清楚,尤其是TBB对结肠癌的作用机制尚未明确。本实验旨在探讨TBB对人结肠癌SW480细胞的增殖抑制和诱导凋亡作用及其可能的机制,为TBB的临床开发及应用提供理论依据。
1 材料与方法 1.1 细胞和主要试剂人结肠癌SW480细胞购自中国科学院细胞研究所。TBB(HPLC,≥98%)购自美国Sigma公司,胰蛋白酶和胎牛血清购自美国Gibco公司,细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,DMEM高糖液体培养基、PBS和青/链霉素购自美国HyClone公司,3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)购自美国Amresco公司,Akt、p-Akt(兔抗人多克隆抗体)、Bad、Bcl-2、pro-caspase-9、cleaved-caspase-3和β-actin(鼠抗人多克隆抗体)购自美国Santa Cruz公司,ECL化学发光试剂购自美国Thermo公司,DCFH-DA购自美国Invitrogen公司。
1.2 人结肠癌SW480细胞的培养将人结肠癌SW480细胞用含10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的DMEM高糖培养基,在5% CO2、37℃饱和湿度的培养箱中培养,待细胞长至70%~80%时进行传代。取对数生长期的细胞进行实验。
1.3 MTT法检测人结肠癌SW480细胞存活率取对数生长期的结肠癌SW480细胞,以每孔1×104个细胞的密度接种于96孔板中。置于5% CO2、37℃培养箱中孵育24 h,采用含有1% FBS的DMEM培养液血清饥饿2 h,加入DMSO溶解的(1、3、10、30和100 μmol·L-1)TBB,设不加TBB为对照组,即分别为6组处理浓度,各组均设8个复孔,并确保在培养体系中DMSO终浓度小于0.5%,继续孵育24 h。每孔加入15 μL MTT(5 g·L-1),继续培养2~4 h。将培养液吸去,PBS洗涤1次,每孔加入100 μL DMSO,在摇床上混匀15 min。在酶联免疫检测仪测量570 nm处各孔吸光度(A)值,其中对照组每孔加入1 μL DMSO,空白调零孔加入100 μL DMSO。细胞存活率=(实验组A值-空白调零组A值)/(对照组A值-空白调零组A值)×100%。
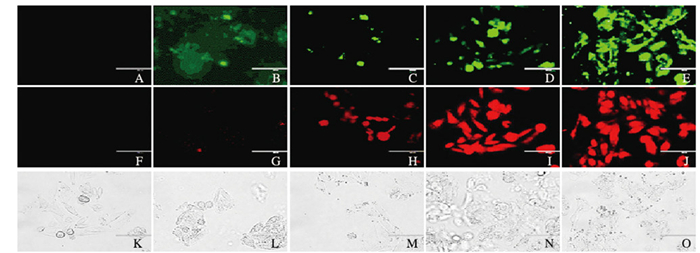
1.4 Annexin Ⅴ-FITC/PI双染法检测人结肠癌SW480细胞凋亡率取对数生长期的结肠癌SW480细胞,以每孔1×105个细胞的密度接种于6孔板中。培养24 h,采用30 μmol·L-1TBB分别处理细胞3、6、12和24 h后,弃去上清液,1 mL PBS洗涤1次,每孔依次加入195 μLAnnexin Ⅴ-FITC结合液、3 μL Annexin Ⅴ-FITC和2 μL PI,使结合液与染色液充分混匀后,避光孵育5~10 min,采用荧光显微镜成像,明场条件下观察细胞形态,暗场条件下观察细胞荧光强度,绿色荧光为Annexin Ⅴ-FITC阳性、发生凋亡的细胞,红色荧光为PI阳性、发生晚期凋亡及坏死的细胞。通过细胞计数法计算细胞凋亡率。细胞凋亡率=已染细胞数/总细胞数×100%。
1.5 流式细胞术检测人结肠癌SW480细胞凋亡率取处于对数生长期结肠癌SW480细胞,以每孔1×105个细胞的密度接种于6孔板中。培养24 h,采用30 μmol·L-1TBB分别处理细胞3、6、12和24 h,收集细胞,每管加入195 μL Annexin Ⅴ结合液、3 μL Annexin Ⅴ-FITC和2 μL PI,混匀后室温避光孵育15 min,加入300 μL PBS转移至流式管中,经流式细胞仪分析,每个样本计数1×105个细胞,采用CyExpert 1.2软件进行数据分析。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。
1.6 流式细胞术检测人结肠癌SW480细胞中活性氧(reactive oxygen species,ROS)水平取处于对数生长期结肠癌SW480细胞,以每孔1×105个细胞密度接种于6孔板中。培养24 h,采用30 μmol·L-1 TBB分别处理细胞3、6、12和24 h,收集细胞,PBS清洗1次,加入终浓度为10 μmol·L-1DCHF-DA。37℃孵育30 min,PBS清洗2次。500 μL PBS重悬细胞,经流式细胞仪行分析,每个样本计数1×104个细胞,采用CyExpert 1.2软件进行数据分析。细胞中ROS增加倍数=实验组ROS生成量/对照组ROS生成量。
1.7 Western blotting法检测人结肠癌SW480细胞中凋亡相关蛋白p-Akt、Akt、Bcl-2、Bad、pro-caspase-9和cleaved-caspase-3表达水平分别收集30 μmol·L-1TBB处理3、6、12和24 h的人结肠癌SW480细胞,考马斯亮蓝法定量后,取30 μg蛋白样品,加入5×buffer上样至12%聚丙烯酰胺凝胶进行电泳,半干转至硝酸纤维膜。5%脱脂奶粉室温封闭1 h,加入相应一抗4℃摇床孵育过夜。TBST洗涤5次,每次5 min,加入HRP标记山羊抗兔IgG及山羊抗鼠IgG的二抗(稀释比例为1:2 000)室温孵育2 h。TBST洗涤5次,每次5 min。使用ECL化学发光试剂显色,采用化学发光型凝胶成像系统成像,目的条带用ImageJ软件分析相对灰度值(以β-actin为内参)。蛋白相对表达水平=实验组灰度值/对照组灰度值。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组人结肠癌SW480细胞存活率、细胞凋亡率、细胞中ROS水平和凋亡相关蛋白p-Akt、Akt、Bad、Bcl-2、pro-caspase-9、cleaved-caspase-3表达水平以x±s表示,组内两两比较采用Dunnett-t检验,多组间均数比较采用单因素方差分析(LSD法)。以α=0.05为检验水准。
2 结果 2.1 各组人结肠癌SW480细胞存活率经1、3、10、30和100 μmol·L-1 TBB处理SW480细胞24 h后,随着TBB浓度的增加,SW480细胞存活率明显降低,经1、3、10、30和100 μmol·L-1 TBB处理的SW480细胞存活率分别为(91.60±1.21)%、(78.61±1.20)%、(68.36±3.88)%、(34.72±1.75)%和(14.97±3.37)%,均低于对照组(100%±1.47%)(P<0.05)。TBB的半数抑制浓度(IC50)值为21.03 μmol·L-1。
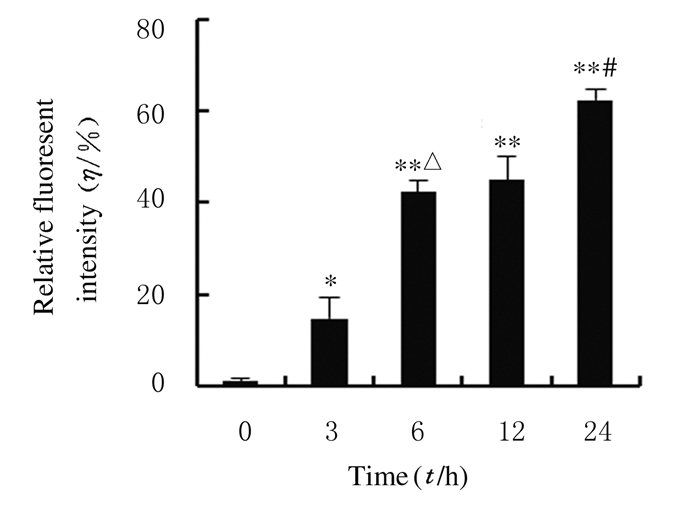
2.2 Annexin Ⅴ-FITC/PI双染法检测人结肠癌SW480细胞凋亡率经30 μmol·L-1TBB处理SW480细胞3、6、12和24 h,利用Annexin Ⅴ-FITC/PI双染法检测细胞凋亡率。在明场条件下,对照组(0 h)SW480细胞均贴壁良好,呈扁平多角形,可见紧密连接。处理24 h时,细胞形态发生明显改变,细胞皱缩变圆,细胞悬浮,脱落等。暗场条件下,随着TBB处理时间的延长,Annexin Ⅴ-FITC(绿色)荧光强度逐渐增强,细胞凋亡程度明显增加,见图 1(插页五)。处理3、6、12和24 h时细胞凋亡率(14.6±4.50)%、(42.3±2.51)%、(45.0±5.00)%和(62.3±2.51)%均高于对照组(0 h, 1.33%±0.57%)(P<0.05)。见图 2。
|
| 图 1 Anncxin V-FITC/PI双染法检测SW480细胞凋亡荧光强度(×200) Figure 1 Apoptotic fluorescence irucnsity of SW480 cells detected by Anncxin V-FITC/N double staining (× 200) |
|
|
|
| *P < 0.05, **P < 0.01 compared with control group (0 h); △P < 0.05 compared with 3 h group; #P < 0.05 compared with 12 h group. 图 2 Annexin Ⅴ-FITC/PI双染法检测各组SW480细胞凋亡率 Figure 2 Apoptotic rates of SW480 cells in various groups detected by Annexin Ⅴ-FITC/PI double staining |
|
|
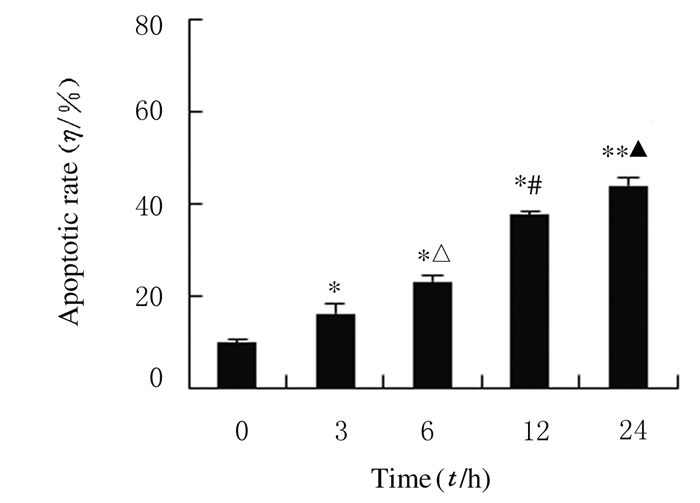
经30 μmol·L-1TBB处理SW480细胞3、6、12和24 h后,随着TBB处理时间的增加,细胞凋亡率明显增加,并呈时间依赖性,处理3、6、12和24 h SW480细胞凋亡率分别为(16.09±2.03)%、(23.00±1.39)%、(37.69±0.75)%和(44.00±1.89)%,均高于对照组(0 h,9.69%±0.88%)(P<0.05)。见图 3和4。

|
| A-E: 0, 3, 6, 12, and 24 h groups, respectively. 图 3 流式细胞术检测各组SW480细胞凋亡 Figure 3 Apoptosis of SW480 cells in various groups detected by flow cytometry |
|
|
|
| *P < 0.05, **P < 0.01 compared with control group (0 h); △P < 0.05 compared with 3 h group; #P < 0.05 compared with 6 h group; ▲P < 0.05 compared with 12 h group. 图 4 流式细胞术检测各组SW480细胞凋亡率 Figure 4 Apoptotic rates of SW480 cells in various groups detected by flow cytometry |
|
|
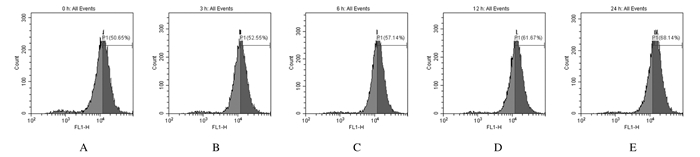
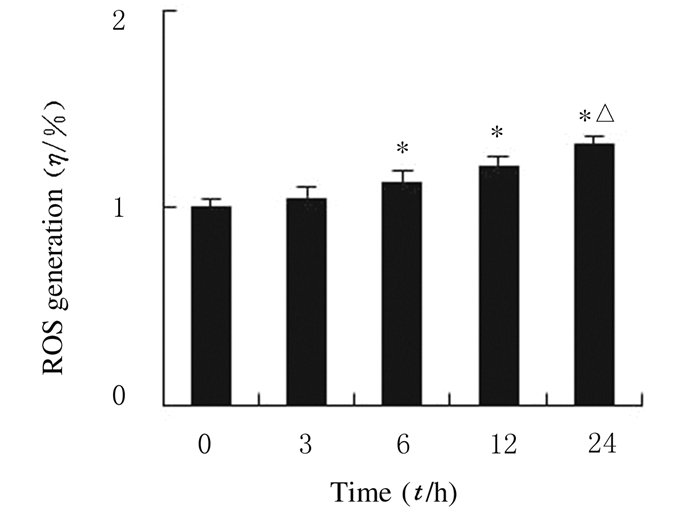
随着TBB处理时间的增加,细胞荧光峰图逐渐右移。与对照组(0 h)比较,其他各组SW480细胞中ROS水平均升高(P<0.05)。细胞中相对荧光强度变化情况显示:TBB呈时间依赖性诱导细胞中ROS的产生。见图 5和6。
|
| A-E: 0, 3, 6, 12, and 24 h groups, respectively. 图 5 流式细胞术检测各组SW480细胞中ROS水平 Figure 5 Intracellular ROS levels in SW480 cellsin various groups detected by flow cytometry |
|
|
|
| *P < 0.05, **P < 0.01 compared with control group (0 h); △P < 0.05 compared with 12 h group. 图 6 流式细胞术检测各组SW480细胞中ROS水平 Figure 6 ROS levels in SW480 cells in various groups detected by flow cytometry |
|
|
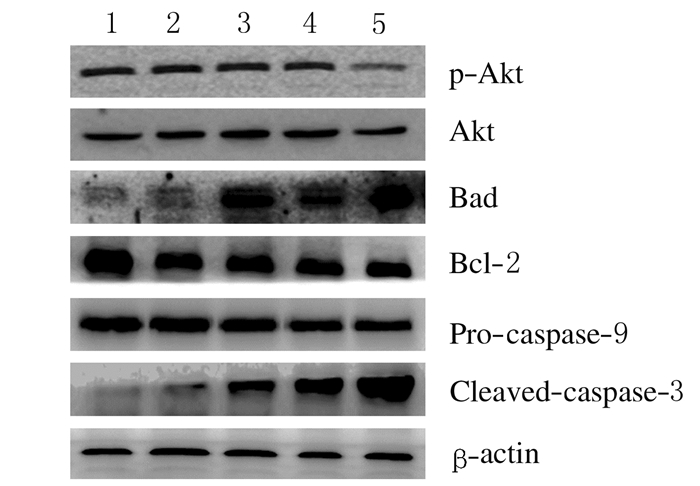
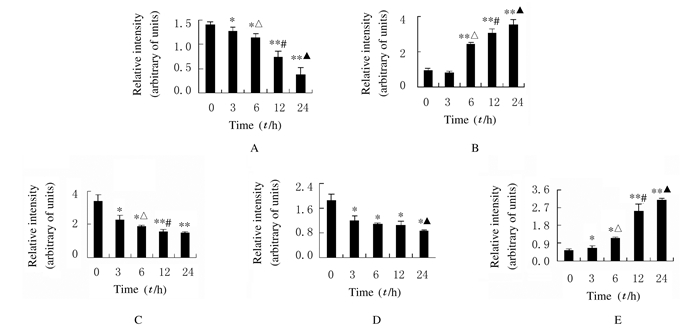
经30 μmol·L-1TBB处理SW480细胞3、6、12和24 h后,随着TBB处理时间的增加,促进细胞凋亡的cleaved-caspase-3与Bad蛋白表达水平逐渐升高,pro-caspase-9蛋白表达水平逐渐降低,而抑制细胞凋亡的磷酸化Akt与Bcl-2蛋白表达水平逐渐降低,与对照组(0 h)比较差异具有统计学意义(P<0.05)。见图 7和8。
|
| Lane 1-5: 0, 3, 6, 12 and 24 h groups, respectively. 图 7 Western blotting法检测SW480细胞中凋亡相关蛋白的表达量电泳图 Figure 7 Electrophoregram of expression levels of apoptosis related proteins in SW480 cells detected by Western blotting method |
|
|
|
| *P < 0.05, **P < 0.01 compared with control group(0 h); △P < 0.05 compared with 3 h group; #P < 0.05 compared with 6 h group; ▲P < 0.05 compared with 12 h group. A: P-Akt; B: Bcl-2; C: Bad; D: Pro-caspase-9; E: Cleaved-caspase-3. 图 8 Western blotting法检测各组SW480细胞中凋亡相关蛋白的表达水平 Figure 8 Expression levels of apoptosis related proteins in SW480 cells in various groups detected by Western blotting method |
|
|
肿瘤的发生与细胞的无限增殖、机体内凋亡信号的控制密切相关。当凋亡信号蛋白与细胞因子严格执行调控时,可抑制肿瘤细胞的增殖。因此,寻找能够诱导肿瘤细胞凋亡的药物成为研究的热点之一。本研究通过生物化学、分子生物学和细胞生物学等方法,对TBB诱导结肠癌细胞的凋亡作用及其分子机制进行了探讨。倒置显微镜下观察TBB处理后的细胞形态表现:随着处理时间的不断增加,细胞形态发生明显变化,尤其在处理24 h时,细胞发生明显皱缩,类似于细胞凋亡的形态。MTT结果表明:TBB呈浓度依赖性地抑制人结肠癌SW480细胞的增殖与存活,与细胞形态结果相吻合。Annexin Ⅴ-FITC/PI双染后,在荧光显微镜下观察到随着TBB处理细胞时间的增加,细胞中绿色荧光强度也逐渐增强。流式细胞术检测TBB对SW480细胞的诱导凋亡结果显示:随着TBB处理时间的延长,细胞的凋亡数逐渐增加,这与倒置显微镜下观察到的细胞凋亡现象基本一致,说明TBB能够抑制人结肠癌SW480细胞的增殖,诱导其发生凋亡。
细胞中的氧化-还原平衡对细胞的生长、增殖和凋亡至关重要,然而维持细胞中氧化-还原平衡的主要因素是ROS。ROS是真核细胞有氧呼吸过程中形成的。ROS包括过氧化氢(H2O2)、超氧阴离子(O2-)、羟自由基(OH)和一氧化氮(NO)等[7-8]。研究[9-11]表明:活性氧与细胞凋亡密切相关,在多种抗肿瘤药物诱导细胞凋亡过程中起介导和调节作用,如ROS能够诱导前列腺癌PC-3细胞和肺癌A549细胞凋亡;同时,ROS可以激活caspase-9和caspase-3进而引发caspase家族级联反应,使DNA断裂,引起细胞凋亡。本研究采用流式细胞术检测TBB处理后SW480细胞中ROS水平显示:随着TBB处理时间的延长,细胞中ROS水平明显升高,说明TBB诱导SW480细胞凋亡的机制可能与上调ROS水平有关。
Akt(PKB)为丝氨酸与苏氨酸蛋白激酶,亦称为B类蛋白激酶。主要通过磷酸活化一些细胞因子(白细胞介素家族,mTOR等)间接对细胞的生长、繁殖及凋亡起重要的调节作用[12-14]。PI3K/Akt通路是肿瘤常见的激活通路,与乳腺癌[15]、肝癌[16]和肺癌[17]等恶性肿瘤的发生发展密切相关。研究[18]显示:通过LPS刺激结肠癌细胞,PI3K/Akt信号通路被激活并促进结肠癌细胞的转移和浸润,说明PI3K与Akt组成的信号通路能抑制细胞凋亡,促进肿瘤生长;Akt可以抑制Bax的构象变化,磷酸化Bad和caspase-9[19];通过在细胞核中下调肿瘤抑制蛋白P53表达等从而抑制细胞发生凋亡[20-21]。本研究采用蛋白质免疫印记法检测细胞凋亡相关蛋白表达水平变化的结果显示:TBB处理细胞后,促进凋亡蛋白caspase-3与Bad表达水平逐渐升高、pro-caspase-9表达水平逐渐降低,而抑制凋亡的p-Akt和Bcl-2的蛋白表达水平逐渐降低,与以往研究结果完全相符,说明TBB能够通过调控凋亡相关因子的表达诱导SW480细胞凋亡。
综上所述,TBB可以降低人结肠癌SW480细胞存活率,提高凋亡率,抑制Akt的活性,这与细胞中ROS水平升高引起的氧化损伤有关。更多TBB促进生成的ROS与细胞凋亡相关的调控分子机制有待进一步研究。本研究结果为TBB的应用与结肠癌临床治疗提供了新思路。
| [1] | 崔戈, 张婷, 崔杰. 结肠癌相关转录因子1表达在结直肠癌早期筛查及预后评估中的作用[J]. 南京医科大学学报:自然科学版, 2015, 35(7): 1008–1012. |
| [2] | 殷亮, 陈明清. 结直肠癌诊疗进展[J]. 昆明医科大学学报, 2012, 33(12): 166–170. DOI:10.3969/j.issn.1003-4706.2012.12.049 |
| [3] | 崔艳成, 高志冬, 禚洪庆, 等. 结肠癌术后局部复发的现状和进展[J]. 中华普外科手术学杂志:电子版, 2012, 6(2): 225–228. |
| [4] | 闫威, 任丽莉, 孟智超, 等. 蛋白激酶CK2抑制剂四溴苯三唑可促进卵巢癌CAOV3细胞凋亡[J]. 第三军医大学学报, 2015, 37(14): 1478–1481. |
| [5] | 刘超, 刘洋, 赵颂, 等. 蛋白激酶CK2抑制剂TBB对甲状腺鳞癌细胞株SW579 CK2β和Akt表达的影响[J]. 吉林大学学报:医学版, 2012, 38(2): 276–280. |
| [6] | 王翠瑶, 刘超, 任丽莉, 等. TBB通过WNT/β-catenin通路抑制甲状腺滤泡状癌细胞FTC133的增殖与迁移[J]. 基础医学与临床, 2014, 34(10): 1381–1385. DOI:10.3969/j.issn.1001-6325.2014.10.015 |
| [7] | 潘寅兵, 王娴, 马绍磊, 等. 活性氧介导大剂量氯胺酮致原代培养皮层神经元凋亡[J]. 南京医科大学学报:自然科学版, 2010(11): 1560–1563. |
| [8] | 李恒元, 孙凌凌, 李冰皓, 等. 雷公藤红素通过ROS/JNK通路诱导骨肉瘤细胞周期阻滞、凋亡和自噬的研究[J]. 中华骨科杂志, 2016, 36(8): 490–502. |
| [9] | 许宁, 欧仁杰, 王晓庆, 等. 盐霉素抗癌细胞及癌干细胞作用的研究进展[J]. 吉林大学学报:医学版, 2015, 41(3): 666–670. |
| [10] | 郗艳丽, 许娜, 李澍, 等. 没食子酸对人非小细胞肺癌A549细胞增殖的抑制作用[J]. 吉林大学学报:医学版, 2016, 42(6): 1092–1098. |
| [11] | Redza-Dutordoir M, Averill-Bates DA. Activation of apoptosis signalling pathways by reactive oxygen species[J]. Biochim Biophys Acta, 2016, 1863(12): 2977–2992. DOI:10.1016/j.bbamcr.2016.09.012 |
| [12] | 史毅, 金晓红, 吴伟忠, 等. 补骨脂乙素对舌鳞状细胞癌Tca8113细胞增殖的抑制作用和凋亡诱导作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(4): 725–730. |
| [13] | 肖亮, 殷小成. PI3K/Akt/mTOR信号通路在肿瘤中的研究进展[J]. 现代医药卫生, 2016, 32(12): 1858–1861. |
| [14] | 李俐, 田智丹, 黄文斌, 等. IL-13对人结肠癌LS174T细胞增殖和侵袭能力的影响[J]. 南京医科大学学报:自然科学版, 2011, 31(12): 1823–1825. |
| [15] | Yang SX, Polley E, Lipkowitz S. New insights on PI3K/AKT pathway alterations and clinical outcomes in breast cancer[J]. Cancer Treat Rev, 2016, 45: 87–96. DOI:10.1016/j.ctrv.2016.03.004 |
| [16] | Zhang X, Wang Y, Wang J, et al. Protein-protein interactions among signaling pathways may become new therapeutic targets in liver cancer[J]. Oncol Rep, 2016, 35(2): 625–638. DOI:10.3892/or.2015.4464 |
| [17] | Pérez-Ramírez C, Cañadas-Garre M, Molina MA, et al. PTEN and PI3K/AKT in non-small-cell lung cancer[J]. Pharmacogenomics, 2015, 16(16): 1843–1862. DOI:10.2217/pgs.15.122 |
| [18] | O' Leary DP, Bhatt L, Woolley JF, et al. TLR-4 signalling accelerates colon cancer cell adhesion via NF-κB mediated transcriptional up-regulation of Nox-1[J]. PLoS One, 2012, 7(10): e44176. DOI:10.1371/journal.pone.0044176 |
| [19] | 刘畅, 罗英花, 蒋雪园, 等. 大黄素对人肝癌Huh7细胞的凋亡作用及机制研究[J]. 药物评价研究, 2016, 39(3): 367–371. |
| [20] | 黄重发, 付启梅, 周怿, 等. miRNA-33a抑制人结肠癌细胞HCT-116增殖的机制研究[J]. 解放军医学杂志, 2016, 41(9): 725–729. |
| [21] | 冯凯, 路浩军, 贾海英, 等. RASSF1AA1a33Ser单核苷酸多态性与中国北方汉族结直肠癌的关联研究[J]. 解放军医学杂志, 2015, 40(3): 221–225. DOI:10.11855/j.issn.0577-7402.2015.03.10 |
 2017, Vol. 43
2017, Vol. 43


