扩展功能
文章信息
- 刘瑶, 赵晓云, 赵雅宁, 李建民, 李佳宁
- LIU Yao, ZHAO Xiaoyun, ZHAO Yaning, LI Jianmin, LI Jianing
- 脑缺血后处理对大鼠大脑海马区Notch1、Cyclin D1和CDK4蛋白表达的影响
- Effects of cerebral ischemic postconditioning on expressions of Notch1, Cyclin D1 and CDK4 proteins in hippocampus of rats
- 吉林大学学报(医学版), 2017, 43(06): 1142-1147
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1142-1147
- 10.13481/j.1671-587x.20170614
-
文章历史
- 收稿日期: 2016-11-20
2. 华北理工大学附属医院神经外科, 河北 唐山 063000;
3. 河北省唐山市人民医院急诊科, 河北 唐山 063000
2. Department of Neurosurgery, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Emergency, Tangshan People's Hospital, Hebei Province, Tangshan 063000, China
脑缺血后处理(cerebral ischemic postconditioning, CIP)是指脑组织长时间缺血后在再灌注之前短时间内,对已缺血的组织器官给予多次缺血/再通的循环处理,能明显减轻缺血组织和器官的缺血再灌注损伤。Zhao等[1]在犬心肌缺血再灌注研究中首先发现CIP可以减轻再灌注损伤。研究[2]显示:作为一种有效的内源性保护机制,CIP能够减轻脑梗死灶体积,改善神经功能损伤。但CIP保护作用的确切机制尚未清楚。Notch信号是一个在进化过程中高度保守的信号通路,其是介导细胞和细胞之间直接接触的主要信号通路之一,Notch信号可表达于多种组织和器官中,调控了多细胞机体的细胞凋亡、增殖和分化。研究[3]显示:大脑局灶性缺血能激活Notch信号,且能启动对受伤神经元的修复。在全脑缺血损伤中,缺血周围区域有许多细胞周期相关蛋白的表达,这些相关蛋白与细胞凋亡关系密切。细胞周期相关蛋白在脑缺血损伤中的神经再生作用机制也越来越受到关注。Cyclin D1和CDK4是在细胞周期素家族中与细胞增殖周期关系非常密切的成员,二者是决定细胞周期能不能开始进行的启动因子,Cyclin D1与CDK4结合,可促进细胞进入周期,促进细胞增殖[4]。研究[5]显示:Notch信号可以通过调控细胞周期发挥作用,但关于CIP是否可以通过Notch信号通路调控Cyclin D1和CDK4的表达的报道较少。本研究建立大鼠全脑缺血损伤模型,应用CIP及Notch1抑制剂进行干预,观察其对大鼠海马区Cyclin D1和CDK4的表达以及大鼠神经功能的影响,从Notch信号通路角度探讨CIP对Cyclin D1和CDK4表达的影响。
1 材料与方法 1.1 实验动物128只清洁级健康雄性的SD大鼠,体质量300~350 g,购自北京的维通利华实验动物中心,并于华北理工大学医学实验中心饲养。于模型制备前让大鼠适应环境7d,自由进食,不限饮水,温度22℃~26℃,湿度40%~70%,空气压力梯度为20 P。
1.2 主要试剂和仪器Notch1兔抗鼠多克隆抗体为美国Abcam公司产品,Cyclin D1兔抗鼠多克隆抗体、CDK4兔抗鼠多克隆抗体和二抗(山羊抗兔)为武汉博士德生物工程有限公司,γ-分泌酶抑制剂DAPT为美国SELLECK生物科技有限公司产品,二甲基亚枫(DMSO)为美国Sigma公司产品。生物光学显微镜为日本株式会社尼康公司产品,伯乐电泳转印系统和凝胶成像系统为美国Bio-Rad公司产品。
1.3 实验动物分组和处理将128只大鼠采用随机数字法分为假手术组、缺血再灌注模型(ischemic reperfusion, I/R)组、CIP组和DAPT组,每组32只。参照四血管闭塞法(4-VO)[6]制作全脑缺血再灌注模型。10%水合氯醛常规麻醉,颈正中切口,分离双侧颈总动脉,分别置线标记备用。将大鼠枕后部正中切开,暴露双侧第一颈椎横突翼孔后,热凝其下通过的椎动脉,电凝每次时间为2~4 s,使翼小孔后双侧椎动脉永久闭塞。常规消毒缝合伤口,单独放入笼中,造模后24 h,在大鼠清醒状态下夹闭两侧颈动脉20 min,实行再灌注,完成缝合。CIP组大鼠松开动脉夹之前的过程同I/R组,实现永久再灌注前,进行松开动脉夹15 s、再夹闭15 s,进行3次缺血/再灌注循环,即为实现CIP。假手术组只分离暴露血管,不电凝椎动脉、不夹闭颈总动脉。DAPT组(DAPT是一种γ-分泌酶抑制剂,为Notch1通路的抑制剂)大鼠在进行CIP之前3 h,先给对应组的大鼠腹腔注射DAPT(10 mg·kg-1·d-1),然后按照I/R组的操作方法进行手术。
1.4 HE染色规定时间内以0.4%戊巴比妥纳麻醉大鼠后,开胸、暴露心脏,4%多聚甲醛行心脏灌流,断头取脑,4℃冰箱放置至少24h。在视交叉后1~6 mm处冠状面切开,取中间块入用4%多聚甲醛固定液固定,石蜡包埋,连续冠状切片,每只大鼠取5张海马区切片,片厚4μm。切片常规脱蜡至水,HE染色。在光学显微镜(400倍)下观察海马神经元形态表现,计算神经元存活率。各组各时间点选取4只大鼠,每只大鼠取5张海马区切片,每张切片选取5个不重复的视野,采用Motic-6.0图像采集以及分析系统计算每个视野的存活神经元数。神经元存活率=存活的神经元数/神经元总数×100%。
1.5 免疫组织化学染色分析大鼠海马区CyclinD1、CDK4和Notch1阳性细胞数将各组大鼠麻醉后处死,开胸、暴露心脏, 4%多聚甲醛行心脏灌流, 断头取脑,在视交叉后1和6 mm处冠状面切开,取中间块置入4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5μm)。切片常规脱蜡至水,滴加一抗(CyclinD1:1:200;CDK4:1:200;Notch1:1:150),4℃孵育过夜,TBST洗膜,滴加二抗,37℃恒温箱内孵育1 h;DAB显色,脱水、透明、封片。每个标本取5张切片, 每张切片在海马区随机选取3~5个视野,观察CyclinD1、CDK4和Notch1阳性细胞数。
1.6 Western blotting法检测大鼠海马区CyclinD1、CDK4和Notch1蛋白表达水平大鼠在规定时间点处死后,迅速取双侧海马区组织,用4℃PBS充分洗涤,加入单去污剂裂解液(含PMSF)提取蛋白,4℃离心15 min,12 000 r·min-1,取上清。BCA法测定各样本的蛋白浓度, 将0.8 mL蛋白标准配制液和BSA蛋白标准混合配制成浓度为25 g·L-1蛋白标准液。采用电脑绘制出来的标准曲线计算待测蛋白浓度。使用100 g·L-1十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液中封闭1 h,加入Cyclin D1(1:500)、CDK4(1:500)、Notch1(1:400)与β-actin(1:1 000)的一抗,4℃孵育过夜,TBST洗膜,标记二抗,37℃孵育1 h(1:800),TBST洗膜,ECL显色,采用数码成像分析系统软件分析各因子的平均灰度值。各因子的灰度值=目的因子灰度值/内参的平均灰度值。
1.7 统计学分析采用SPSS19.0统计软件进行统计学分析。各组大鼠海马区神经元存活率、海马区CyclinD1、CDK4和Notch1阳性细胞数及蛋白水平以x ±s表示,组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
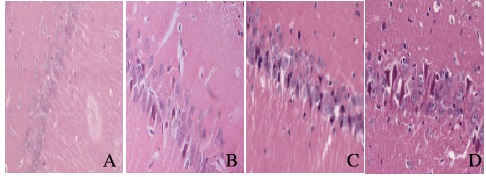
2 结果 2.1 各组大鼠海马区神经元形态表现和存活率假手术组大鼠海马区神经元排列紧密,神经元胞体较大,胞核大而圆,核仁清晰,胞浆淡染;与假手术组比较,I/R组大鼠海马区神经元表现为细胞正常结构消失,细胞核固缩、碎裂,各时间点神经元存活率明显降低;与I/R比较,CIP组神经元形态损伤程度和细胞核变性的情况减轻,大鼠海马区神经元存活率升高(P < 0.05);与CIP组比较,DAPT组大鼠海马区神经元形态不完整,相应时间点大鼠海马区神经元存活率降低(P < 0.05)。见表 1和图 1(插页四)。
| (n=16, x ±s, η/%) | |||||
| Group | Survival rate of neurons | ||||
| (t/h) | 6 | 24 | 48 | 72 | |
| Shamoperation | 98.41±1.00 | 98.10±1.22 | 97.60±1.48 | 97.59±1.47 | |
| I/R | 76.25±1.13* | 69.14±1.63* | 61.99±1.61* | 54.19±1.75 | |
| CIP | 87.06±0.91*△ | 79.63±1.53*△ | 70.10±1.68*△ | 63.98±1.36*△ | |
| DAPT | 81.08±1.66*△# | 74.09±1.61*# | 65.05±1.59*# | 58.21±1.20*# | |
| *P < 0.05 vs sham operation group;△P < 0.05 vs I/R group;#P < 0.05 vs CIP group. | |||||
|
| A:Sham group; B:I/R group; C:CIP group; D:DAPT group. 图 1 各组大鼠海马区神经元形态表现(HE,×400) Figure 1 Morphology of neurons in hippocampus of rats in various groups (HE, ×400) |
|
|
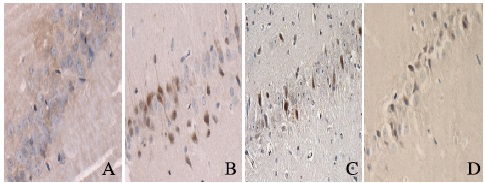
免疫组织化学结果显示:Cyclin D1、CDK4和Notch1阳性产物表达在细胞核中,呈棕黄色染色,假手术组偶见阳性细胞;与假手术组比较,I/R组大鼠各时间点Cyclin D1、CDK4和Notch1阳性细胞数增加(P < 0.05);与I/R组比较,CIP组大鼠相应时间点Cyclin D1和CDK4阳性细胞数降低(P < 0.05),Notch1阳性细胞数进一步增加(P < 0.05);与CIP组比较,DAPT组相应时间点Cyclin D1和CDK4阳性细胞数增加(P < 0.05),Notch1阳性细胞数减少(P < 0.05)。见表 2和图 2~4(插页四)。
| (n=16, x ±s) | |||||||||||||||
| Group | Number of CyclinD1 positive cells | Number of CDK4 positive cells | Number of Notch1 positive cells | ||||||||||||
| (t/h) | 6 | 24 | 48 | 72 | (t/h) | 6 | 24 | 48 | 72 | (t/h) | 6 | 24 | 48 | 72 | |
| Sham operation | 3.24±1.28 | 3.17±0.99 | 3.31±1.24 | 3.30±1.18 | 3.30±0.73 | 3.25±1.41 | 3.40±1.76 | 3.45±1.57 | 2.45±1.05 | 2.48±1.10 | 2.59±0.86 | 2.47±0.88 | |||
| I/R | 11.06±0.70* | 15.55±0.86* | 22.23±1.07* | 29.66±1.19* | 10.10±1.55* | 16.45±1.26* | 23.60±1.31* | 29.60±2.08* | 4.42±0.60* | 6.48±0.93* | 10.81±1.04* | 8.76±1.01* | |||
| CIP | 7.03±1.21*△ | 11.15±1.07*△ | 17.35±0.93*△ | 25.09±0.88*△ | 5.80±1.42*△ | 11.40±1.35*△ | 19.25±1.03*△ | 25.45±1.25*△ | 8.63±0.94*△ | 11.26±1.13*△ | 15.89±1.11*△ | 13.42±1.08*△ | |||
| DAPT | 9.12±1.57*# | 14.15±1.49*# | 20.99±1.61*# | 27.63±1.00*# | 8.76±1.39*# | 14.88±1.79*# | 21.97±1.55*# | 28.49±1.57*# | 6.30±0.91*# | 8.72±0.90*# | 12.70±1.04*# | 9.86±1.05*# | |||
| *P < 0.05 vs sham operation group;△P < 0.05 vs I/R group;#P < 0.05 vs CIP group. | |||||||||||||||

|
| A:Sham group; B:I/R group; C:CIP group; D:DAPT group. 图 2 造模后24 h各组大鼠海马区Cyclin D1阳性细胞的表达(免疫组织化学,×400) Figure 2 Expressions of Cyclin D1 positive cells in hippocampus region of rats in various groups 24 h after modeling (Immunohistochemistry, ×400) |
|
|
|
| A:Sham group; B:I/R group; C:CIP group; D:DAPT group. 图 3 造模后24 h各组大鼠海马区CD4阳性细胞的表达(免疫组织化学,×400) Figure 3 Expressions of CD4 positive cells in hippocampus region of rats in various groups 24 h after modeling (Immunohistochemistry, ×400) |
|
|

|
| A:Sham group; B:I/R group; C:CIP group; D:DAPT group. 图 4 造模后24 h各组大鼠海马区Notch1阳性细胞的表达(免疫组织化学,×400) Figure 4 Expressions of Notch1 positive cells in hippocampus region of rats in various groups 24 h after modeling (Immunohistochemistry, ×400) |
|
|
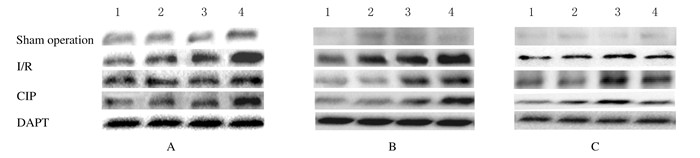
假手术组大鼠海马区Cyclin D1和CDK4蛋白表达水平较低;与假手术组比较,I/R组大鼠海马区各时间点Cyclin D1、CDK4和Notch1蛋白表达水平升高(P < 0.05);与I/R组比较,CIP组大鼠海马区相应时间点Cyclin D1和CDK4蛋白表达水平降低(P < 0.05),Notch1蛋白表达水平进一步升高(P < 0.05);与CIP组比较,DAPT组大鼠海马区相应时间点Cyclin D1和CDK4蛋白表达水平升高(P < 0.05),Notch1蛋白表达水平降低(P < 0.05)。见表 3和图 5。
| (n=16, x ±s) | |||||||||||||||
| Group | CyclinD1protein | CDK4protein | Notch1protein | ||||||||||||
| (t/h) | 6 | 24 | 48 | 72 | (t/h) | 6 | 24 | 48 | 72 | (t/h) | 6 | 24 | 48 | 72 | |
| Shamoperation | 0.26±0.04 | 0.27±0.05 | 0.26±0.07 | 0.27±0.06 | 0.20±0.04 | 0.23±0.03 | 0.22±0.04 | 0.22±0.06 | 0.15±0.04 | 0.16±0.05 | 0.15±0.05 | 0.16±0.04 | |||
| I/R | 0.58±0.06* | 0.75±0.09* | 0.84±0.08* | 0.89±0.09* | 0.50±0.09* | 0.65±0.05* | 0.73±0.07* | 0.86±0.09* | 0.28±0.08* | 0.44±0.07* | 0.72±0.04* | 0.55±0.09* | |||
| CIP | 0.35±0.08*△ | 0.43±0.09*△ | 0.56±0.06*△ | 0.63±0.07*△ | 0.29±0.07*△ | 0.38±0.06*△ | 0.42±0.09*△ | 0.51±0.08*△ | 0.59±0.07*△ | 0.73±0.05*△ | 0.94±0.04*△ | 0.82±0.07*△ | |||
| DAPT | 0.46±0.04*# | 0.65±0.06*# | 0.71±0.07*# | 0.80±0.08*# | 0.42±0.06*# | 0.53±0.07*# | 0.59±0.06*# | 0.70±0.08*# | 0.44±0.10*# | 0.58±0.08*# | 0.83±0.06*# | 0.65±0.08*# | |||
| *P < 0.05 vs sham operation group;△P < 0.05 vs I/R group;#P < 0.05 vs CIP group. | |||||||||||||||
|
| Lane 1:6h;Lane 2:24 h; Lane 3:48 h; Lane 4:72 h. 图 5 Western blotting法检测各组大鼠海马区Cyclin D1(A)、CDK4(B)和Notch1(C)蛋白表达电泳图 Figure 5 Electrophoregram of expressions of Cyclin D1(A), CDK4(B), and Notch1(C)proteins in hoppocampus of rats in various groups detected by Western blotting method |
|
|
CIP是一种新发现的内源性保护现象,即在组织缺血后持续再灌注前多次短暂再灌注/缺血处理可以减轻再灌注损伤,由于CIP可以在缺血后实施,所以具有良好的临床应用前景。近年来研究[7-10]显示:CIP在减轻心肌损伤的缺血再灌注损伤、肝脏缺血再灌注损伤、肾脏缺血再灌注损伤和肺移植再灌注损伤等疾病的治疗发挥着重要作用。CIP作为一种缺氧耐受现象,可以减轻脑缺血再灌注损伤,但其内源性保护机制尚不清楚,成为众多学者的研究重点。韩冬等[11]发现:与I/R组比较,CIP组血脑屏障紧密连接开放减轻紧密连接蛋白表达水平升高,提示CIP能够减轻紧密连接破坏,其保护机制可能与ZO-1蛋白表达增加有关;李鑫等[12]发现:CIP所产生的神经保护作用可以被N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体抑制剂所阻断,说明CIP通过激活NMDA受体起到神经保护作用。Notch信号通路作为邻近细胞之间信息交流平台,在决定细胞发育、分化、增殖、凋亡及上皮细胞向间质细胞转化过程中发挥重要作用[13-14],且Notch信号转导通路是众所周知的调节神经系统发育的通路,在大脑发育中对神经干细胞的维护、增殖和分化也起重要作用。近期研究[15]显示:CIP可激活Notch信号转导通路,从而促进老年大鼠脑缺血诱导的神经元再生作用并改善脑缺血后受损的神经功能。研究[16]显示:Notch1信号通路可以通过抑制细胞凋亡线粒体途径,减轻细胞凋亡的发生,从而在心肌缺血后处理中起到心肌保护作用,为防治心肌缺血再灌注损伤提供新靶点。本研究结果显示:与I/R组比较,CIP组大鼠海马区Notch1蛋白表达水平明显升高,且神经元存活率升高,说明了CIP通过提高Notch1通路的活性对损伤神经元起到修复作用。
细胞增殖是通过细胞周期有丝分裂的调控来实现的。细胞周期呈现的是由复杂的蛋白质系统调节细胞分裂所需的一系列生物化学变化。研究[17]显示:脑缺血再灌注损伤的神经元内Cyclin D1和CDK4的表达是决定神经元进入病理状态与否的关键细胞周期因子。近期研究[18]显示:CIP可通过启动心肌组织相关Cyclins和CDK4的表达实现心肌细胞的增殖补偿或修复受损的心肌组织。本研究结果显示:与I/R组比较,CIP组大鼠海马区Cyclin D1和CDK4蛋白表达水平明显降低,且损伤神经元数明显减少,说明CIP对脑缺血神经元的保护作用可能与下调Cyclin D1和CDK4的表达有关。研究[19]显示:Notch1信号通路通过调节Cyclin D1的表达使SMMC7721细胞静止在G0/G1期,表明Cyclin D1是Notch1信号通路的一个十分重要的下游调控基因。徐培荣等[20]发现:Notch1信号途径可以通过对Cyclin D1和CyclinE的调控抑制食管鳞癌细胞的增殖,提示Cyclin D1和CyclinE是受Notch1调节的一个重要的下游基因。上述证据表明:Notch1信号通路通过对Cyclins的调节, 参与细胞周期的调控。本研究结果显示:DAPT组中大鼠海马区Notch1蛋白表达水平低于CIP组,而Cyclin D1、CDK4蛋白表达水平高于CIP组,说明抑制Notch1通路的活性能够提高Cyclin D1和CDK4蛋白表达水平。本文作者推测:CIP可以通过提高Notch1信号通路活性进而调控Cyclin D1和CDK4的表达,调节神经元的细胞周期,最终起到对神经元的保护作用。
关于CIP对脑缺血损伤保护作用的确切机制还有待进一步研究。对CIP机制的研究越明确深入,越有利于寻找脑缺血保护的有效治疗途径,为以后临床治疗脑缺血损伤疾病提供重要的参考依据。
| [1] | Zhao ZQ, Corvera JS, Halkos ME, et al. Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J]. Am J Physiol Heart Circ Physiol, 2003, 285(2): 579–588. DOI:10.1152/ajpheart.01064.2002 |
| [2] | 刘瑶, 赵雅宁, 李建民, 等. P38MAPK通路对脑缺血后处理大鼠海马自噬的影响[J]. 西安交通大学学报:医学版, 2017, 38(4): 522–528. |
| [3] | Su nF, Ma oX, Xi eL, et al. Notch1 signaling modulates neuronal progenitor activity in the subventricular zone in response to aging and focal ischemia[J]. Aging Cell, 2013, 12(6): 978–987. DOI:10.1111/acel.2013.12.issue-6 |
| [4] | 金文虎, 王达利, 聂开瑜, 等. 增生性瘢痕成纤维细胞中Cyclin D1, CDK2, CDK4作用及与细胞周期的相关性[J]. 中国组织工程研究, 2012, 16(24): 4422–4426. DOI:10.3969/j.issn.1673-8225.2012.24.011 |
| [5] | Zhao Y, Chen X, Ma L, et al. Electroacupuncture pretreatment induces tolerance against focal cerebral ischemia through activation of canonical Notch pathway[J]. BMC Neurosci, 2012, 13(1): 111. DOI:10.1186/1471-2202-13-111 |
| [6] | 李兵, 章翔, 蒋晓帆, 等. 改良四血管阻塞法建立大鼠全脑缺血模型[J]. 中华神经外科疾病研究杂志, 2005, 4(2): 110–113. |
| [7] | 彭荣琳, 涂荣会, 郑国军. STEMI急诊介入治疗中缺血后处理对心肌的保护作用[J]. 心血管康复医学杂志, 2015, 24(3): 277–279. |
| [8] | 吉斐, 华赟鹏, 简佩恩, 等. 缺血后处理对肝硬化大鼠肝脏缺血-再灌注损伤保护作用的免疫机制[J]. 中华肝脏外科手术学电子杂志, 2014, 3(6): 371–374. |
| [9] | 王磊, 刘修恒, 陈晖. 肾脏缺血后处理对缺血再灌注损伤保护作用的研究进展[J]. 职业与健康, 2015, 31(16): 2292–2294, 2298. |
| [10] | 张浩, 伍火志, 马明生. 缺血后处理对肺移植早期NF-κB激活信号通路影响的研究[J]. 中国现代医学杂志, 2015, 25(7): 12–17. |
| [11] | 韩冬, 孙淼, 何平平, 等. 缺血后处理对大鼠脑缺血再灌注后紧密连接的保护作用及ZO-1蛋白表达的影响[J]. 中风与神经疾病杂志, 2015, 32(4): 296–298. |
| [12] | 李鑫, 吕达平, 姚明, 等. 缺血后处理通过NMDA受体对全脑缺血大鼠的神经保护作用[J]. 中风与神经疾病杂志, 2015, 32(10): 910–913. |
| [13] | Wu X, Fleming A, Ricketts T, et al. Autophagy regulates Notch degradation and modulates stem cell development and neurogenesis[J]. Nat Commun, 2016, 7(1): 10533. |
| [14] | Wang L, Song G, Ming L, et al. MicroRNA-375 overexpression influences P19 cell proliferation, apoptosis and differentiation through the Notch signaling pathway[J]. Int J Mol Med, 2016, 37(1): 47–55. DOI:10.3892/ijmm.2015.2399 |
| [15] | 周娜. 脑缺血后处理对全脑缺血大鼠海马区Notch1/细胞周期通路的影响[D]. 唐山: 华北理工大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10081-1016784270.htm |
| [16] | 何砚如, 陈立娟, 马根山. Notch信号通路对缺血心肌的保护作用[J]. 东南大学学报:医学版, 2016, 35(1): 139–143. |
| [17] | 龚薇薇. INOSINE对脑缺血再灌流后脑组织Cyclin D1、CDK4表达的影响[D]. 青岛: 青岛大学, 2004. http://d.wanfangdata.com.cn/Thesis_Y618275.aspx |
| [18] | 王耀琴. 缺血后处理启动细胞周期促进受损心肌组织修复的研究[D]. 太原: 山西医科大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10114-1013224442.htm |
| [19] | Sriuranpong V, Borges MW, Ravi RK, et al. Notch signaling induces cell cycle arrest in small cell lung cancer cells[J]. Cancer Res, 2001, 61(7): 3200–3205. |
| [20] | 田园如画, 周中和, 陈会生. 腺苷酸活化蛋白激酶在缺血预处理诱导的神经保护中的作用[J]. 解放军医学杂志, 2015, 40(5): 366–371. DOI:10.11855/j.issn.0577-7402.2015.05.07 |
 2017, Vol. 43
2017, Vol. 43


