扩展功能
文章信息
- 王俊妹, 孙千月, 吴哲, 李彤, 李婧
- WANG Junmei, SUN Qinyue, WU Zhe, LI Tong, LI Jing
- 银杏叶提取物对破骨细胞分化和骨吸收的作用及其机制
- Effects of Ginkgo Bitoba extract on differentiation and bone resorption ofosteoclasts and their mechanisms
- 吉林大学学报(医学版), 2017, 43(06): 1130-1136
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1130-1136
- 10.13481/j.1671-587x.20170612
-
文章历史
- 收稿日期: 2017-05-18
2. 广州医科大学附属口腔医院修复科, 广东 广州 510500
2. Department of Prosthodontics, Affiliated Stomatology Hospital, Guangzhou Medical University, Guangzhou 510500, China
骨量一直是口腔种植修复的基础,充足且健康的骨组织是成功完成红、白美学修复的关键,外伤和拔牙后牙槽骨萎缩、囊肿以及根尖周病变等通常会导致牙槽骨骨量不足,给种植修复带来困难[1]。骨量不足主要是由于破骨细胞活性过高,引起骨质破坏和骨溶解,骨稳态平衡丧失。因此,有效抑制破骨细胞的形成和功能是防治溶骨性损害如种植体松动和炎症性骨吸收等的重要途径[2]。
目前,国内外针对破骨细胞的治疗药物包括雌激素和双磷酸盐等,但长期采用雌激素疗法能增加子宫内膜癌和乳腺癌的发病率[3],口服双磷酸盐易导致颌骨坏死的发生[4]。中药因其副作用小、药效温和等优点,受到越来越多学者的关注。银杏叶提取物(Ginkgo Biloba extract, GBE)是一种传统中药,研究遍及到医药学的各个领域,尤其其在心脑血管疾病方面[5]的疗效已经得到了共识,但在骨组织方面的研究尚处于初级阶段。Nizamettin等[6]通过放射学和组织形态学观察到GBE能够加速骨形成及骨折的愈合, 本课题组前期实验[7]也证实:GBE可以促进大鼠BMSCs向成骨细胞分化,且在质量浓度为75和15 mg·L -1[8]时,其促成骨效果较为明显。但GBE对破骨细胞的影响却鲜有报道,其促进骨再生机制尚不明确。本研究通过观察GBE对破骨细胞分化及骨吸收的作用,进一步探索其成骨机制,为研究GBE在骨重建中的作用提供理论基础。
1 材料与方法 1.1 主要试剂和仪器银杏叶标准品(徐州恒凯银杏制品有限公司),L-DMEM培养基(美国Hyclone公司),胎牛血清、双抗和胰蛋白酶(美国Gibco公司),RAN提取试剂盒(日本TaKaRa公司),蛋白提取试剂盒和抗酒石酸酸性磷酸酶试剂盒(美国Sigma公司),可溶性重组核因子κB受体活化因子配体(RANKL)(美国Peprotech公司)。低温高速离心机(德国Eppendorf公司),二氧化碳孵化箱(日本SANYO公司),平底6孔板、12孔板和96孔板(美国Corning公司),培养瓶(美国Corning公司),聚合酶链式反应(PCR)循环仪(美国Perkin Elmer Cetus公司)等。
1.2 细胞培养小鼠单核巨噬细胞系RAW264.7购于美国MANASSAS公司,接种到含10%胎牛血清、1%青霉素和链霉素的培养基的12孔板上,置于37℃、5% CO2培养箱中孵育。
1.3 体外破骨细胞诱导分化实验细胞随机分为空白对照组、RANKL组、RANKL+75 mg·L -1 GBE组和RANKL+150 mg·L -1 GBE组,每组设3个复孔。依据实验分组将100μg·L -1 RANKL诱导因子作用于12孔板中的RAW264.7细胞,诱导其向破骨细胞分化,2 h后分别加入不同浓度GBE进行干扰,隔天换液,7 d后PBS冲洗,4%多聚甲醛固定细胞10 min,采用抗酒石酸酸性磷酸酶染色(TRAP)法对细胞染色,倒置相差显微镜下计数每孔中TRAP阳性(细胞核≥3)的细胞,拍照,分析。所得数据取平均值。
1.4 骨片的制备硬组织切片机将新鲜牛股骨皮质切成150 μm厚的骨片, 砂纸均匀磨为20 μm,超声波清洗后, 75%乙醇浸泡,紫外线过夜消毒,采用完全培养基在12孔板中浸泡48 h(每孔1个骨片),每12 h换液,孵育箱中孵育备用。
1.5 骨吸收陷窝实验细胞随机分为空白对照组、RANKL组、RANKL+75 mg·L -1 GBE组和RANKL+150 mg·L -1 GBE组,每组3个复孔。依据实验分组将RAW 264.7细胞(2×104个细胞/孔)接种至上述孵育箱12孔板中的骨片上,在孵育箱中培养24 h,加入100μg·L-1RANKL诱导因子诱导2 h,再加入75和150 mg·L -1 GBE对RAW264.7细胞继续培养,隔天换液。7 d后,倒置相差显微镜下观察骨片上细胞黏附情况,取出骨片,PBS冲洗掉骨片上细胞,梯度乙醇脱水,扫描电镜下观察骨片,采集每张骨片上圆形、椭圆形和不规则形凹陷的骨吸收陷窝图像,每组采集3张骨片,骨吸收陷窝图像采用IMAGE-PRO PLUS6图像软件(美国Media Cybernetics公司)分析并计算其面积。所得数据取平均值。
1.6 流式细胞术检测RAW264.7细胞凋亡率和RT-PC检测细胞随机分为空白对照组、75 mg·L -1 GBE组和150 mg·L -1 GBE组。依据实验分组,将RAW 264.7细胞(5×105个细胞/孔)接种至6孔板中,每组1个孔,以75和150 mg·L -1 GBE对RAW264.7细胞进行孵育,24 h后依据凋亡试剂盒操作步骤,流式细胞术检测RAW264.7细胞凋亡率。
1.7 RT-PCR法检测RAW264.7细胞凋亡相关基因B淋巴细胞瘤2(Bcl-2)和Bcl-2相关X蛋白(Bax)表达水平目的基因相对表达水平计算方法:分别计算3个重复样品中目标基因Bcl-2、Bax和内参基因GAPDH平均Ct值,内参基因对目的基因进行校正,计算出ΔΔCt,采用2-ΔΔCt表示目的基因的相对表达水平。ΔΔCt= ΔCt (实验组) -ΔCt(空白组),ΔCt=同一实验组中目的基因平均Ct值-内参基因平均Ct值。实验重复3次。
1.8 流式细胞术检测RAW264.7细胞周期和蛋白表达细胞随机分为RANKL组、RANKL+75 mg·L -1 GBE组和RANKL+150 mg·L -1 GBE组。依据实验分组将RAW 264.7细胞(1×106个细胞/孔)接种至6孔板中,每组1个孔,采用100μg·L -1RANKL诱导因子及75、150 mg·L -1 GBE对RAW264.7细胞进行孵育,24 h后终止培养,胰酶消化后收集细胞,PBS冲洗2次,弃上清,加入2 mL70%预冷乙醇中,吹打均匀,4℃固定24 h后,PBS冲洗2次,加入PI避光染色30 min,流式细胞术检测细胞周期,MODFIT软件进行细胞周期分析。
1.9 RT-PCR法检测G0-G1期相关基因P27和细胞周期蛋白D1(Cyclin-D1)表达水平结果以基因相对表达水平显示。目的基因相对表达水平计算方法:分别计算3个重复样品中目标基因P27、细胞周期蛋白D1(Cyclin-D1)和内参基因GAPDH平均Ct值,内参基因对目的基因进行校正,计算出ΔΔCt,采用2-ΔΔCt表示目的基因的相对表达水平。ΔΔCt=ΔCt (实验组) -ΔCt(空白组),ΔCt=同一实验组中目的基因平均Ct值-内参基因平均Ct值。实验重复3次。
1.10 RT-PCR法检测活化T细胞核因子c1(NFATc1)、树突状细胞特异性跨膜蛋白(DC-STAMP)、组织蛋白酶K(Cathepsin K)和基质金属蛋白酶9(MMP-9)基因表达水平细胞随机分为空白对照组、RANKL组、RANKL+ 75 mg·L -1 GBE组和RANKL+150 mg·L -1 GBE组。依据实验分组将RAW 264.7细胞(2×106个细胞/孔)接种到6孔板中,每组1孔,采用75和150 mg·L -1 GBE对RAW264.7细胞先孵育2 h,加入100μg·L -1 RANKL诱导因子继续孵育,24 h后,按照细胞RNA提取试剂盒从细胞中提取总RNA, Nano-drop分光光度计测定mRNA浓度,按照RT-PCR Kit说明书进行逆转录操作,结果以基因相对表达水平显示。目的基因相对表达水平计算方法:分别计算3个重复样品目的基因和内参基因平均Ct值,用内参基因对目的基因进行校正,计算出ΔΔCt,采用2-ΔΔCt表示目的基因的相对表达水平。ΔΔCt= ΔCt (实验组) -ΔCt(空白组),ΔCt=同一实验组中目的基因平均Ct值-内参基因平均Ct值。实验重复3次。PCR引物序列见表 1。
| Gene | Forward primer (5′-3′) | Reverse primer (5′-3′) | Length of product (bp) |
| NFATc1 | CGAGTTCACATCCCACAG | GACAGCACCATCTTCTTCC | 158 |
| β3-integrin | GGCTTTTCTCTTCCTGCT | TTTCTTTCTTTCTTTCTTTCTCC | 98 |
| DC-STAMP | TGATGAAAAGGAGAGGCA | AGGACAGGAAGGAAGAACA | 141 |
| Bax | GCTACAGGGTTTCATCCA | CGTCAGCAATCATCCTCT | 170 |
| Cathepsin K | ACGAGAAAGCCCTGAAGA | TGTAAAACTGGAAAGATGCC | 87 |
| Bcl-2 | CGAGAAGCATTTTAGCAGTT | GACAGAGTGAGTATTGGAGGAG | 110 |
| P27 | ATAAGCACTGAGAAAGCAAAA | AACAAAGCAAATAAGGAACAAC | 118 |
| Cyclin D1 | CGGATGAGAACAAGCAGA | CGGTAGCAGGAGAGGAAG | 172 |
| MMP-9 | TCACTTTCCCTTCACCTTC | ATTTGCCGTCCTTATCGT | 113 |
| GAPDH | AAGAAGGTGGTGAAGCAGG | GAAGGTGGAAGAGTGGGAGT | 111 |
采用SPSS19.0统计软件进行统计学分析。破骨细胞数,骨吸收陷窝面积,Bcl-2、Bax、P27、Cyclin-D1、NFATc1、DC-STAMP、MMP-9和Cathepsin K基因相对表达水平均以x ±s表示。以P<0.05为差异有统计学意义。
2 结果 2.1 各组破骨细胞的形态和数量TRAP染色后,倒置相差显微镜下观察到RANKL组破骨细胞贴壁生长,比空白对照组RAW264.7细胞体积大3~10倍,多核,形态不规则,多数为圆形典型的破骨细胞,少数可见伪足,细胞内TRAP活性部分被TRAP染色为粉红色,细胞核为阴性,无染色。与RANKL组比较,RANKL+75 mg·L -1 GBE和RANKL+150 mg·L -1 GBE组破骨细胞数明显减少(P < 0.05),且RANKL+75 mg·L -1 GBE组破骨细胞数量多于RANKL+150 mg·L -1 GBE组。见图 1(插页四)和表 2。
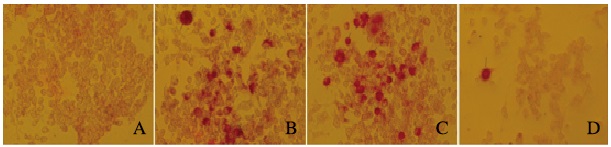
|
| A: Control group; B: RANKL group; C:RANKL+75 mg·L-1 GBE group; D:RANKL+150 mg·L-1 GBE group. 图 1 光镜下各组破骨细胞形态表现(TRAP,×100) Figure 1 Morphology of osteoclasts in various groupsunder light microscope(TRAP, ×100) |
|
|
| (n=3, x ±s) | |
| Group | Number of osteoclasts |
| Blank control | 0.000±0.000 |
| RANKL | 74.556±0.839* |
| RANKL+75 mg·L -1 GBE | 43.222±1.953△ |
| RNAKL+150 mg·L -1 GBE | 13.889±1.018△ |
| *P < 0.05 vs blank control group; △P < 0.05 vs RANKL group. | |
扫描电镜下,RANKL组骨片上骨吸收陷窝表现出圆形、椭圆形、三角形和多边形等多种形态,部分还可呈串珠样,深浅不一,陷窝内胶原纤维清晰可见(图 2A~D)。IMAGE-PRO PLUS6图像软件分析,与RANKL组比较,RANKL+75 mg·L -1 GBE和RANKL+150 mg·L-1 GBE组骨吸收陷窝面积明显减少(P < 0.05),RANKL+150 mg·L -1 GBE组骨吸收陷窝面积小于RANKL+75 mg·L-1 GBE组, 但组间比较差异无统计学意义(P < 0.05)。见图 2和表 3。
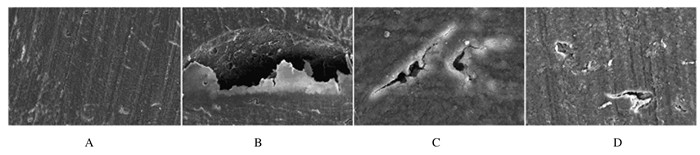
|
| A: Blank control group; B: RANKL group; C:RANKL+75 mg·L-1 GBE group; D:RANKL+150 mg·L -1 GBE group. 图 2 各组破骨细胞骨吸收陷窝形态表现(×100) Figure 2 Morphology of bone resorption pits of osteoclasts in various groups(×100) |
|
|
| (n=3, x ±s) | |
| Group | Area of bone resorption(S/mm2) |
| Blank control | 0.000±0.000 |
| RANKL | 3.644±0.312* |
| RANKL+75 mg·L -1 GBE | 2.127±0.063△ |
| RNAKL+150 mg·L -1 GBE | 1.177±0.064△ |
| *P < 0.05 vs blank control group; △P < 0.05 vs RANKL group. | |
与空白对照组比较,75和150 mg·L -1 GBE组RAW264.7细胞凋亡率升高(P<0.05);Bcl-2表达水平明显降低(P<0.05),Bax表达水平明显升高(P<0.05)。见图 3和表 4。
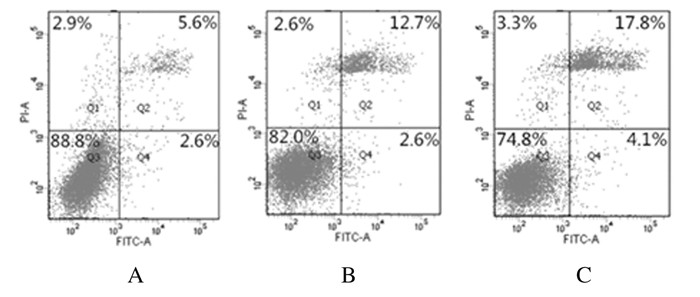
|
| A: Blank control group; B: 75 mg·L -1 GBE group; C: 150 mg·L-1 GBE group. 图 3 流式细胞术检测各组RAW264.7细胞凋亡率 Figure 3 Diagram of apoptotic rates of RAW264.7 cells in various groupsdetected by flow cytometry |
|
|
| (n=3, x ±s) | |||
| Group | Relative expression level | ||
| Bcl-2 | Bax | ||
| Blank control | 1.000±0.000 | 1.000±0.000 | |
| 75 mg·L -1 GBE | 1.686±0.013* | 0.224±0.013* | |
| 150 mg·L -1 GBE | 3.062±0.027* | 0.077±0.013* | |
| *P < 0.05 vs blank control group. | |||
与RANKL组比较,RANKL+75 mg·L -1 GBE组和RANKL+150 mg·L-1 GBE组RAW264.7细胞G0-G1期明显缩短(P<0.05),细胞中P27表达水平明显降低,Cyclin-D1表达水平明显升高(P<0.05)。见图 4和表 5。
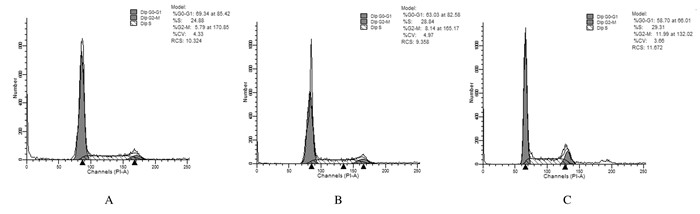
|
| A:RANKL group; B: RANKL+75 mg·L -1 GBE group; C: RANKL+150 mg·L -1 GBE group. 图 4 各组RAW264.7细胞周期流式图 Figure 4 Diagram of cell cycle of RAW264.7 cells in various groups |
|
|
| (n=3, x ±s) | ||
| Group | Relative expression level | |
| P27 | Cyclin-D1 | |
| RANKL | 0.034± 0.015 | 12.055±0.043 |
| RANKL+75 mg·L -1 GBE | 0.340±0.024* | 5.178±0.020* |
| RANKL+150 mg·L -1 GBE | 1.195±0.013* | 2.789±0.015* |
| *P < 0.05 vs RANKL group. | ||
与空白对照组比较,RANKL组RAW264.7细胞中破骨细胞相关基因NFATc1、DC-STAMP、Cathepsin K和MMP-9表达水平明显升高(P<0.05);与RANKL组比较,RANKL+ 75 mg·L-1 GBE和RANKL+150 mg·L-1 GBE组RAW264.7细胞中破骨细胞相关基因NFATc1、DC-STAMP、Cathepsin K和MMP-9表达水平明显降低(P<0.05)。见表 6。
| (n=3, x ±s) | ||||
| Group | Relative expression level | |||
| NFATc1 | DC-STAMP | Casthepin K | MMP-9 | |
| Blank control | 1.000±0.000 | 1.000±0.000 | 1.000±0.000 | 1.000±0.000 |
| RANKL | 0.041±0.014* | 0.023±0.010* | 0.035±0.020* | 0.028±0.060* |
| RANKL+75 mg·L -1 GBE | 0.207±0.031△ | 0.094±0.013△ | 0.227±0.024△ | 0.078±0.012△ |
| RANKL+150 mg·L -1 GBE | 0.899±0.019△ | 0.593±0.023△ | 0.720±0.022△ | 0.755±0.022△ |
| *P < 0.05 vs blank control group; △P < 0.05 vs RANKL group. | ||||
骨吸收是一种有序的过程,包括破骨细胞前体细胞的募集、分化和活化[9],该过程中的任何异常均会影响破骨细胞性能,导致骨吸收抑制或增强。因此,干扰破骨细胞的诱导分化、减弱破骨细胞的活性均是有效的抑制骨吸收的方法。本研究观察GBE对破骨细胞前体细胞RAW264.7细胞凋亡、细胞周期、破骨细胞分化和骨吸收活性的影响,阐述GBE对骨吸收的作用及其潜在的机制。
RAW264.7细胞是一种被广泛应用的破骨细胞前体细胞,其在100μg·L -1 RANKL诱导因子的作用下,能够分化为破骨细胞[10]。RANK是肿瘤坏死因子家族中的一种,RANKL与细胞表面跨膜蛋白RANK结合,导致肿瘤坏死因子受体相关因子6(TRAF 6)募集,激活丝裂原活化蛋白激酶(MAPK)及相关转录因子(如NF-κB、AP-1和NFAT)[11-12],随即上调破骨细胞相关基因(如NFATc1、DC-STAMP、Cathepsin K和MMP-9)的表达,这些基因中,NFATc1是调控RANKL诱导的破骨细胞基因表达的转录因子[13],DC-STAMP是单核细胞融合及巨细胞形成中必要的细胞因子,Cathepsin K和MMP-9能够有效降解骨组织中的有机成分,在破骨细胞骨吸收活性中发挥重要的作用[9],因此本实验采用RT-PCR法选择这4种基因来验证RAW264.7细胞向破骨细胞的分化。
本研究结果显示:GBE能够减少RANKL诱导的TRAP阳性破骨细胞的数量,RT-PCR结果证实了GBE抑制破骨细胞分化相关基因NFATc1和DC-ATEMP的表达。体外实验中,常用破骨细胞骨陷窝的面积来评估骨吸收能力,本研究通过IMAGE-PRO PLUS 6软件对底片进行分析显示:破骨细胞形成的骨吸收陷窝面积明显被GBE所抑制,浓度为150 mg·L -1时效果最明显,RT-PCR结果验证了GBE抑制破骨细胞骨吸收活性相关基因Cathepsin K和MMP-9的表达,上述结果提示GBE抑制破骨细胞骨吸收活性。
破骨细胞由多个单核细胞融合而成,在RANKL的作用下,RAW264.7细胞在向破骨细胞分化的同时,进行着细胞融合。而在该过程中,RAW264.7细胞的凋亡、分化周期对破骨细胞的诱导均有重要的意义。RAW264.7细胞凋亡率影响破骨细胞的数量,Bcl-2与Bax常共同用于细胞凋亡的研究,Bcl-2是一种癌基因,具有抑制细胞凋亡的作用,Bax是Bcl-2基因家族中细胞凋亡促进基因,Bax的过表达可拮抗Bcl-2的保护效应。本实验观察到GBE能够促进RAW264.7细胞凋亡,RT-PCR结果证实:GBE组RAW264.7细胞中Bcl-2表达水平降低,Bax表达水平升高,RAW264.7细胞的过早凋亡使向破骨细胞分化的RAW264.7细胞减少。RAW264.7细胞向破骨细胞分化时,细胞周期发生相应的改变,研究[16]表明:RANKL诱导过程中,RAW264.7细胞长期处于G0-G1期,以便于破骨细胞相关基因的表达,P27和Cyclin-D1均是调控细胞周期的重要基因,P27抑制细胞由G1向S期的转变[17-19],Cyclin-D1促进细胞增殖,缩短G0-G1期;P27和Cyclin-D1的改变可评估G0-G1期的长短。本研究结果显示:GBE明显缩短RANKL诱导的RAW264.7细胞的G0-G1期阻滞,导致P27表达水平降低、Cyclin-D1表达水平升高。
综上所述,GBE可促进RAW264.7细胞凋亡,使RANKL诱导的RAW264.7细胞的G0-G1期阻滞缩短,进而抑制破骨细胞的分化和骨吸收, GBE对成骨细胞与破骨细胞的双重作用预示着其在骨再生方面有良好的临床应用前景。
| [1] | Chrcanovic BR, Albrektsson T, Wennerberg A. Bone quality and quantity and dental implant failure:a systematic review and meta-analysis[J]. Int J Prosthodont, 2017, 30(3): 219–237. DOI:10.11607/ijp.5142 |
| [2] | Feihl S, Renz N, Schutz M, et al. Antibiotic strategies in trauma surgery:Treatment of implant-associated infections[J]. Unfallchirurg, 2017, 120(6): 486–493. DOI:10.1007/s00113-017-0359-5 |
| [3] | Mungenast F, Aust S, Verqote L, et al. Clinical significance of the estrogen-modifying enzymes steroid sulfatase and estrogen sulfotransferase in epithelial ovarian cancer[J]. Oncol Lett, 2017, 13(6): 4047–4054. |
| [4] | Gross C, Weber M, Creutzburg K, et al. Osteoclast profile of medication-related osteonecrosis of the jaw secondary to bisphosphonate therapy:a comparison with osteoradionecrosis and osteomyelitis[J]. J Transl Med, 2017, 15(1): 128–130. DOI:10.1186/s12967-017-1230-8 |
| [5] | Zhou X, Qi Y, Chen T. Long-term pre-treatment of antioxidant Ginkgo biloba extract EGb-761 attenuates cerebral-ischemia-induced neuronal damage in aged mice[J]. Biomed Pharmacother, 2017, 85(1): 256–263. |
| [6] | Guzel N, Sayit E, Aynaci O, et al. Ginkgo Biloba improves bone formation during fracture healing:an experimental study in rats[J]. Acta Ortop Bras, 2017, 25(3): 95–98. DOI:10.1590/1413-785220172503156966 |
| [7] | 张甲弟, 时舒曼, 张海燕, 等. 银杏叶提取物对骨髓间充质干细胞增殖及成骨分化的影响[J]. 口腔医学研究, 2015, 31(6): 575–579. |
| [8] | 时舒曼, 袁浩天, 张晓晓, 等. 银杏叶提取物诱导骨髓间充质干细胞成骨分化过程中P38信号通路的研究[J]. 口腔医学研究, 2016, 32(9): 912–915. |
| [9] | Matsuo K, Irie N. Osteoclast-osteoblast communication[J]. Arch Biochem Biophys, 2008, 473(2): 201–209. DOI:10.1016/j.abb.2008.03.027 |
| [10] | Zeng XZ, He LG, Wang S, et al. Aconine inhibits RANKL-induced osteoclast differentiation in RAW264.7 cells by suppressing NF-κB and NFATc1 activation and DC-STAMP expression[J]. APS, 2016, 37(2): 255–263. |
| [11] | Walsh MC, Kim N, Kadono Y, et al. Osteoimmunology:interplay between the immune system and bone metabolism[J]. Annu Rev Immunol, 2006, 24: 33–63. DOI:10.1146/annurev.immunol.24.021605.090646 |
| [12] | Takayanagi H. Osteoimmunology:shared mechanisms and crosstalk between the immune and bone systems[J]. Nat Rev Immunol, 2007, 7(4): 292–304. DOI:10.1038/nri2062 |
| [13] | Negishi-Koga T, Takayanagi H. Ca2+-NFATc1 singnaling is an essential axis of osteoclast differentiation[J]. Immunol Rev, 2009, 231(1): 241–256. DOI:10.1111/imr.2009.231.issue-1 |
| [14] | Wisitrasameewong W, Kajiya M, Movila A, et al. DC-STAMP is an osteoclast fusogen engaged in periodontal bone resorption[J]. J Dent Res, 2017, 96(6): 685–693. DOI:10.1177/0022034517690490 |
| [15] | Nagase Y, Iwasawa M, AkiyamaT, et al. Anti-apoptotic molecule Bcl-2 regulates the differentiation, activation, and survival of both osteoblasts and osteoclasts[J]. J Biol Chem, 2009, 284(52): 366659–366669. |
| [16] | Kwon M, Kim JM, Le cK, et al. Synchronized cell cycle arrest promotes osteoclast differentiation[J]. MolSci, 2016, 17(8): 1292–1300. |
| [17] | Li A, Wang J, Wu M, et al. The inhibition of activated hepatic stellate cells proliferation by arctigenin through G0/G1 phase cell cycle arrest:persistent p27(Kip1) induction by interfering with PI3K/Akt/FOXO3a signaling pathway[J]. Eur J Pharmacol, 2015, 747: 71–87. DOI:10.1016/j.ejphar.2014.11.040 |
| [18] | 章振林, 夏维波, 金小岚, 等. 骨质疏松诊治进展及分级诊疗制度之讨论[J]. 中国实用内科杂志, 2016, 36(11): 928–934. |
| [19] | 赵兰岚, 姚军, 高莹, 等. 促甲状腺激素抑制治疗及其与分化型甲状腺癌骨代谢相关性研究进展[J]. 中国实用内科杂志, 2017, 37(2): 162–165. |
 2017, Vol. 43
2017, Vol. 43


