扩展功能
文章信息
- 路博丞, 冷向阳, 张鹏程, 王英, 王旭凯
- LU Bocheng, LENG Xiangyang, ZHANG Pengcheng, WANG Ying, WANG Xukai
- 鹿茸多肽联合GDNF基因修饰的雪旺细胞对人骨髓间质干细胞体外增殖的影响
- Effect of velvet antler polypeptides combined with Schwann cells modified with GDNF gene on proliferation of human bone marrow mesenchymal stem cells in vitro
- 吉林大学学报(医学版), 2017, 43(06): 1125-1129
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1125-1129
- 10.13481/j.1671-587x.20170611
-
文章历史
- 收稿日期: 2017-04-13
关节软骨的缺损是临床上的常见损伤, 且易导致关节面不平整,继发骨性关节炎等其他更为严重的骨科疾病[1],由于关节软骨缺损自身修复能力有限,临床主要采用关节镜下清创术、软骨移植、软骨细胞移植、组织工程技术及凝胶类关节软骨修复材料等对关节软骨损伤进行修复。近年来,随着组织工程的发展,组织工程技术用于关节软骨损伤修复备受关注[2]。骨髓间质干细胞(bone marrow mesenchymal stem cells,BMSCs)由于具有多向分化潜能,能够在一定条件下分化为骨细胞、软骨细胞、骨髓基质细胞、血管内皮细胞及神经星状细胞等[3],是组织工程较为理想的种子细胞。而鹿茸多肽(pilose antlepeptide,PAP)是从梅花鹿茸中提取的一种多肽类生物活性因子, 为鹿茸的主要活性成分,能有效刺激软骨细胞增殖[4]。研究[5]证实:PAP可促进BMSCs向神经元样细胞转化,且BMSCs诱导后胶质细胞源性神经营养因子(GDNF)表达明显增加。由此可见,GDNF参与了BMSCs向神经元样细胞分化的过程。但由于GDNF是目前已知运动神经营养因子中活性最强的[5],其半衰期短且不能通过血脑屏障,无法用于临床,但若使用GDNF基因修饰的雪旺细胞,可提高两者的协同作用[6]。本研究探讨PAP联合GDNF基因修饰的雪旺细胞对人BMSCs体外增殖的影响,旨在为临床优化组织工程中的种子细胞的研究提供实验和理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器清洁级Wistar大鼠20只,体质量201~250 g,购于南京君科生物工程有限公司,动物许可证号:SCXK(苏)2014-0011。饲养环境:温度(25±1)℃,湿度50%~70%,12 h光照,自由饮食水。主要试剂:αMEM培养基(美国海克隆实验公司),胎牛血清(美国Gibco公司),0.25%胰蛋白酶(美国Invitrogen公司),青霉素和链霉素(华北制药集团),D-Hank’ s液和磷酸盐缓冲液(PBS)(上海华联制药有限公司),Ficoll-Hypaque淋巴细胞分离液(天津TDB生物技术发展中心产品),雪旺细胞增生刺激培养液、荧光标记CD34-PE、CD45-FITC、CD29-FITC、CD90-FITC单克隆抗体和四唑盐MTT(美国Sigma公司),增殖细胞核抗原PCNA(武汉博士德生物工程有限公司),鹿茸多肽粉针(具有水溶性)。主要仪器:25cm2培养瓶和75cm2培养瓶(上海闪晶分子生物科技有限公司),倒置光学显微镜(北京恒奥德仪表有限公司),流式细胞仪(美国BD公司),酶联免疫测定仪(北京万泰公司)。
1.2 BMSCs的分离和培养按常规方法抽取健康志愿者骨髓10 mL,志愿者均身体健康,同意进行试验并签署知情同意书。将骨髓置于有肝素的离心管中,加入等量PBS缓冲液稀释混匀,将骨髓稀释液置于等量淋巴细胞分离液中,离心,吸取灰白色单核细胞层,加入PBS洗涤2次,离心,接种于培养瓶中,调整细胞浓度至5 × 106mL-1,置于37 ℃、5%CO2饱和湿度的培养箱中进行培养。2d后换液并去除未贴壁细胞,此后每3d更换1次培养液,至原代培养细胞完全融合前进行传代,采用0.25%胰酶预热,接种于培养瓶中进行消化。显微镜下观察发现细胞间隙增大、细胞质回缩,终止消化,吹打瓶壁细胞使其脱离形成细胞悬液,PBS洗涤后进行接种传代。传至第3代时收获BMSCs,调整细胞浓度为5 × 106mL-1备用。
1.3 BMSCs的鉴定不同代次的BMSCs采用PBS重新悬浮后, 调整细胞浓度为1× 106mL-1,接种于6孔细胞培养板, 采用成骨以及软骨细胞诱导分化试剂盒进行诱导培养,取100μL细胞悬液与CD34-PE、CD45-FITC、CD73-FITC和CD90-FITC单抗室温避光孵育后,采用茜素红染色、甲苯胺蓝染色和油红染色进行表面分子的鉴定。
1.4 雪旺细胞的分离、培养和鉴定在无菌条件下切取大鼠坐骨神经置于D-Hank’ s液中, 将神经外膜组织剥离, 然后将神经组织剪切成约1.0 mm×1.0 mm×1.0 mm的组织块, 采用0.25%胰蛋白酶消化, 常规细胞培养液清洗3次, 接种于6孔细胞培养板, 2d后换液并去除未贴壁细胞, 用雪旺细胞增生刺激培养液继续培养。当细胞达到80%融合后, 采用0.25%胰酶预热,接种于培养瓶中进行消化,调整浓度为3×107mL-1备用。
1.5 GDNF基因修饰雪旺细胞选择携带GDNF的重组逆转录病毒载体质粒,采用PA317细胞包装,然后进行病毒提取,得到重组的逆转录病毒;使用重组逆转录病毒将培养得到的雪旺细胞进行转染,采用RT-PCR法进行细胞扩增,再培养,得到GDNF基因修饰的雪旺细胞。
1.6 BMSCs增殖活力检测将不同代次BMSCs调整其浓度为5×104mL-1,接种于96孔培养板中,常规培养24h后用含5%FBS的培养基进行培养。GDNF组:加入4μLGDNF基因修饰的雪旺细胞(约2×105个);联合组:4μLPAP(终浓度为10mg·L-1)与GDNF基因修饰的雪旺细胞联与细胞外基质凝胶制成复合体,加入培养基内;对照组未加入任何药物,置于37℃、5% CO2、饱和湿度培养箱中孵育,结束前在每孔滴加CCK-8 10μL,振荡混匀后继续孵育2h。采用酶联免疫检测法测定各孔吸光度(A)值,以A值表示细胞的增殖活力。
1.7 各组BMSCs中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)水平检测将不同代次的BMSCs接种于6孔板,常规培养24 h后,加入4μLGDNF基因修饰的雪旺细胞作为GDNF组,加入4μL PAP(终浓度为10 mg·L-1)联合GDNF基因修饰的雪旺细胞作为联合组,对照组未加任何药物,仅加入等量的培养基。培养48 h后,采用ELISA法检测各孔BMSCs中PCNA水平。
1.8 细胞凋亡率的检测采用胰蛋白酶将培养后的细胞消化后,采用RPMI1640培养液将其制成2×104mL-1的细胞悬液,接种于6孔板。GDNF组:加入4μL GDNF基因修饰的雪旺细胞(约2×105个);联合组:培养基中加入4μL PAP(终浓度为10 mg·L-1)与GDNF基因修饰的雪旺细胞混合液与及细胞外基质凝胶制成复合体;对照组未加入任何药物。在原相同环境条件下继续培养48 h,采用AnnexinⅤ-FIFC/PI细胞凋亡检测试剂盒,于荧光显微镜下观察细胞凋亡率。
1.9 统计学分析采用SPSS 22.0统计软件进行统计学分析。各组细胞增殖活力、PCNA水平和细胞凋亡率以x ±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
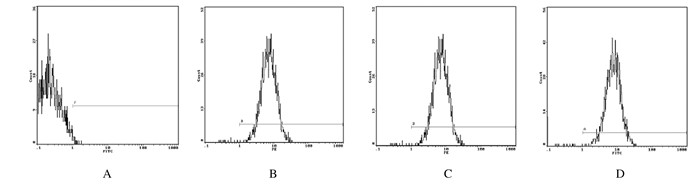
2 结果 2.1 BMSCs的形态表现和抗原特性显微镜下观察,原代BMSCs培养48 h后大部分细胞贴壁, 形态转变为多角形, 少数呈梭形(图 1A,见插页四)。传代细胞几乎呈梭形(图 1B,见插页四)。各代及BMSCs样本中CD34和CD45表达呈阴性, CD73及CD90表达呈阳性。见图 2。

|
| 图 1 光镜下原代BMSCs形态表现(×200) Figure 1 Morphology of primary cultured BMSCs under light microscope(×200) |
|
|
|
| 图 2 各代BMSCs中CD34(A)、CD44(B)、CD73(C)和CD90(D)的表达 Figure 2 Expressions of CD34 (A), CD44(B), CD73(C), and CD90(D) in BMSCs in different generations |
|
|
与对照组比较,GDNF组和联合组细胞增殖活力和PCNA水平升高(P < 0.05),细胞凋亡率降低(P < 0.05);与GDNF组比较,联合组细胞增殖活力和BMSCs中PCNA水平升高,细胞凋亡率降低(P < 0.05)。见表 1。
| (x ±s) | |||
| Group | Proliferative activity | PCNA level | Apoptotic rate (η/%) |
| Control | 0.253±0.033 | 2.54±0.74 | 9.26±1.49 |
| GDNF | 0.484±0.039* | 9.37±1.08* | 7.31±1.25* |
| Combined | 0.593±0.027*△ | 15.36±2.33*△ | 4.95±0.77*△ |
| *P < 0.05 vs control group; △P < 0.05 vs GDNF group. | |||
本研究结果显示:生长因子在关节软骨形成过程中的作用开始受到重视, 有学者对其进行研究发现,种子细胞的生长需要生长因子的调控以得到良好的生物活性[7]。各种组织细胞均来源于自己的干细胞,因此干细胞是近年来研究的热点。BMSCs主要来源于骨髓网状间质,其来源丰富、取材方便、移植方法简单、免疫原性弱,是一种多能干细胞[8],且可作为基因治疗的载体,通过血-脑屏障将有治疗作用的物质释放到中枢神经系统[9-10],是组织工程中较理想的种子细胞。BMSCs非造血干细胞,具有易于体外分离及扩增、易于在体外进行基因操作等优点,因此受到人们的关注。但骨髓中的BMSCs含量稀少,占核细胞的百万分之一到十万分之一,且大部分BMSCs处于G0/G1期[11];但临床组织工程需要大量的种子细胞,故需对BMSCs进行体外纯化和扩增[12]。
鹿茸是中医学中的名贵中药,中华药典记载其具有壮肾阳、益精血、强筋骨、调冲任和托疮毒等功效,临床应用广泛[13]。现代研究[14]证实:鹿茸中的有效成分如多肽、多胺和多糖等,具有对心血管系统、神经系统和免疫系统等多个方面的调节作用,PAP是从梅花鹿茸中提取的一种多肽类生物活性因子,以往均作为保健品。动物实验结果[15-16]表明:PAP具有抗衰老和抗疲劳等作用,还具有抗炎和促生长的作用。近年来的研究[17]结果表明:PAP能明显刺激并促进成骨细胞和软骨细胞的增殖。动物实验[18]已经证实:PAP对BMSCs增殖有促进作用。神经营养因子是一个大的蛋白家族,包括神经生长因子和神经营养素等。本文作者发现:应用PAP联合GDNF基因修饰雪旺细胞的联合组细胞增殖活力高于GDNF组,提示GDNF能明显促进细胞增殖,这与魏传银[19]的研究结果相似,且联合作用能够明显促进人BMSCs的增殖水平,效果优于单一用药。研究[20]表明:GDNF是最强的运动神经营养因子,雪旺细胞是周围神经系统的主要神经胶质细胞,可分泌多种神经营养因子,是神经系统所特有的,能够促进神经元再生、改善损伤部位的微环境,因此被认为是细胞移植治疗中最有临床应用前景的种子细胞。应用转基因技术可以将GDNF基因转染到雪旺细胞中,不仅可以提高GDNF的分泌水平,还能够促进神经元的再生和恢复。近年来的研究[21-22]显示:GDNF的空间位置与转化生长因子β (transforming growth factor-β,TGF-β)相同,因此也具有促进细胞增殖的作用。
PCNA是一种仅在增殖细胞中表达的核内多肽,是人类DNA复制复合体中的核心组分之一。PCNA还与细胞凋亡及增殖密切相关,因此为检测细胞增殖活性的标志之一。本研究结果显示:与对照组比较,GDNF组和联合组细胞的PCNA水平较高,提示联合方法可以促进细胞的增殖;其中应用PAP联合GDNF基因修饰雪旺细胞的联合组PCNA水平较高,提示PAP联合GDNF基因修饰的雪旺细胞对于PCNA表达的促进作用更好,可以调控DNA复制,促进细胞的增殖,并能抑制细胞凋亡,这可能是由于PCNA的基因具有较为特殊的环状结构,有利于促进DNA的复制,且PCNA能够与多种细胞内分子相结合,对细胞周期产生调控作用,并且能对DNA的损伤产生修复作用,此外还在DNA甲基化、染色体重塑等过程中发挥重要的功能。
综上所述,本实验通过探讨PAP联合GDNF基因修饰的雪旺细胞对人BMSCs体外增殖的影响,证实了PAP联合GDNF基因修饰的雪旺细胞对人BMSCs体外增殖具有明显的促进作用,为临床优化组织工程中种子细胞的研究提供了实验和理论依据。在未来研究中,本课题里将对本实验的结论进行更深入的论证。
| [1] | 张洪长, 张莹, 刘明昕, 等. 鹿茸多肽对人骨髓间充质干细胞BMP-2和Runx2表达的影响[J]. 吉林大学学报:医学版, 2015, 41(3): 491–495. |
| [2] | 白东, 周忠笑, 张健. 人端粒酶反转录酶基因修饰骨髓间充质干细胞调控肝细胞增殖和凋亡[J]. 中国组织工程研究, 2015, 19(32): 5118–5122. DOI:10.3969/j.issn.2095-4344.2015.32.007 |
| [3] | 胡文昕. GDNF基因修饰的雪旺细胞对大鼠脊髓损伤神经修复机制的实验研究[D]. 长春: 长春中医药大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10199-1012420652.htm |
| [4] | 汤锋. 鹿茸多肽促进周围神经损伤修复的研究进展[J]. 中国医师杂志, 2015, 17(5): 793–795. |
| [5] | 龚庆, 杨春辉, 宋秋莹. 鹿茸多肽对骨髓间充质干细胞向神经元样细胞转化的促诱导作用[J]. 医药卫生:文摘版, 2016, 14(3): 230–230. |
| [6] | 薛杨, 黄晓蕾, 蔡伶伶, 等. Fth1基因标记对骨髓间充质干细胞生物学特性及体外MRI表现的影响[J]. 第二军医大学学报, 2016, 37(7): 841–845. |
| [7] | 李瑞妮, 荣为为, 金世柱, 等. 骨髓间充质干细胞体外增殖的策略[J]. 医学研究生学报, 2015, 28(5): 549–552. |
| [8] | 王旭凯. GDNF基因修饰的雪旺细胞对大鼠脊髓损伤保护作用的实验研究[D]. 长春: 吉林大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10183-2009093632.htm |
| [9] | 张琨. 对鹿茸活性成分的药理学研究[J]. 中国科技博览, 2015(25): 397. |
| [10] | Kierdorf U, Li C, Price JS. Improbable appendages:deer antler renewal as a unique case of mammalian regeneration[J]. Semin Cell Dev Biol, 2009, 20(5): 535–542. DOI:10.1016/j.semcdb.2008.11.011 |
| [11] | 王玺, 王胜, 肖玉周. 脐血间充质干细胞诱导分化为类雪旺细胞修复大鼠坐骨神经损伤的实验研究[J]. 中国修复重建外科杂志, 2015, 29(2): 213–220. DOI:10.7507/1002-1892.20150046 |
| [12] | 李昂, 李波, 魏志坚, 等. 骨髓间充质干细胞治疗脊髓损伤的研究进展[J]. 中国脊柱脊髓杂志, 2016, 26(1): 90–94. |
| [13] | 冯烨军, 陈明. 骨髓间充质干细胞在神经修复中的研究进展[J]. 神经损伤与功能重建, 2016, 11(5): 426–428. |
| [14] | 张爱霞, 余伟华, 王涛, 等. 人骨髓间质干细胞诱导成骨分化过程中差异表达蛋白的鉴定和分析[J]. 中国现代医学杂志, 2015, 25(25): 16–20. DOI:10.3969/j.issn.1005-8982.2015.25.004 |
| [15] | 胡太超, 刘玉敏, 陶荣珊, 等. 鹿茸的化学成分及药理作用研究概述[J]. 经济动物学报, 2015, 19(3): 156–162. |
| [16] | 汤锋. 鹿茸多肽修复周围神经损伤的应用研究及辽西地区周围神经损伤的流行病学初步调查[D]. 沈阳: 辽宁中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10162-1015660016.htm |
| [17] | Zang ZJ, Tang HF, Tuo Y, et al. Effects of velvet antler polypeptide on sexual behavior and testosterone synthesis in aging male mice[J]. Asian J Androl, 2016, 18(4): 613–619. DOI:10.4103/1008-682X.166435 |
| [18] | Polisetti N, Chaitanya VG, Babu PP, et al. Isolation, characterization and differentiation potential of rat bone marrow stromal cells[J]. Neurology India, 2010, 58(2): 201. DOI:10.4103/0028-3886.63789 |
| [19] | 魏传银. 胶质细胞源性神经营养因子与PC12工程细胞在大鼠脊髓损伤治疗中的协同作用[D]. 青岛: 青岛大学, 2003. http://cdmd.cnki.com.cn/article/cdmd-11906-2004096125.htm |
| [20] | 王逸文, 徐方剑, 孙浩, 等. 鹿茸多肽提取工艺及其药理学作用[J]. 上海中医药杂志, 2016(4): 94–96. |
| [21] | 崔军, 莫忆南. 鹿茸多肽-FK506-PLGA复合膜修复周围神经损伤的实验研究[J]. 中国医药科学, 2016, 6(17): 30–32. |
| [22] | 何珊, 赵俪月, 巴晓晔, 等. 苯妥英钠对大鼠骨髓间充质干细胞与血管内皮细胞VEGF和SCF分泌的影响[J]. 西安交通大学学报:医学版, 2016, 37(2): 204–208. |
 2017, Vol. 43
2017, Vol. 43


