扩展功能
文章信息
- 张利群, 姚兰, 潘袁, 赵芸鹤, 蔡知天
- ZHANG Liqun, YAO Lan, PAN Yuan, ZHAO Yunhe, CAI Zhitian
- 卵巢功能调控相关蛋白在不同发育阶段卵泡中的表达及其意义
- Expressions of ovarian function-related proteins in ovarian follicles in different development stages and their significances
- 吉林大学学报(医学版), 2017, 43(06): 1121-1124
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1121-1124
- 10.13481/j.1671-587x.20170610
-
文章历史
- 收稿日期: 2017-08-11
卵泡发育调控机制和排卵障性疾病发生机制研究一直备受大家关注。蛋白质调控卵泡发育和卵巢功能研究成为热点,但大多数是针对小鼠卵巢组织进行研究,针对人卵巢组织的研究极少。本课题组[1]曾对绝经期与育龄期女性卵巢组织行比较蛋白质组学及Western blotting分析,筛选出4种蛋白,即乙二醛酶Ⅰ(Glyoxalase Ⅰ)、泛素羧基末端水解酶L1(ubiquitin carboxy-terminal hydrolase L1,UCH-L1)、热休克蛋白27(heat shock protein 27,HSP 27)和血清淀粉样蛋白P(serum amyloid P,SAP)作为与卵巢功能调控相关的功能蛋白。本研究采用免疫组织化学技术分析这些蛋白在不同发育阶段卵泡中的表达强度,探讨蛋白与卵泡发育及卵巢功能调控的相关性,关于这些蛋白与在人卵巢组织的相关研究目前国内外未见报道。
1 材料与方法 1.1 主要试剂选取本院病理科育龄期女性的包含不同发育阶段卵泡的正常卵巢组织蜡块,鼠抗人SAP、HSP27、Glyoxalase Ⅰ、UCH-L1一抗和辣根过氧化物酶标记山羊抗鼠IgG二抗(美国Invitrogen公司),免疫组织化学试剂盒和DAB显色试剂盒(北京中杉公司)。
1.2 免疫组织化学法检测不同发育阶段卵泡中SAP、HSP27、Glyoxalase Ⅰ和UCH-L1表达强度选取卵巢组织石蜡蜡块、切片,脱蜡,封闭,抗原修复,于室温封闭2h。吸去封闭液,加入适当浓度一抗,加入二抗,DAB染色,镜下观察,终止显色,采用苏木素染液复染,棕色阳性,1%HCL作用10s后水洗。梯度乙醇脱水,二甲苯透明,中性树胶封片,观察SAP、HSP27、Glyoxalase Ⅰ和UCH-L1在不同发育阶段卵泡中的表达强度。
1.3 蛋白在不同发育阶段卵泡中表达强度的判定方法细胞质染色呈棕色为阳性,提示有蛋白表达;据棕色的深浅区分表达强度,棕褐色为强表达,棕黄色为中等强度表达,淡棕色为弱表达。胞质不显色为阴性,提示蛋白不表达。
2 结果 2.1 光镜下不同发育阶段卵泡的特征原始卵泡:被单层梭形前颗粒细胞围绕而成;初级生长卵泡:梭形前颗粒细胞分化为一层或多层立方形细胞,在卵母细胞周围出现红染的透明带,卵泡外围出现卵泡膜;次级生长卵泡:出现卵泡腔,形成卵丘,位于卵泡内壁为颗粒层,卵泡膜分内膜和外膜2层。成熟卵泡:卵泡腔很大,卵丘很明显。卵泡内膜细胞紧靠卵泡颗粒层,内膜细胞呈多边形,胞质清亮,胞核圆形,细胞间可见许多毛细血管,外膜细胞位于最外层,多呈梭形,与周围结缔组织分界不明显。
2.2 Glyoxalase Ⅰ在不同发育阶段卵泡中的表达强度Glyoxalase Ⅰ在原始卵泡、初级生长卵泡胞质中呈弱表达,在次级生长卵泡和成熟卵泡颗粒细胞及卵泡膜细胞质中呈强表达,在闭锁卵泡中呈强表达,在白体中不表达。见图 1(插页三)。
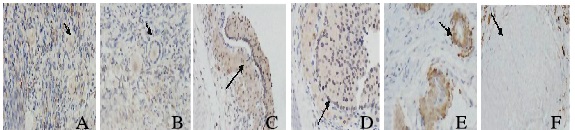
|
| A:Primordial follicle; B:Primary follicle; C:Secondary follicle; D:Mature follicle; E:Atretic follicle; F:Corpus albican. 图 1 Glyoxalase Ⅰ在不同发育阶段卵泡中的表达强度(×20) Figure 1 Expression intensities of Glyoxalase Ⅰ in different developmental stages of follicles(×20) |
|
|
HSP27在原始卵泡及初级卵泡的细胞质中呈中等强度的表达,在次级卵泡和成熟卵泡颗粒细胞及卵泡膜细胞质中呈弱表达,在闭锁卵泡中呈强表达,在白体中不表达。见图 2(插页三)。
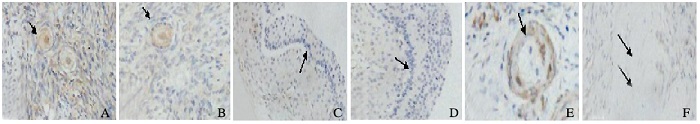
|
| A:Primordial follicle; B:Primary follicle; C:Secondary follicle; D:Mature follicle; E:Atretic follicle; F:Corpus albican. 图 2 HSP27在不同发育阶段卵泡中的表达强度(×20) Figure 2 Expression intensities of HSP27 in different developmental stages of follicles (×20) |
|
|
SAP在原始卵泡和初级卵泡胞质中呈强表达,在次级卵泡和成熟卵泡颗粒细胞质中呈强表达,在闭锁卵泡呈强表达,在白体中不表达。见图 3(插页三)。
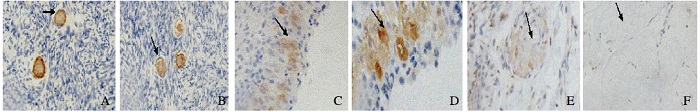
|
| A:Primordial follicle; B:Primary follicle; C:Secondary follicle; D:Mature follicle; E:Atretic follicle; F:Corpus albican. 图 3 SAP在不同发育阶段卵泡蛋白中的表达强度(×20) Figure 3 Expression intensities of SAP in different developmental stages of follicles (×20) |
|
|
UCH-L1在原始卵泡和初级卵泡质中呈中等强度表达,在次级卵泡和成熟卵泡颗粒细胞及卵泡膜细胞质中呈强表达,在闭锁卵泡呈弱表达,在白体中不表达。见图 4(插页三)。
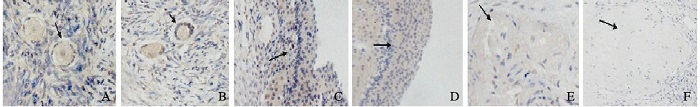
|
| A:Primordial follicle; B:Primary follicle; C:Secondary follicle; D:Mature follicle; E:Atretic follicle; F:Corpus albican. 图 4 UCH-L1在不同发育阶段卵泡蛋白中的表达强度(×20) Figure 4 Expression intensities of UCH-L1 in different developmental stages of follicles (×20) |
|
|
本研究结果显示:Glyoxalase Ⅰ、UCH-L1、HSP27和SAP蛋白在不同发育阶段卵泡中表达强度不同。在次级卵泡和成熟卵泡的颗粒细胞及卵泡膜细胞胞质中UCH-L1呈强表达,HSP27呈弱表达;在闭锁卵泡中Glyoxalase Ⅰ呈强表达,HSP27呈强表达;SAP在原始卵泡、初级卵泡、次级卵泡及成熟卵泡均呈强表达,所有蛋白均定位表达于细胞质;蛋白在白体中均不表达。
3.1 Glyoxalase Ⅰ与卵巢功能调控的关系本研究结果表明:Glyoxalase Ⅰ在原始卵泡和初级生长卵泡细胞质中呈弱表达;随着卵泡的生长,在次级生长卵泡及成熟卵泡颗粒细胞及卵泡膜细胞质中呈强表达;在闭锁卵泡中呈强表达,且表达水平升高,考虑主要参与卵泡的闭锁及凋亡。Rulli等[3]研究表明:低雌激素作用可以促进Glyoxalase Ⅰ表达水平升高,减低雌激素的作用可上调乳腺癌激素敏感型细胞系MCF7细胞中Glyoxalase-Ⅰ基因的表达并增强其酶活性。绝经期妇女卵巢功能衰退,雌激素水平降低,且大多数闭锁卵泡为凋亡的卵泡,细胞凋亡过程中甲基二乙醛(MG)浓度增加,MG激活Glyoxalase Ⅰ系统发挥其细胞中高效的解毒机制,清除这些细胞毒物[3-4]。卵细胞的凋亡闭锁可促进Glyoxalase Ⅰ表达水平升高,起到解毒保护作用,但Glyoxalase Ⅰ水平升高是否又作用于衰退的卵细胞促进其继续凋亡闭锁尚需进一步研究。
3.2 UCH-L1与卵巢功能调控的关系UCH-L1在细胞分裂、细胞信号转导以及细胞程序死亡的过程中起重要作用[5]。本研究结果表明:随着卵泡的生长(由原始卵泡、初级卵泡到次级卵泡及成熟卵泡),该蛋白在颗粒细胞及卵泡膜细胞质中表达水平升高。考虑UCH-L1参与卵泡的成熟,在卵巢功能调控过程中发挥重要作用。Kwon等[6]证明:UCH-L1在精子细胞早期凋亡和精子变形过程中起重要作用。在大部分哺乳动物的雄性性腺组织中表达。另外,UCH-L1在小鼠卵母细胞中有表达,参与精子和卵子的结合,且在卵巢损伤诱导中发挥作用[7-9]。UCH-L1可通过调控Mos/MAPK通路,调控卵泡发育过程中卵母细胞生发泡破裂(GVBD)过程及卵细胞第二次减数分裂(MII)期的停滞与发生,参与了卵泡发育及卵巢功能的调控[10]。
3.3 HSP27与卵巢功能调控的关系HSP27在原始卵泡和初级卵泡细胞质呈中等强度表达,随着卵泡生长,其表达减弱,其在闭锁卵泡中呈强表达。研究[11-12]表明:进入老年后,磷酸化的HSP27保护细胞功能的活性下降,且HSP27磷酸化水平降低。HSP27影响雌激素与子宫内膜雌、孕激素的活性,HSP27表达强度降低可以促进老鼠卵泡的成熟[13-14]。上述研究结果与本研究结果共同表明:HSP27在生长期卵泡中的弱表达利于卵泡的发育,HSP27在卵泡凋亡闭锁过程中呈强表达且与细胞凋亡相关。
3.4 SAP与卵巢功能调控的关系SAP在不同发育阶段卵泡中均呈强表达,且参与了卵泡发育生长和卵泡闭锁的整个过程。研究[15]显示:人SAP增强重新折叠变性乳酸脱氢酶对抗酶失活。另外,SAP可能参与组织结构的维持。生理状态下SAP特异性地、钙依赖性地与DNA和染色质结合,清除因细胞死亡而暴露的染色质。研究[16-17]显示:SAP参与细胞凋亡抑制自身抗体诱生。SAP参与了自身免疫调控和组织结构维持,考虑SAP可通过对自身免疫状况的影响,参与卵泡发育及卵巢功能调控。
本研究结果表明:Glyoxalase Ⅰ、UCH-L1、HSP27和SAP蛋白参与卵泡发育和卵巢功能调控,UCH-L1强表达及HSP27弱表达与卵泡成熟发育相关,Glyoxalase Ⅰ强表达及HSP27强表达与卵泡闭锁及卵巢功能衰退有关,但其具体影响机制尚需进一步研究。
| [1] | Zhang LQ, ZhangXN, Ga oY, et al. Identification of differentially expressed proteins in the ovaries of menopausal women[J]. Arch Gynecol Obstet, 2014, 290(6): 1179–1186. DOI:10.1007/s00404-014-3357-7 |
| [2] | Rulli A, Antognelli C, Prezzi E, et al. A possible regulatory role of 17 beta estradiol and tamoxifen on glyoxalase Ⅰ and glyoxalase Ⅱ genes expression in MCF7 and BT20 human breast cancer cells[J]. Breast Cancer Res Treat, 2006, 96(2): 187–196. DOI:10.1007/s10549-005-9078-7 |
| [3] | Rabbani N, Thornalley PJ. Methylglyoxal, glyoxalase 1 and the dicarbonyl proteome[J]. Amino Acids, 2012, 42(4): 1133–1142. DOI:10.1007/s00726-010-0783-0 |
| [4] | Tatone C, Carbone MC, Campanella G, et al. Female reproductive dysfunction during ageing:role of methylglyoxal in the formation of advanced glycation endproducts in ovaries of reproductivelyaged mice[J]. J Biol Regul Homeost Agents, 2010, 24(1): 63–72. |
| [5] | 方一力, 张志刚. 泛素羧基端水解酶L1在人类疾病发生发展中的调控作用[J]. 临床与病理杂志, 2017, 37(1): 177–183. DOI:10.3978/j.issn.2095-6959.2017.01.030 |
| [6] | Kwon J, Mochida K, Wang YL, et al. Ubiquitin C-terminal hydrolase L-1 isessential for the early apoptotic wave of germinal cells and for sperm quality control during spermatogenesis[J]. Biol Reprod, 2005, 73(1): 29–35. DOI:10.1095/biolreprod.104.037077 |
| [7] | Sekiguchi S, Kwon J, Yoshida E, et al. Localization of ubiquitin C-terminal hydrolase L1 in mouse ovay and its function in the plasma membrane to block polyspermy[J]. Am J Pathol, 2006, 169(5): 1722–1729. DOI:10.2353/ajpath.2006.060301 |
| [8] | Mtango NR, Sutovsky M, Vandevoort CA, et al. Essential role of ubiquitin C-terminal hydrolases UCHL1 and UCHL3 in mammalian oocyte maturation[J]. J Cell Physiol, 2012, 227(5): 2022–2029. DOI:10.1002/jcp.22931 |
| [9] | He YX, Zhang H, Li HY, et al. Differential proteomics reveals the potential injury mechanism induced by heavy ion radiation in mice ovaries[J]. BES, 2017, 30(4): 301–307. |
| [10] | Kim HJ, Kim YM, Lim S, et a1. Ubiquitin C-terminal hydrolase-L1 is a key regulator of tumor cell invasion and metastasis[J]. Oncogene, 2008, 28(1): 117–127. |
| [11] | Arrigo AP. The cellular 'networking' of mammalian Hsp27 and its functions in the control of protein folding, redox state and apoptosis[J]. Adv Exp Med Biol, 2007, 594: 14–26. DOI:10.1007/978-0-387-39975-1 |
| [12] | Njemini R, Lambert M, Demanet C, et al. The effect of aging and inflam mation on heat shock protein 27 in human monocytes and lymphocytes[J]. Exp Gerontol, 2006, 41(3): 312–319. DOI:10.1016/j.exger.2006.01.006 |
| [13] | Velazquez MM, Alfaro NS, Salvetti NR, et al. Levels of heat shock protein transcripts in normal follicles and ovarian follicular cysts[J]. Reprod Biol, 2011, 11(3): 276–283. DOI:10.1016/S1642-431X(12)60072-2 |
| [14] | Liu JJ, Ma X, Cai LB, et al. Downregulation of both gene expression andactivity of Hsp27 improved maturation of mouse oocyte in vitro[J]. Reprod Biol Endocrinol, 2010, 8: 47–58. DOI:10.1186/1477-7827-8-47 |
| [15] | Wood SP, Coker AR. Serum amyloid P component-structural features and amyloid recognition[M]. Amyloid Proteins: Beta Sheet Conform Dis, 2008: 189-209. |
| [16] | Burlingame RW, Volzer MA, Harris J, et al. The effect of acute phase proteins on clearance of chromatin from the circulation of normal mice[J]. J Immunol, 1996, 156(12): 4783–4788. |
| [17] | 王丽, 杨筱凤, 毛文军, 等. 青春期女性月经失调与卵巢形态学分析[J]. 西安交通大学学报:医学版, 2017, 38(4): 579–583. |
 2017, Vol. 43
2017, Vol. 43


