扩展功能
文章信息
- 李贺, 刘聪, 李宁, 王春梅, 敬舒, 孙靖辉, 孙红霞, 张成义, 陈建光
- LI He, LIU Cong, LI Ning, WANG Chunmei, JING Shu, SUN Jinghui, SUN Hongxia, ZHANG Chengyi, CHEN Jianguang
- 北五味子酸性多糖对阿尔茨海默病模型小鼠学习记忆能力的改善作用
- Improvement of acidic polysaccharose of Schisandra Chinensis on learning and memory functions of Alzheimer's disease model mice
- 吉林大学学报(医学版), 2017, 43(06): 1115-1120
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1115-1120
- 10.13481/j.1671-587x.20170609
-
文章历史
- 收稿日期: 2017-06-05
2. 北华大学附属医院普外科, 吉林 吉林 132001
2. Department of General Surgery, Affiliated Hospital, Beihua University, Jilin 132001, China
阿尔茨海默病(Alzheimer’ s disease, AD)是一种进行性发展的致死性神经退行性疾病。记忆认知功能减退是AD的主要临床表现。研究[1-2]显示:Tau蛋白过度磷酸化是AD发生的主要发病机制之一。北五味子具有敛肺滋肾、生津敛汗、涩精止安和宁心安神的功效。晋代《抱扑子》有五味子“常服能返老还童、延年益寿”的记载。《本草纲目》记载:“五味子有南北之分,入滋补药必用北产者乃良”。指出北五味子是五味子中的上品。北五味子多糖是五味子中主要活性成分之一,北五味子酸性多糖(SCP-A)是本课题组在北五味子总多糖中分离提取得到的酸性多糖成分。目前关于SCP-A抗AD作用尚未见报道。本研究通过Aβ25-35建立小鼠AD模型,探讨SCP-A对AD小鼠记忆的改善作用及基于Tau蛋白磷酸化相关机制,为开发具有抗AD功能的药物提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级健康C57BL小鼠75只,雄性,体质量(20±2) g,由吉林大学实验动物研究中心提供,实验动物生产许可证号:SCXK(吉)2015-0005,小鼠采取分笼饲养,且维持12 h:12 h昼夜循环,饲料供给充足,自由饮水。SCP-A由北华大学五味子开发及产业化工程研究中心提供,二氧化钛(分析纯)和吐温-20(分析纯)购自天津永大试剂公司,Aβ25-35购自美国Sigma试剂有限公司,HCl-Tris、30%丙烯酰胺、TEMED、过硫酸铵、Tris和甘氨酸购自北京鼎国试剂公司,脱脂奶粉购自美国BD公司,β-actin、Tau-5、p-Tau S199、p-Tau S396、p-Tau S404、GSK-3β,p-GSK-3β Tyr216及GSK-3β S9购自美国Abcam公司,ECL显色液购自江苏碧云天生物制品有限公司。Western blotting电泳仪和电转仪购自美国Bio-Red公司,ChampChemi Professional+全自动多色荧光及化学发光凝胶成像系统购自北京赛智创业科技有限公司,DT-200小鼠避暗仪和MT-200 Morris水迷宫分析仪购自成都泰盟科技有限公司。
1.2 动物分组和给药方式75只C57BL小鼠随机分为5组,每组15只,即空白组(侧脑室注射生理盐水及灌胃蒸馏水)、模型组(侧脑室注射Aβ25-35及灌胃蒸馏水)、5 mg·kg-1 SCP-A组(侧脑室注射Aβ25-35及灌胃5mg·kg-1SCP-A)、10 mg·kg-1 SCP-A组(侧脑室注射Aβ25-35及灌胃10 mg·kg-1SCP-A)和20 mg·kg-1 SCP-A组(侧脑室注射Aβ25-35及灌胃20 mg·kg-1 SCP-A)。灌胃药物每日1次,连续14 d,于第8天以Aβ25-35行侧脑室注射。侧脑室注射方法见参考文献[3]。给药完毕后,第15天依次进行避暗实验、Morris水迷宫实验及Western blotting检测。
1.3 小鼠避暗实验将小鼠放入避暗仪中面部背向洞口放入明室,同时启动计时器。小鼠进入洞口到达暗室被错误时计时器记录的时间即为潜伏期。本实验对小鼠训练5 min,并记录在5 min内小鼠的错误次数。间隔24 h后进行第2次试验。通过记录每只鼠的潜伏期以及在5 min内出现的错误次数[4-5],观察SCP-A对AD小鼠学习记忆能力的影响。
1.4 Morris水迷宫实验训练期间继续给药,将小鼠放在Morris水迷宫视频跟踪测试系统WMT-100中,小鼠的训练时间设定为120 s,在120 s内未达到终点的小鼠按120 s记录。每隔24 h训练1次,采集第5天的实验数据。第1次实验之前将小鼠放在平台附近,使其自动爬上3次。以后每次训练前将小鼠放在平台附近,使其自主爬上平台1次。第6天去掉平台统计小鼠空间搜索能力,通过小鼠穿越平台的次数和穿越有效区的次数[4]观察SCP-A对AD小鼠学习记忆能力的影响。
1.5 Western blotting法检测脑海马组织中Tau磷酸化相关蛋白表达水平1.4中小鼠末次给药后30 min,每组取3只小鼠脑海马组织,加入裂解液,冰上裂解1 h,置入高速离心机离心取上清。采用BCA法测定组织蛋白浓度,以10%SDS-PAGE凝胶电泳分离目标蛋白。2 h电转移至PVDF膜,取出膜在Tris缓冲液(TBST)中漂洗5 min,然后用封闭液封闭1 h (含5%脱脂奶粉的TBST缓冲液)。室温孵育后弃去封闭液,分别加入Tau-5、TauSer199/202、Tau Ser396、Tau Ser404、糖原合酶激酶3β(glycogen synthase kinase 3β, GSK-3β)、GSK-3β Ser9和GSK-3β(Try216)等一抗(1:1 000),4℃温育过夜后,TBST洗涤5×5 min。加入二抗(1:2 000)温育2 h,TBS-T洗涤5×5 min,最后加入显色液ECL显色。通过观察Tau-5、TauSer199/202、Tau Ser396、Tau Ser404、GSK-3β、GSK-3βSer9和GSK-3βTry216的蛋白表达水平研究SCP-A改善AD小鼠学习记忆能力的机制。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。避暗实验中小鼠的潜伏期和错误次数、Morris水迷宫实验中小鼠的潜伏期、经过平台及有效区次数、Tau-5、TauSer199/202、Tau Ser396、Tau Ser404、GSK-3β、GSK-3βSer9和GSK-3βTry216的蛋白表达水平以x ±s表示,对于符合正态分布且总体方差齐的数据组间比较采用单因素方差分析,不符合正态分布且总体方差不齐的数据组间比较采用Kruskal-WallisH检验。以P < 0.05为差异统计学意义。
2 结果 2.1 避暗实验检测各组小鼠潜伏期和错误次数在第2天的记忆测试中,与空白组比较,模型组小鼠潜伏期明显缩短(P < 0.01),错误次数明显增加(P < 0.01);与模型组比较,10和20 mg·kg-1SCP-A组小鼠潜伏期明显延长(P < 0.01),错误次数明显减少(P < 0.05或P < 0.01);5 mg·kg-1 SCP-A组小鼠错误次数多于10和20 mg·kg-1 SCP-A组(P < 0.05),10 mg·kg-1 SCP-A组小鼠错误次数多于20 mg·kg-1 SCP-A组(P<0.05)。见表 1。
| (n=15, x ±s) | ||
| Group | Latency(t/s) | Number of error |
| Control | 46.83±10.12 | 4.24±2.01 |
| Model | 13.52±9.95* | 13.07±2.51* |
| SCP-A | ||
| 5 mg·kg-1 | 18.85±4.17△ | 12.55±2.05 |
| 10 mg·kg-1 | 28.75±12.68△△ | 8.53±1.57△△# |
| 20 mg·kg-1 | 39.84±7.33△△ | 4.71±1.68△#▲ |
| *P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs model group;#P < 0.05 vs 5mg·kg-1 SCP-A group; ▲P < 0.05 vs 10 mg·kg-1 SCP-A group. | ||
与空白组比较,模型组小鼠找到平台时间明显增加(P < 0.01),穿过原平台的次数明显减少(P < 0.01),在目标象限停留时间缩短(P < 0.01);与模型组比较,10和20 mg·kg-1 SCP-A组小鼠找到平台时间明显缩短(P < 0.01),穿过平台次数及象限停留时间明显增加(P < 0.01);5 mg·kg-1 SCP-A组小鼠找到平台时间长于10和20 mg·kg-1 SCP-A组(P < 0.01),10 mg·kg-1 SCP-A组小鼠找到平台时间长于20 mg·kg-1 SCP-A组(P < 0.05);10 mg mg·kg-1SCP-A组小鼠的穿越平台次数和目标象限停留时间少于20 mg·kg-1 SCP-A组(P<0.05或P<0.01)。见表 2。
| (n=15, x ±s) | |||
| Group | Time of finding platform(t/s) | Number of passing platform | Dwell time of target quadrant(t/s) |
| Control | 48.67±10.24 | 6.09±1.73 | 54.77±6.24 |
| Model | 102.74±25.03* | 2.10±1.06* | 21.01±5.48* |
| SCP-A | |||
| 5 mg·kg-1 | 89.24±10.95△△ | 3.73±1.41 | 23.65±7.44 |
| 10 mg·kg-1 | 71.49±12.46△# | 4.04±1.26△ | 31.07±7.13△ |
| 20 mg·kg-1 | 57.03±14.20△#▲ | 5.89±1.24△▲ | 44.50±6.53△▲ |
| *P < 0.01 vs control group; △P < 0.01 vs model group;#P < 0.05 vs 5 mg·kg-1 SCP-A group;▲P < 0.05 vs 10 mg·kg-1 SCP-A group. | |||
与空白组比较,模型组小鼠海马组织中Tau-5表达水平明显升高(P < 0.01),Tau蛋白磷酸化位点Tau Ser199、Tau Ser396和Tau Ser404相对表达水平明显升高(P < 0.01);与模型组比较,20 mg·kg-1SCP-A组小鼠脑海马组织中磷酸化蛋白Tau Ser199、Tau Ser396及Tau Ser404表达水平明显降低(P < 0.05)。见图 1。

|
| A: Electrophoregram(Lane 1:Control group; Lane 2:Model group; Lane 3:SCP-A group); B:Tau-5(*P < 0.01 vs conrtol group; △P < 0.05 vs model group); C:p-Tau S199/Tau-5(*P < 0.01 vs conrtol group; △P < 0.05 vs model group); D:p-Tau S396/Tau-5(*P < 0.01 vs conrtol group; △P < 0.05 vs model group); E:p-Tau S404/Tau-5(*P < 0.01 vs conrtol group; △P < 0.05 vs model group). 图 1 Western blotting法检测各组小鼠海马组织中Tau-5、p-Tau Ser S199、Tau Ser S396和Tau Ser S404表达水平 Figure 1 Expression levels of Tau-5, p-Tau Ser S199, Tau Ser S396, and Tau ser S404 in hippocampus tissue of mice in various groups detected by Western blotting method |
|
|
与空白组比较,模型组小鼠海马组织中GSK-3β表达水平明显升高(P < 0.05),磷酸化蛋白GSK-3β Tyr216表达水平明显升高(P < 0.01),磷酸化蛋白GSK-3β Ser9表达水平明显降低(P < 0.01);与模型组比较,20 mg·kg-1 SCP-A组小鼠海马组织中GSK-3β表达水平明显降低(P < 0.01),磷酸化蛋白GSK-3β Tyr216表达水平明显降低,磷酸化蛋白GSK-3β Ser9表达水平明显升高(P < 0.05)。见图 2。
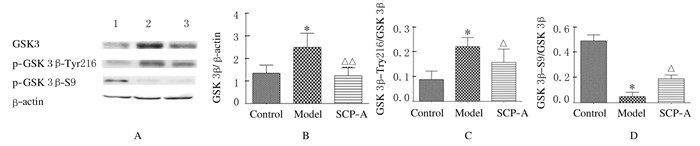
|
| A:Electrophoregram(Lane 1:Control group; Lane 2:Model group; Lane 3:SCP-A group); B: GSK-3β(*P < 0.05 vs conrtol group; △P < 0.01 vs model group); C:p-GSK-3β Tyr216/GSK-3β(*P < 0.01 vs conrtol group; △P < 0.05 vs model group); D:p-GSK-3β S9/GSK-3β(*P < 0.01 vs conrtol group; △P < 0.05 vs model group). 图 2 Western blotting法检测各组小鼠海马组织中GSK-3β,p-GSK-3β Tyr216和S9的表达水平 Figure 2 Expression levels of GSK-3β, p-GSK-3β Tyr216, and S9 in hippocampus tissue of mice in various groups detected by Western blotting method |
|
|
AD是老年期痴呆最常见的类型,临床上主要表现为记忆和认知功能障碍、抽象思维和计算力损害等。随着人口老龄化的不断加重,预测到2050年AD患者将增加到9 000万人[1-2]。可见,抗AD药物的研发刻不容缓。本研究采用的SCP-A北五味子为吉林省长白山地区的道地药材。北五味子多糖是五味子中的主要活性成分,本研究所选用的SCP-A是将上述北五味子总多糖经过DEAE-纤维素离子交换层析柱进一步分离所得的酸性糖产物,本研究旨在观察其抗AD作用,以期为开发抗AD药物提供依据。
研究[6]显示:Aβ沉积是AD发病的中心环节,Aβ的神经毒性作用是导致AD发病的重要病因之一,侧脑室注射Aβ25-35能引起神经细胞变性、突触丢失、学习记忆能力受损等神经系统退化的表现[7]。本研究结果显示:Aβ25-35侧脑室注射后,与空白组比较,小鼠学习记忆能力明显降低,且海马组织中Tau蛋白出现多个位点出现异常磷酸化,相关结果与其他研究[8-11]报道的Aβ25-35构建小鼠AD模型一致。本研究结果表明:无论在避暗实验还是水迷宫实验中,与模型组比较,各剂量SCP-A均表现出显著的学习记忆能力,且随着SCP-A剂量的增加,该作用也逐渐增强,提示SCP-A改善记忆的作用可能存在剂量效应关系。
神经细胞中Tau蛋白过度磷酸化所导致的神经原纤维缠结是AD的主要病理特征之一。Tau蛋白与AD相关的磷酸化位点有Ser199、Ser396和Ser404等。本研究结果显示:20 mg·kg-1 SCP-A可以明显降低AD小鼠海马组织中Tau蛋白Ser199、Ser396、Ser404位点的磷酸化水平,提示其改善记忆作用与其抑制AD小鼠模型脑组织Tau蛋白磷酸化水平密切相关。GSK-3β是参与形成AD样Tau过度磷酸化的最关键的激酶之一,增加GSK-3β表达水平的升高可以导致Tau蛋白过度磷酸化[12]。GSK-3β Ser9位点磷酸化后,GSK-3β活性减低,进而使Tau过度磷酸化程度减低,GSK-3β Ser9位点磷酸化后,GSK-3β活性减低,进而使Tau过度磷酸化程度减低;GSK-3β Tyr216位点磷酸化后,GSK-3β活性增强,Tau过度磷酸化程度增高[13-16]。本研究结果显示:SCP-A可以增加GSK-3β Ser9位点磷酸化,降低GSK-3β Tyr216位点磷酸化蛋白及GSK-3β的表达水平,提示SCP-A能够通过调节GSK-3β活性、降低Tau蛋白多个位点的过度磷酸化,改善其学习记忆能力,而发挥抗AD作用。
综上所述,SCP-A对Aβ所致AD小鼠的学习记忆能力具有改善作用,可降低其海马组织中Tau蛋白磷酸化水平,该作用可能与其调节GSK-3β活性有关。
| [1] | 白娟. 吡格列酮对AD大鼠模型学习记忆及GSK-3β、p-tau蛋白的影响[D]. 太原: 山西医科大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10114-1011092174.htm |
| [2] | Wang HY, Lee DH, D'Andrea MR, et al. beta-Amyloid(1-42) binds to alpha7 nicotinic acetylcholine receptor with high affinity.Implications for Alzheimer's disease pathology[J]. J Biol Chem, 2000, 275(8): 5626–5632. DOI:10.1074/jbc.275.8.5626 |
| [3] | 汪琴. 自主运动影响Aβ25-35对C57/bl6小鼠的神经毒性作用及其机制[D]. 南京: 南京医科大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10312-1015519076.htm |
| [4] | 李宁, 刘聪, 李佳鸿, 等. 五味子淫羊藿混合提取物对东莨菪碱致小鼠学习记忆障碍的改善作用[J]. 吉林大学学报:医学版, 2017, 43(1): 42–46. |
| [5] | 黄清松, 李红枝, 郑敏, 等. 姬松茸粗多糖提高脑老化小鼠学习记忆能力的作用及其机制[J]. 吉林大学学报:医学版, 2014, 40(1): 70–73. |
| [6] | Mozayan M, Lee TJ. Statins prevent cholinesterase inhibitor blockade of sympathetic alpha7-n ACh R-mediated currents in rat superior cervical ganglion neurons[J]. Am J PhysiolHeart Circ Physiol, 2007, 293(3): 1737–1744. DOI:10.1152/ajpheart.00269.2007 |
| [7] | Lee AY, Hwang BR, Lee MH, et al. Perilla frutescens var. japonica and rosmarinic acid improve amyloid-β25-35 induced impairment of cognition and memory function[J]. Nutr Res Pract, 2016, 10(3): 274–281. DOI:10.4162/nrp.2016.10.3.274 |
| [8] | 刘港, 胡增峣, 杨胜, 等. BALB/c和昆明小鼠Aβ侧脑室注射建立阿尔茨海默病小鼠模型比较[J]. 军事医学科学院院刊, 2009, 33(6): 554–557. |
| [9] | 吴婷, 汪琴, 孙建国, 等. 自主性运动对β淀粉样蛋白_(25-35)诱导小鼠神经细胞凋亡及氧化应激水平的影响[J]. 中国临床神经科学, 2013, 21(4): 365–370. |
| [10] | 李纪彤, 齐越, 姜鸿, 等. 温郁金水提物对Aβ(25-35)致阿尔兹海默病小鼠模型行为学的影响[J]. 辽宁中医杂志, 2017, 44(3): 633–636. |
| [11] | 肖弯, 曹晓璐, 张容, 等. 黄芩苷改善Aβ(25-35)诱导的小鼠学习和记忆障碍及可能机制[J]. 中国药理学与毒理学杂志, 2017, 31(1): 59–64. |
| [12] | 杨遥. REM睡眠剥夺对小鼠海马tau蛋白磷酸化的影响[D]. 石河子: 石河子大学, 2013. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sylc201401003&dbname=CJFD&dbcode=CJFQ |
| [13] | Liu SJ, Zhang AH, Li HL, et al. Overactivation of glycogen synthase kinase-3 by inhibition of phosphoinositol-3 kinase and protein kinase C leads to hyperphosphorylation of tau and impairment of spatial memory[J]. J Neurochem, 2003, 87(6): 1333–1344. DOI:10.1046/j.1471-4159.2003.02070.x |
| [14] | Li XH, Lv BL, Xie JZ, et al. AGEs induce Alzheimer-like tau pathology and memory deficit via RAGE-mediated GSK-3 activation[J]. Neurobiol Aging, 2012, 33(7): 1400–1410. DOI:10.1016/j.neurobiolaging.2011.02.003 |
| [15] | Liu ZC, Fu ZQ, Song J, et al. Bip enhanced the association of GSK-3β with tau during ER stress both in vivo and in vitro[J]. J Alzheimers Dis, 2012, 29(4): 727–740. |
| [16] | Cho JH, Johnson GV. Glycogen synthase kinase 3β induces caspasecleaved tau aggregation in situ[J]. J Biol Chem, 2004, 279(52): 54716–54723. DOI:10.1074/jbc.M403364200 |
 2017, Vol. 43
2017, Vol. 43


