扩展功能
文章信息
- 李会敏, 伊焕发
- LI Huimin, YI Huanfa
- 刚地弓形虫肌动蛋白profilin的原核表达和纯化
- Prokaryotic expression and purification of Toxoplasma gondii profilin protein
- 吉林大学学报(医学版), 2017, 43(06): 1109-1114
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1109-1114
- 10.13481/j.1671-587x.20170608
-
文章历史
- 收稿日期: 2017-03-21
2. 吉林大学第二医院检验科, 吉林长春 130041
2. Department of Clinical Laboratory, Second Hospital, Jilin University, Changchun 130041, China
弓形虫是一种专性细胞内寄生的病原体,具有广泛的宿主范围;可感染人和多种动物,引起人兽共患病[1]。弓形虫感染主要分为急性和慢性2个阶段,大多数弓形虫感染的人或动物表现出强烈的细胞介导的免疫反应。宿主通过自然杀伤(natural killer, NK)细胞和T细胞产生的干扰素γ(interferon gamma, IFN-γ)参与宿主抵抗[2-5]。刚地弓形虫肌动蛋白profilin(Toxoplasms gondii profilin protein, TgPRF)是弓形虫入侵机体的一个必需蛋白分子,与其他蛋白聚合形成滑行体,从而有效地穿越机体的生物屏障并进一步入侵宿主细胞。因此破坏TgPRF可阻断弓形虫的滑行运动[6-7]。TgPRF在小鼠的巨噬细胞和树突状细胞(dendritic cells,DCs)中可识别Toll样受体11(Toll-like receptor 11, TLR11)和12,在人类抗体中可识别Toll样受体5(Toll-like receptor 5,TLR5),调控DCs分泌白细胞介素12 (interleukin 12,IL-12)和干扰素α(interferon alpha, IFN-α)及NK细胞分泌的IFN-γ因子,因此profilin蛋白被认为与抗弓形虫免疫有关[8-10]。
CpG岛(Toll样受体9的配体)和单磷酰脂质A (monophosphoryl lipid A,MPL,即Toll样受体4的配体)等Toll样受体的配体作为抗肿瘤佐剂已经进入临床前实验,但TgPRF作为免疫佐剂的研究尚处于起步阶段[11-13]。为进一步研究TgPRF作为免疫佐剂的作用及其相关的抗肿瘤免疫机制,本实验成功构建了重组质粒pET28a-TgPRF并实现了TgPRF的可溶性原核表达,为后续的抗肿瘤免疫佐剂研究奠定了基础。
1 材料与方法 1.1 弓形虫cDNA、质粒和菌种cDNA来源于刚地弓形虫RH株。原核表达质粒pET-28a(+)和大肠埃希菌(E. coli)DH5α由吉林大学第一医院转化医学研究院杨永广实验室保存。Trans1-T1感受态细胞和pEASY®-T5 Zero Cloning Vector购自北京全式金生物技术有限公司。BL21(DE3)购自北京鼎国生物技术有限责任公司。
1.2 主要试剂和仪器限制性内切酶Nco Ⅰ和Xho Ⅰ购自美国Thermo FisherScientific公司,T4 DNA连接酶和质粒提取试剂盒购自美国Promega公司,琼脂糖凝胶回收试剂盒购自上海生工有限公司,异丙基-β-D-硫代半乳糖苷(IPTG)购自美国Sigma公司,Ni Sepharose 4B和SephadexG-25介质购自美国Amersham Pharmacia Biotech公司,DNA marker和标准蛋白质maker购自北京全式金生物技术有限公司,氨苄青霉素和卡那霉素购自美国Amresco公司,小鼠抗多聚组氨酸标签(His-tag)单克隆抗体和辣根过氧化物酶(HRP)标记山羊抗小鼠抗体IgG购自北京全式金生物技术有限公司,化学发光液ECL购自美国Thermo Fisher Scientific公司。高压灭菌锅(日本SANYO公司),电热恒温水箱(上海新苗医疗器械制造有限公司),-80 ℃冰箱(美国Thermo Scientific公司),PCR仪(上海伯乐生命医学产品有限公司),恒温培养摇床(上海一恒科学仪器有限公司),凝胶成像系统(上海伯乐生命医学产品有限公司), 超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.3 PCR引物的设计和合成根据弓形虫肌动蛋白profilin基因编码序列(GenBank: AY937257.1)设计1对引物。上、下游引物分别为F:5′-TCATTC CATGGCCAT-GTCCGACTGGGACCC TG-3′和R:5′-ACT-GACTCGAGG TAC CCAGACTGGTGA AGA-3′, 下划线为酶切位点,并分别设计含有NcoⅠ和XhoⅠ的酶切位点。引物由上海生工生物技术有限公司合成。
1.4 肌动蛋白profilin基因的扩增以合成的cDNA为模板进行PCR反应,反应条件为:98℃、1 min;98℃、10 s,62℃、30 s,72℃、30 s,共30个循环;72℃、10 min延伸。1.2%琼脂糖凝胶电泳分离鉴定。琼脂糖凝胶回收试剂盒回收和纯化PCR产物。
1.5 原核表达质粒的构建 1.5.1 基因片段的TA克隆和测序PCR产物和pEASY®-T5 Zero Cloning Vector连接,连接产物转化入Trans1-T1感受态细胞中,铺板,培养过夜,挑取多个单克隆送公司测序,鉴定阳性重组子。
1.5.2 阳性重组子的鉴定选择形态较好的单克隆接种于含LB/Kan+(50 g·L-1)的5 mL液体培养基中,于37℃剧烈振摇下培养过夜。采用试剂盒小量提取质粒,应用NcoⅠ和XhoⅠ双酶切,鉴定含有profilin基因片段的重组质粒T5-profilin基因。
1.5.3 pET28a-profilin重组质粒的构建和测序将pET28a空质粒和T5-profilin重组质粒用NcoⅠ和XhoⅠ双酶切消化,琼脂糖凝胶回收profilin基因片段及线性化的pET28a(5 369 bp)载体,目的基因TgPRF与载体质粒pET-28a(+)按摩尔比5:1(目的片段:载体)将二者连接、转化入E.coli DH5α感受态细胞,涂布于含卡那抗性(50mg·L-1)的平皿, 37℃孵箱培养12~16 h,挑取单克隆接种于5 mL含卡那抗性(卡那霉素使用浓度为50 g·L-1)的LB培养基中,37℃摇床225 r·min-1,振荡培养12~16 h。试剂盒提取质粒,并采用NcoⅠ和XhoⅠ双酶切处理,电泳鉴定阳性重组质粒。阳性菌液送上海生工生物技术有限公司测序鉴定。同时设pET28a空质粒为阴性对照。
1.6 重组蛋白的表达和纯化 1.6.1 重组蛋白的表达和表达方式的鉴定测序鉴定序列正确后,采用pET28a-profilin重组质粒转化入BL21(DE3)表达菌株,涂布于含卡那抗性(50 mg·L-1)的平皿上, 37℃孵箱培养12~16 h。挑取单克隆接种于20 mL卡那抗性(50 mg·L-1)的LB培养基中,37℃摇床225 r·min-1,振荡培养,当A(600)达0.5~0.8时,留取菌种和1 mL菌液作为诱导前对照。剩余菌液内加入终浓度为0.5 mmol·L-1 IPTG,37℃摇床225 r·min-1诱导表达4 h后,留取1mL诱导后菌液。分别将诱导前与诱导后菌液11 000 r·min-1离心2 min,沉淀用100 μL 1×还原buffer重悬,沸水煮沸10 min,11 000 r·min-1离心5 min,SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定表达产物。
取pET28a-profilin重组质粒在BL21(DE3)菌中诱导后的菌液5 mL离心,沉淀用裂解缓冲液(tris 20 mmol·L-1, NaCL 0.5 mmol·L-1, 咪唑20 mmol·L-1)重悬,放置于小瓶中超声裂菌。裂菌条件为:功率600 W,5 s工作,5 s间歇,超声60次。采用结晶紫染色的方法观察菌体是否经超声裂解完全。如裂菌完全,各取1 mL超声后菌液于2个EP管中,11 000 r·min-1离心30 min。其中一管弃上清,沉淀采用100 μL1×还原buffer重悬;另一管取50 μL上清,加入50 μL 2×还原buffer,沉淀用1 mL超纯水重悬后取50 μL,加入50 μL 2×还原buffer,将电泳的样品煮沸、离心,SDS-PAGE鉴定表达方式。
1.6.2 重组蛋白的纯化重组蛋白表达菌离心后,菌沉淀用裂解缓冲液重悬,采用金属螯合亲和层析法(填料为Ni2+ Saphrose-4B)纯化重组蛋白(柱长30 cm,直径2.5 cm,填料高度10 cm)。葡聚糖凝胶Sephadex G-25为填料进行凝胶过滤除盐(除盐柱柱长100 cm,直径2.5 cm, 填料高度80 cm)。洗脱纯化的蛋白并测定蛋白纯度和浓度(洗脱条件:用平衡缓冲液对Ni2+ Saphrose-4B进行柱平衡,缓慢上样后,加入洗涤缓冲液进行洗涤,洗涤至基线,再加入样品洗脱缓冲液,收集目标蛋白,将收集的目的蛋白流经除盐柱进行除盐)。
1.7 Western blotting法鉴定重组融合蛋白His-profilin的表达将His-profilin蛋白经SDS-PAGE分离、转膜和5%脱脂奶粉封闭等程序后,加入小鼠抗His-tag单克隆抗体(1:5 000)作为一抗,4℃摇动孵育过夜,PBS-T洗涤3次,再加入山羊抗小鼠的HRP-IgG(1:5 000)作为二抗,室温孵育1 h,PBS-T洗涤3次,采用ECL发光液显色并拍照。
2 结果 2.1 肌动蛋白profilin基因的PCR电泳PCR产物经1.2%琼脂糖凝胶电泳结果显示:在约492 bp处有1条特异性扩增条带,其相对分子质量与刚地弓形虫肌动蛋白profilin的cDNA序列大小相符,结合测序结果,证实该片段为TgPRF基因片段。见图 1。
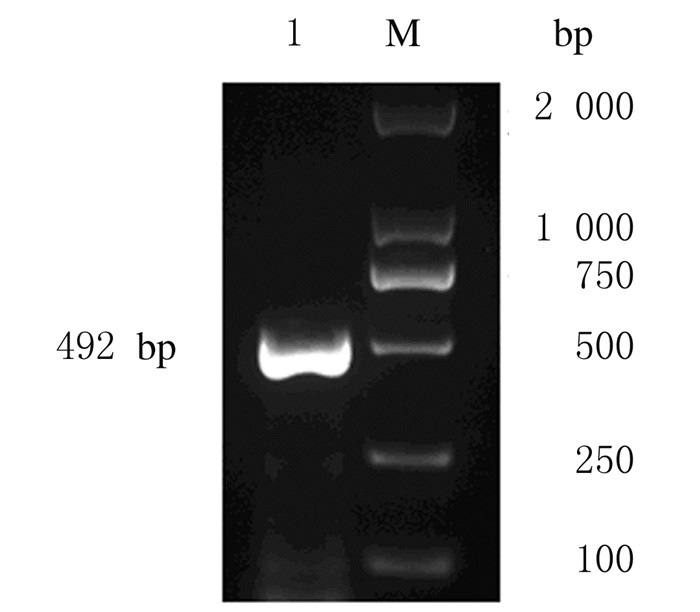
|
| M: DL2 000 DNA marker; Lane 1: TgPRF fragment. 图 1 TgPRF基因片段的琼脂糖凝胶电泳图 Figure 1 Agarose gel electrophorogram of TgPRF gene fragment |
|
|
将pEASY®-T5-profilin重组质粒采用NcoⅠ和XhoⅠ双酶切,所得片段定向亚克隆置入pET28a(+)表达载体中,经转化筛选,挑取几个单克隆菌株,提取质粒,采用NcoⅠ和XhoⅠ双酶切。电泳结果显示,在约5369 bp和492 bp处分别出现条带,与预期结果相符。提取的pET28a-profilin重组质粒送公司测序,测序结果与设计的目的序列完全相同,见图 2。
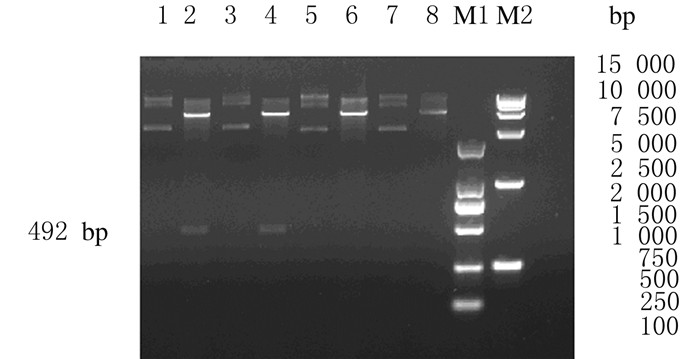
|
| M1: DL2 000 DNA marker; M2: DL15 000 DNA marker; Lane 1, 3: pET28a-profilin; Lane 2, 4: pET28a-profilin digested by NcoⅠand XhoⅠ; Lane 5, 7: pET28a vector (negative control); Lane 6, 8: pET28a vector digested by NcoⅠand XhoⅠ(negative control). 图 2 重组质粒pET28a-profilin的双酶切鉴定的琼脂糖凝胶电泳图 Figure 2 Agarose gel electrophoregram of recombinant plasmid pET28a-profilin identified by double enzyme digestion |
|
|
与诱导前比较,诱导后出现1条相对分子质量约为18 000的蛋白条带(图 3),与预测的蛋白质相对分子质量基本一致,初步证实重组蛋白profilin在大肠杆菌BL21(DE3)中成功表达。应用带His标签的一抗对重组蛋白TgPRF进行Western blotting鉴定,在相对分子质量约为18 000处可见阳性条带,而相应的未插入profilin基因的pET28a空质粒表达菌株诱导4 h后,在18 000条带处未见阳性条带(图 4),进一步证实在大肠杆菌中表达的蛋白即是TgPRF蛋白。SDS-PAGE分析结果显示:重组蛋白主要在超声裂解菌体的上清中表达(图 5),说明重组蛋白TgPRF在大肠杆菌BL21(DE3)中以可溶性形式表达,为可溶性原核表达。

|
| M: Protein marker; Lane 1: Before induction; Lane 2: After induction. 图 3 SDS-PAGE法检测重组蛋白TgPRF表达的电泳图 Figure 3 Electrophoregram of expression of recombinant protein TgPRF detected by SDS-PAGE method |
|
|

|
| Lane 1: Whole proteins of pET28a bacteria without induction(negative control); Lane 2: Whole proteins of pET28a bacteria with induction (negative control); Lane 3: Whole proteins of bacteria without induction; Lane 4: His-profilin. 图 4 Western blotting法检测重组蛋白TgPRF表达的电泳图 Figure 4 Electrophoregram of expression of recombinant protein TgPRF detected by Western blotting method |
|
|
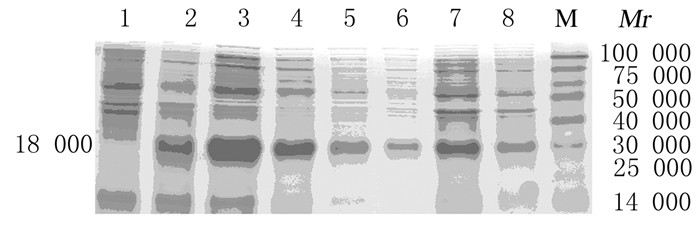
|
| M: Protein marker; Lane 1: Before induction; Lane 2: After induction; Lane 3: Supernatant of induced BL21;Lane 4: Supernatant of induced BL21 (2 fold dilution); Lane 5: Supernatant of induced BL21 (4 fold dilution); Lane 6: Supernatant of induced BL21 (8 fold dilution); Lane 7: Deposition of induced BL21;Lane 8: Deposition of induced BL21 (2 fold dilution). 图 5 SDS-PAGE法检测TgPRF蛋白诱导表达形式的电泳图 Figure 5 Electrophoregram of inducible expression patterns of TgPRF protein detected by SDS-PAGE method |
|
|
超声裂解表达重组蛋白TgPRF的菌体,采用Ni2+-Saphrose-4B金属螯合亲合层析纯化重组蛋白,纯化样品进行SDS-PAGE分析,行考马斯亮蓝染色鉴定(图 6)。纯化蛋白在SDS-PAGE上呈现单一条带,凝胶成像系统软件分析纯化蛋白的纯度大于90%,BCA法测定蛋白浓度为1 g·L-1。说明获得了较好纯度和浓度的目的蛋白。

|
| Protein marker; Lane 1: Precipitation after squeeze and centrifuge; Lane 2: Supernatant liquid after squeeze and centrifuge; Lane 3: Flow through; Lane 4: Washing buffer; Lane 5: Before elution; Lane 6: Elution of post-peak; Lane 7: After elution; Lane 8: Protein samples after demineralization; Lane 9: After induction with 0.5 mmol·L-1 IPTG. 图 6 SDS-PAGE法检测纯化重组蛋白TgPRF表达电泳图 Figure 6 Electrophoregram of expressions of purified recombinant protein TgPRF detected by SDS-PAGE method |
|
|
TgPRF基因突变或缺失将阻碍弓形虫滑动,无法完成对宿主的侵袭和感染,从而影响弓形虫的毒力和对宿主的抗弓形虫免疫。因此profilin蛋白可作为抗弓形虫药物的靶位点或疫苗的候选基因。研究[13]显示:将TgPRF包裹在甘露糖脂质(TgPF-OML)体内,注射给感染弓形虫的C57BL/6小鼠,可明显延长小鼠的生存周期和减小脑部损伤,诱导TgPRF依赖的特异性IFN-γ和抗体IgG的产生,引发强烈的抗弓形虫体液和细胞免疫反应。但是这一过程依赖髓样分化因子88(myeloid differentiation factor 88, MyD88)信号通路和TLR11受体分子。人和猪等动物中并不存在TLR11,在感染弓形虫的猪血清中检测到anti-TgPF抗体,暗示在缺少TLR11的物种中TgPRF的免疫原性被提高,TgPF-OML可能在缺乏TLR11的物种中参与抗弓形虫的感染免疫,但需要更多的科学研究支持。
TgPRF处理的细胞能诱导抗原提呈和适应性T细胞免疫反应,可作为一种新的肿瘤疫苗佐剂[14]。弓形虫感染过程中可通过增加树突状细胞(DCs)、巨噬细胞、自然杀伤细胞(NK)、CD4+和CD8+ T细胞的数量诱导肿瘤免疫反应,通过Th1免疫反应,活化细胞毒性T细胞,减缓肿瘤的生长速度[15-17]。采用分泌的TgPRF抗原治疗B16荷瘤小鼠,可明显减缓肿瘤的生长速度和增加细胞免疫反应[18]。Pyo等[14]应用小鼠结肠癌细胞系的自体整个肿瘤细胞疫苗(autologous whole-tumor-cell vaccine, AWV)模型研究显示:TgPRF可增加抗原提呈分子(如MHCs Ⅰ/Ⅱ)及其共刺激分子受体(CD80和CD86)的表达,诱导抗肿瘤免疫和吞噬作用。TgPRF和AWV共同作用可提高疫苗的效果,减缓肿瘤的生长速度,提高荷瘤者的生存率。但现有的多种抗弓形虫疫苗均受到安全性和保护效力不充分的限制,未能应用于临床。
本实验成功构建了重组质粒pET28a(+)-profilin的原核表达体系,并实现了重组蛋白TgPRF的可溶性表达和高度纯化,为后续的抗肿瘤免疫佐剂研究奠定了基础。
| [1] | Ovciarikova J, Lemgruber L, Stilger KL, et al. Mitochondrial behaviour throughout the lytic cycle of Toxoplasma gondii[J]. Sci Rep, 2017, 7: 42746. DOI:10.1038/srep42746 |
| [2] | Salazar Gonzalez RM, Shehata H, O'Connell MJ, et al. Toxoplasma gondii-derived profilin triggers human toll-like receptor 5-dependent cytokine production[J]. J Innate Immun, 2014, 6(5): 685–694. DOI:10.1159/000362367 |
| [3] | Ge Y, Chen J, Qiu X, et al. Natural killer cell intrinsic toll-like receptor MyD88 signaling contributes to IL-12-dependent IFN-γ production by mice during infection with Toxoplasma gondii[J]. Int J Parasitol, 2014, 44(7): 475–484. DOI:10.1016/j.ijpara.2014.03.004 |
| [4] | Krishnamurthy S, Konstantinou EK, Young LH, et al. The human immune response to Toxoplasma:Autophagy versus cell death[J]. PLoS Pathog, 2017, 13(3): e1006176. DOI:10.1371/journal.ppat.1006176 |
| [5] | Tosh KW, Mittereder L, Bonne-Annee S, et al. The IL-12 response of primary human dendritic cells and monocytes to toxoplasma gondii is stimulated by phagocytosis of live parasites rather than host cell invasion[J]. J Immunol, 2016, 196(1): 345–356. DOI:10.4049/jimmunol.1501558 |
| [6] | Che FY, Madrid-Aliste C, Burd B, et al. Comprehensive proteomic analysis of membrane proteins in Toxoplasma gondii[J]. Mol Cell Proteomics, 2011, 10(1): 1–14. |
| [7] | Alam A, Bhatnagar RK, Relan U, et al. Proteolytic activity of Plasmodium falciparum subtilisin-like protease 3 on parasite profilin, a multifunctional protein[J]. Mol Biochem Parasitol, 2013, 191(2): 58–62. DOI:10.1016/j.molbiopara.2013.09.006 |
| [8] | Koblansky AA, Jankovic D, Oh H, et al. Recognition of Profilin by Toll-like Receptor 12 is Critical for Host Resistance to Toxoplasma gondii[J]. Immunity, 2013, 38(1): 119–130. DOI:10.1016/j.immuni.2012.09.016 |
| [9] | Raetz M, Kibardin A, Sturge CR, et al. Cooperation of TLR12 and TLR11 in the IRF8-dependent IL-12 response to Toxoplasma gondii profilin[J]. J Immunol, 2013, 191(9): 4818–4827. DOI:10.4049/jimmunol.1301301 |
| [10] | Tanaka S, Kuroda Y, Ihara F, et al. Vaccination with profilin encapsulated in oligomannose-coated liposomes induces significant protective immunity against Toxoplasma gondii[J]. Vaccine, 2014, 32(16): 1781–1785. DOI:10.1016/j.vaccine.2014.01.095 |
| [11] | Kramer K, Shields NJ, Poppe V, et al. Intracellular cleavable CpG oligodeoxynucleotide-antigen conjugate enhances anti-tumor immunity[J]. Mol Ther, 2017, 25(1): 62–70. DOI:10.1016/j.ymthe.2016.10.001 |
| [12] | Hanagata N. CpG oligodeoxynucleotide nanomedicines for the prophylaxis or treatment of cancers, infectious diseases, and allergies[J]. Int J Nanomedicine, 2017, 12: 515–531. DOI:10.2147/IJN |
| [13] | Srivastava AK, Yolcu ES, Dinc G, et al. SA-4-1BBL/MPL as a novel immune adjuvant platform to combat cancer[J]. Oncoimmunology, 2016, 5(1): e1064580. DOI:10.1080/2162402X.2015.1064580 |
| [14] | Pyo KH, Lee YW, Lim SM, et al. Immune adjuvant effect of a Toxoplasma gondii profilin-like protein in autologous whole-tumor-cell vaccination in mice[J]. Oncotarget, 2016, 7(45): 74107–74119. |
| [15] | Halonen SK, Weiss LM. Toxoplasmosis[J]. Handb Clin Neurol, 2013, 114: 125–145. DOI:10.1016/B978-0-444-53490-3.00008-X |
| [16] | Yarovinsky F. Innate immunity to Toxoplasma gondii infection[J]. Nat Rev Immunol, 2014, 14(2): 109–121. DOI:10.1038/nri3598 |
| [17] | Engel MA, Neurath MF. Anticancer properties of the IL-12 family--focus on colorectal cancer[J]. Curr Med Chem, 2010, 17(29): 3303–3308. DOI:10.2174/092986710793176366 |
| [18] | Rankin EB, Yu D, Jiang J, et al. An essential role of Th1 responses and interferon gamma in infection-mediated suppression of neoplastic growth[J]. Cancer Biol Ther, 2003, 2(6): 687–693. |
 2017, Vol. 43
2017, Vol. 43


