扩展功能
文章信息
- 王雪, 秦瑞, 王皓莹, 高守阳, 兰彦方, 田秀娟
- WANG Xue, QIN Rui, WANG Haoying, GAO Shouyang, LAN Yanfang, TIAN Xiujuan
- 乳胞素联合卡铂对卵巢癌SKOV3细胞的增殖抑制作用和促凋亡作用
- Inhititory effect of proliferation and promotion effect of apoptosis of lactacystin combined with carboplatin on ovarian cancer SKOV3 cells
- 吉林大学学报(医学版), 2017, 43(06): 1098-1102
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1098-1102
- 10.13481/j.1671-587x.20170606
-
文章历史
- 收稿日期: 2017-07-03
卵巢癌是妇科三大恶性肿瘤之一,死亡率高,近年来发病率呈明显升高趋势, 严重威胁女性的健康。除手术治疗外,化疗是卵巢癌主要的治疗方法,但是,传统化疗药物易产生耐药,毒副作用大,使其应用受到了一定程度的限制。乳胞素(lactacystin, LAC)是一种蛋白酶体抑制剂,能够抑制泛素-蛋白酶体通路,从而阻断某些蛋白质的降解,促进细胞凋亡,对多种恶性肿瘤具有明显的抑制作用[1],但其对卵巢癌作用的研究国内外报道较少,本研究采用LAC和(或)卡铂在体外作用于卵巢癌SKOV3细胞,探讨其对SKOV3细胞的增殖抑制作用和对细胞凋亡的影响,阐明LAC及其与卡铂联合应用对卵巢癌SKOV3细胞的作用机制,为临床卵巢癌的治疗提供依据。
1 材料与方法 1.1 细胞株、主要试剂和仪器卵巢癌SKOV3细胞株和LAC均由吉林大学基础医学院药理学教研室提供。SKOV3细胞置于5 %CO2培养箱中37℃培养,并隔日传代1次。四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)购自美国Sigma公司, 胰酶和IMDM培养基购自美国Hyclone公司,新生小牛血清购自杭州四季青生物材料有限公司,卡铂(批号:BB2J7004)由齐鲁制药有限公司生产。选取处于对数生长期的SKOV3细胞用于实验。将LAC采用DMSO溶液配成1 μmol·L-1的储存液, -20℃避光保存,使用前加入培养基RPMI 1640配制所需的实验浓度[2]。全自动显微镜数码摄像系统、全自动显微镜光学摄像系统和相差显微镜均购自日本OLYMPUS公司,流式细胞仪购自美国BD公司。
1.2 MTT比色法检测SKOV3细胞的增殖抑制率将SKOV3细胞接种于96孔培养板,密度为5× 104 mL-1 ,培养24 h,分别加入0、2.5、5.0、10.0和20.0 μmol·L-1 LAC继续培养48 h,测定各组细胞增殖抑制率,计算LAC的半数抑制浓度(IC50)。取5 μmol·L-1 LAC干预SKOV3细胞, 分别作用0、12、24、48和72 h,观察LAC作用不同时间时SKOV3细胞的增殖抑制率。另将细胞分为对照组(细胞不经药物干预)、LAC组(加入终浓度为5 μmol·L-1 LAC)、不同浓度卡铂组(分别加入终浓度为10、20、40及80 μmol·L-1卡铂)和LAC联合不同浓度卡铂组(分别加入5 μmol·L-1 LAC和10、20、40、80 μmol·L-1卡铂)。各组细胞培养48 h后,每孔加入20μL MTT作用4 h,弃去上清, 每孔再加入150μL DMSO, 采用酶标测试仪测定490 nm处吸光度(A)值, 计算各组细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%[2]。同时计算卡铂和卡铂联合5 μmol·L-1LAC作用SKOV3细胞48 h时的IC50。每组重复6孔, 实验重复3次[2]。
1.3 流式细胞术(FCM)检测SKOV3细胞的凋亡率将SKOV3细胞接种于6孔培养板, 密度为5× 104 mL-1 ,培养24 h,弃去培养液后加入5 μmol·L-1LAC, 分别作用0、12、24、48和72 h。另将SKOV3细胞分为4组:对照组(细胞不经药物干预);LAC组(加入终浓度为5 μmol·L-1LAC);卡铂组(加入终浓度为20 μmol·L-1卡铂)和LAC联合卡铂组(加入5 μmol·L-1LAC和20 μmol·L-1卡铂)。各组细胞培养48 h后,分别收集1×106个细胞, 75 %冷乙醇固定, 4℃过夜。弃上清后用PBS漂洗2次, 加入80μL RNase (终浓度为50 mg·L-1)和150 μL PI(终浓度为50 mg·L-1), 混匀, 室温避光反应30 min, 采用FCM检测各组细胞凋亡率, 采用MultyCycle软件进行分析,实验重复3次。
1.4 统计学分析采用SPSS 16.5统计软件进行统计学分析。各组细胞增殖抑制率和凋亡率均以x ±s表示,组间比较采用t检验, 多组间两两比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组SKOV3细胞的增殖抑制率 2.1.1 LAC的IC500、2.5、5.0、10.0和20.0 μmol·L-1 LAC作用48 h后, SKOV3细胞增殖抑制率分别为0、(32.98±3.51)%、(42.38± 3.87)%、(60.39±4.59)%和(82.37±3.29)%,随着LAC浓度的增加,SKOV3细胞增殖受到明显抑制, LAC作用48 h时IC50为5.36 μmol·L-1。
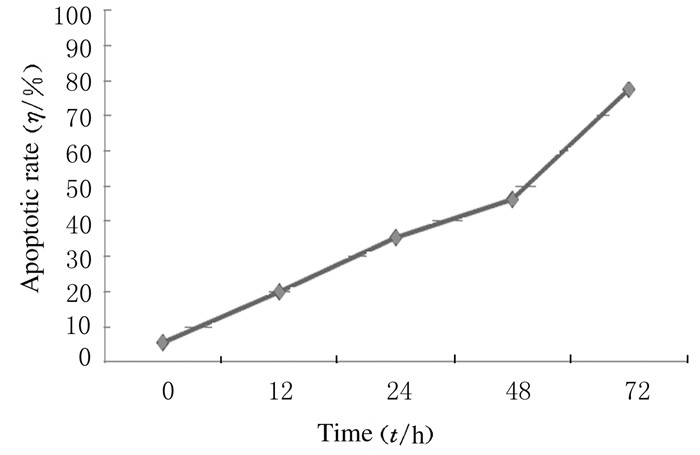
2.1.2 LAC作用不同时间各组SKOV3细胞的增殖抑制率5 μmol·L-1 LAC作用于SKOV3细胞0、12、24、48和72 h后,细胞增殖抑制作用随着药物作用时间的延长而明显增强,12、24、48和72 h时细胞增殖抑制率分别为(25.24±3.46)%、(39.23±4.27)%、(42.38±3.87)%和(79.44±3.09)%。
2.1.3 LAC联合卡铂作用48 h各组SKOV3细胞增殖抑制率卡铂单独作用于SKOV3细胞48 h时的IC50为58.08 μmol·L-1; 当卡铂与5 μmol·L-1 LAC联合作用时, 其IC50为18.37 μmol·L-1。与相同浓度卡铂组比较,LAC联合卡铂组SKOV3细胞增殖抑制率差异均有统计学意义(P < 0.05)。见表 1。
| (n=6, x ±s, η/%) | |
| Group | Inhibitory rate of proliferation |
| Carboplatin(μmol·L-1) | |
| 10 | 13.28±3.12 |
| 20 | 27.44±2.67 |
| 40 | 49.31±3.05 |
| 80 | 69.58±2.99 |
| LAC and carboplatin(μmol·L-1) | |
| 5+10 | 42.41±3.25* |
| 5+20 | 53.84±2.67△ |
| 5+40 | 75.42±3.74# |
| 5+80 | 92.02±3.86 |
| *P < 0.05 compared with 10 μmol·L-1 corboplatin group; △P<0.05 compared with 20 μmol·L-1 carboplatin group; #P<0.05 compared with 40 μmol·L-1 carboplatin group. | |
5μmol·L-1 LAC干预SKOV3细胞24 h即观察到凋亡亚二倍体峰, 且随着作用时间的延长,细胞凋亡率明显升高。24、48和72 h时细胞凋亡率[(35.17±3.05)%、(46.05±3.22)%、(77.35±6.51)%]明显高于0和12 h时的细胞凋亡率[(5.28 ±2.44)%、(19.72±4.63)%](P < 0.05)。见图 1和2。

|
| A:Control group; B-E: 5 μmol·L-1 LAC group; B:12 h; C:24 h; D: 48 h; E: 72 h. 图 1 FCM检测各组SKOV3细胞凋亡率示意图 Figure 1 Schematic diagram of apoptotic rates of SKOV3 cells detected by FCM |
|
|
|
| 图 2 LAC不同作用时间时SKOV3细胞凋亡率 Figure 2 Apoptotic rates of SKOV3 cells after treated with LAC for different time |
|
|
与对照组[(6.28±2.02)%]比较,LAC联合卡铂组和LAC组SKOV3细胞凋亡率[(70.32±3.12)%和(46.05±3.22)%]明显升高(P < 0.05);卡铂组SKOV3细胞凋亡率[(19.93±3.12)%]与对照组比较差异无统计学意义(P>0.05)。与LAC组和卡铂组比较,LAC联合卡铂组SKOV3细胞凋亡率明显升高,差异有统计学意义(P < 0.05)。
3 讨论LAC是蛋白酶体抑制剂中的一种,具有高度特异性和不可逆性,能够抑制真核细胞中的内源性蛋白质选择性降解途径(泛素-蛋白酶体通路)[3],蛋白酶体抑制剂正是通过抑制泛素-蛋白酶体系统的正常生理代谢过程,使许多与细胞周期运转和细胞自发凋亡等过程相关的功能蛋白无法正常降解而在细胞内大量聚集,进而影响细胞周期、基因转录、抗原提呈和凋亡调控等一系列细胞活动,阻断这一通路能够通过上调caspase-3、Bax的表达和下调Bcl-2、NF-κB等细胞损伤中相关信号的表达进而促使肿瘤细胞发生凋亡[4-7]。近年来研究[8-9]表明:蛋白酶体抑制剂对多种肿瘤具有明显的抑制作用,如多发性骨髓瘤、宫颈癌、肺癌、喉癌和恶性黑素瘤等。但其具体机制目前尚不十分明确,尤其对于卵巢癌的研究仍然处于起步阶段。国外研究[10-12]报道:原癌基因的表达产物C-Jun在经过泛素-蛋白酶体途径裂解后,可对调节转录因子AP-1的生物学活性产生影响,临床上卵巢癌对铂类药物的耐药性的原因之一就是AP-1活性的增加,应用蛋白酶体选择性抑制剂LAC作用于耐药的卵巢癌细胞,可以使耐药性产生逆转,明显增加铂类对卵巢癌耐药细胞的药物敏感性。
本研究结果表明:LAC能够体外抑制SKOV3细胞增殖, 并诱导其凋亡。本研究中,LAC作用于SKOV3细胞24 h后,即可出现凋亡亚二倍体峰, 且细胞凋亡率随着LAC作用时间的延长而明显升高。卡铂是卵巢癌化疗的一种常用药物, 但长期应用尤其对于复发型卵巢癌患者容易产生耐药[13-14]。本研究中FCM检测结果显示:LAC与卡铂联合应用后细胞凋亡率明显高于两药单独应用,呈现明显的凋亡亚二倍体峰, 因此证实了LAC可以明显增强卡铂对卵巢癌SKOV3细胞的抑制作用,能明显增加卡铂对恶性肿瘤的杀伤作用,这样在保证治疗效果的同时,便可以适当减少化疗药物的剂量,进而减轻药物的毒副作用[15-16], 为临床上卵巢癌的治疗提供了新的理论基础和治疗策略。
| [1] | Dou QP, Zonder JA. Overview of proteasome inhibitor-based anti-cancer therapies:perspective on bortezomib and second generation proteasome inhibitors versus future generation inhibitors of ubiquitin-proteasome system[J]. Curr Cancer Drug Targets, 2014, 14(6): 517–536. DOI:10.2174/1568009614666140804154511 |
| [2] | 王雪, 张婷婷, 马峰, 等. Lactacystin及联合顺铂对子宫颈癌Hela细胞株的影响[J]. 中国妇产科临床, 2016, 17(2): 162–164. |
| [3] | Hirosawa Y, Ito-Inaba Y, Inaba T. Ubiquitin-proteasome -dependent regulation of bidirectional communication between plastids and the nucleus[J]. Front Plant Sci, 2017, 8: 310. |
| [4] | Kashyap T, Argueta C, Aboukameel A, et al. Selinexor, a selective inhibitor of nuclear export (SINE) compound, acts through NF-κB deactivation and combines with proteasome inhibitors to synergistically induce tumor cell death[J]. Oncotarget, 2016, 7(48): 78883–78895. |
| [5] | Ye X, Di L, Lin CZ, et al. Proteasome inhibitor lactacystin enhances cisplatin cytotoxicity by increasing endoplasmic reticulum stress-associated apoptosis in SKOV3 cells[J]. Mol Med Rep, 2015, 11(5): 189–195. |
| [6] | 王喆, 袁霞, 葛泽梅, 等. 新型蛋白酶体抑制剂YSY-01A诱导PC-3M细胞自噬的作用[J]. 中国药学:英文版, 2014, 23(8): 565–571. |
| [7] | Tanaka Y, Nonaka T, Suzuki G, et al. Gain-of-function profilin 1 mutations linked to familial amyotrophic lateral sclerosis cause seed-dependent intracellular TDP-43 aggregation[J]. Hum Mol Genet, 2016, 25(7): 1420–1433. DOI:10.1093/hmg/ddw024 |
| [8] | Cron KR, Zhu K, Kushwaha DS, et al. Proteasome inhibitors block DNA repair and radiosensitize non-small cell lung cancer[J]. PLoS One, 2013, 8(9): e73710. DOI:10.1371/journal.pone.0073710 |
| [9] | Khaled YO, Mohamed SA, Khalid AE, et al. Selective growth inhibition of human malignant melanoma cells by syringic acid-derived proteasome inhibitors[J]. Cancer Cell Int, 2013, 13(6): 80–84. |
| [10] | Dick LR, Fleming PE. Building on bortezomib:Second-generation proteasome inhibhors as anti-cancer therapy[J]. Drug Discovery Today, 2010, 15(5/6): 243–249. |
| [11] | Li QQ, Yunmbam MK, Zhong X, et al. Lactacystin emhances cisplatin sensitivity in resistant human ovarian cancer cell lines via inhibition of DNA repair and ERCC-1 expression[J]. Cell Mol Biol, 2001, 47: 61–72. |
| [12] | Inobe T, Genmei R. Inhibition of the 26S proteasome by peptide mimics of the coiled-coil region of its ATPase subunits[J]. Biochem Biophys Res Commun, 2015, 468(1/2): 143–150. |
| [13] | Teschendorff AE, Lee SH, Jones A, et al. HOTAIR and its surrogate DNA methylation signature indicate carboplatin resistance in ovarian cancer[J]. Genome Med, 2015, 7: 108. DOI:10.1186/s13073-015-0233-4 |
| [14] | Wen Q, Shao Z, Zhang P, et al. Mental distress, quality of life and social support in recurrent ovarian cancer patients during active chemotherapy[J]. Eur J Obstet Gynecol Reprod Biol, 2017, 216: 81–95. |
| [15] | Yokoyama T, Katsumata NI. Current Topics of Chemotherapy for Ovarian Cancer[J]. Gan To Kagaku Ryoho, 2017, 44(2): 123–125. |
| [16] | 薛景戈, 任琛琛, 杨立, 等. 卵巢上皮性癌组织中IGF-1、E-cad蛋白的表达以及IGF-1对卵巢癌SKOV3细胞E-cad表达和侵袭力的影响[J]. 郑州大学学报:医学版, 2016, 51(3): 396–401. |
 2017, Vol. 43
2017, Vol. 43


