扩展功能
文章信息
- 车鹏程, 车轩, 李硕峰, 张亚彬, 熊艳杰, 崔曼, 崔菁, 姚芳莲, 孙红
- CHE Pengcheng, CHE Xuan, LI Shuofeng, ZHANG Yabin, XIONG Yanjie, CUI Man, CUI Jing, YAO Fanglian, SUN Hong
- PVA/ι-CA软骨组织工程支架对ATDC-5细胞生物学行为和组织相容性的影响
- Effect of cartilage tissue engineering scaffolds PVA/ι-CA on biological behavior and biocompatibility of ATDC-5 cells
- 吉林大学学报(医学版), 2017, 43(06): 1092-1097
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1092-1097
- 10.13481/j.1671-587x.20170605
-
文章历史
- 收稿日期: 2017-01-04
2. 湖南师范大学医学院医学检验学系, 湖南 长沙 410006;
3. 天津大学化工学院 高分子科学与工程系, 天津 300072;
4. 华北理工大学附属医院病理科, 河北 唐山 063210
2. Department of Medical Laboratory Technology, School of Medical Sciences, Hunan Normal University, Changsha 410006, China;
3. Department of Polymer Science and Engineering, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;
4. Department of Pathology, Affiliated Hospital, North China University of Science and Technology, Tangshan 063210, China
成熟的关节软骨缺少血供,软骨细胞在无血运环境中不能迁徙,关节软骨损伤后缺乏自愈能力,目前临床上的治疗方法均有其局限性[1]。组织工程是一门新兴的生物技术,为关节软骨修复提供了新的思路[2]。在各种关节软骨修复替代材料中,聚乙烯醇(polyvinyl alcohol,PVA)水凝胶较为理想,因为其物理性质十分接近人体组织[3],进行关节软骨置换有一定的修复效果,但是存在松动和错位的缺点[4]。通过表面改性将活性聚合物添加到PVA水凝胶体系中能够提高其活性。本研究以PVA为基材,采用复合天然多糖卡拉胶对其共混改性,利用天然多糖优异的生物相容性,改善复合材料的生物活性。通过细胞与材料复合培养法和皮下植入试验评价其组织相容性,并为进一步修复软骨缺损的研究提供理论依据。
1 材料与方法 1.1 动物、细胞、主要试剂和仪器10周龄雄性SD大鼠,由华北理工大学动物实验中心提供,许可证编号:SCXK京2004-0004。ATDC-5细胞由河北省慢性病重点实验室保存。胎牛血清和DMEM/F-12培养基(美国Gibco公司),DAPI、MTT(美国Sigma公司),Ⅱ型胶原(北京博奥森生物技术有限公司),PV6001免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),甲苯胺蓝和Masson、Van Gieson染色液(珠海贝索生物技术有限公司)。Hitachi S-4800扫描电镜(SEM, 日本Tokyo公司),Bio-Rad680酶标仪(美国Bio-Rad公司)。
1.2 PVA/ι-CA支架材料的制备支架材料由天津大学化工学院制备,通过物理共混技术和反复冷冻-解冻方法,将PVA和卡拉胶按照卡拉胶质量分数30%的比例制作成复合支架材料,厚0.5 cm,直径1 cm,60Co照射消毒备用。SEM下观察并分析其孔径和孔隙率。
1.3 ATDC-5细胞与支架材料共培养复苏ATDC-5细胞,加入含10%FBS的DMEM/F-12培养基,置于37℃、5%CO2培养箱中,隔天换液1次,待细胞融合约铺满80%时,传代培养,弃培养液,PBS冲洗2次,0.25%胰酶消化、计数,将ATDC-5细胞以2×108mL-1的密度接种于支架材料上,每2 d更换培养基。于接种后7、14、21和28 d取材、固定、包埋。HE染色观察ATDC-5细胞的形态、生长情况,免疫组织化学和免疫荧光染色观察ATDC-5细胞的Ⅱ型胶原蛋白表达情况,甲苯胺蓝染色观察ATDC-5细胞蛋白多糖成分表达情况。同期标本以2.5%戊二醛固定、脱水、干燥、喷金,SEM下观察细胞生长和细胞外基质(ECM)分泌情况。将ATDC-5细胞分为阴性对照组(空白培养液)和实验组(含材料的培养液),在预设的时间点,吸出培养基,并加入MTT溶液后,将细胞培养板放置于培养箱中孵育4 h。吸去培养基,用PBS冲洗1次,每孔加入150μL二甲基亚砜(DMSO)。每孔取出100μL溶液转移至96孔酶标板,使用酶标仪测定570 nm处溶液的吸光度(A)值。ATDC-5细胞增殖率=(实验组A值-对照组A值)/对照组A值×100%。
1.4 皮下植入实验观察雄性SD大鼠16只,麻醉、备皮、铺无菌孔巾,在背部正中线左右各埋入材料1枚,术后3 d常规消炎治疗,单笼饲养。术后7、14、21和28 d分别取材,大体观察包埋后大鼠反应情况。标本固定,包埋、常规、Masson’ s Trichrome染色和Van Gieson染色观察大鼠体内成纤维细胞、血管内皮细胞在支架材料上的生长情况,炎症细胞的反应,以评价支架材料的组织相容性。
1.5 统计学分析采用SPSS17.0统计软件进行统计学分析。各组ATDC-5细胞增殖率以x ±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 SEM下PVA/ι-CA支架材料内部结构SEM分析PVA/ι-CA支架材料内部具有互相连通的孔结构,样品的孔隙率为(86.88±3.88)%,可以观察到20~40 μm的孔径,这正是适合种子细胞向支架材料内部生长的尺寸,同时PVA/ι-CA复合支架材料孔径内部具有网状结构。
2.2 HE染色观察支架材料上ATDC-5细胞形态表现ATDC-5细胞与支架材料共培养7 d后,细胞在支架材料上生长良好,呈多角形,胞质均质状,形态饱满。14~21 d,细胞增殖明显,材料表面可见大量细胞黏附呈层状,至28 d材料内部亦可见聚集呈团状的细胞,细胞团中有基质分泌。见图 1(插页二)。
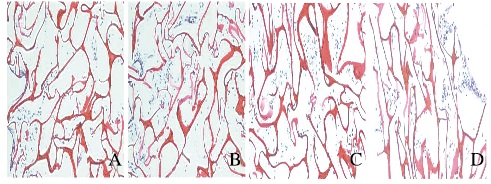
|
| A-D:7, 14, 21, and 28 d. 图 1 PVA/ι-CA支架材料上ATDC-5细胞形态表现(HE,×200) Figure 1 Morphology of ATDC-5 cells on PVA/ι-CA composite scaffold material(HE, ×200) |
|
|
共培养7和14 d后,可见细胞胞浆呈棕黄色,细胞与材料共培养21~28 d时,ATDC-5细胞分泌Ⅱ型胶原,免疫组织化学染色阳性,可见细胞胞浆呈棕黄色,细胞生长密集的地方棕色较深,且细胞外也可见棕色颗粒。见图 2(插页二)。
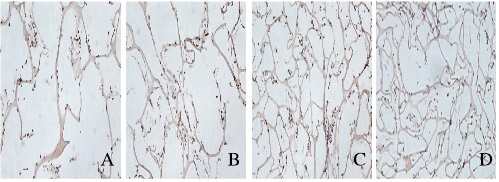
|
| A-D:7, 14, 21, and 28 d. 图 2 PVA/ι-CA支架材料上ATDC-5细胞中Ⅱ型胶原的表达(免疫组织化学,×200) Figure 2 Expressions of type Ⅱ collagen in ATDC-5cells on PVA/ι-CA composite scaffold material (Immunohistochemistry, ×200) |
|
|
Ⅱ型胶原的FITC免疫荧光染色可见ATDC-5细胞浆阳性表达绿色荧光;同时用DAPI复染细胞核,呈现蓝色荧光;与DAPI核染色重合。随着培养时间的延长,支架材料上阳性细胞数量明显增加。且细胞形态饱满,与支架材料结合紧密。见图 3(插页二)。
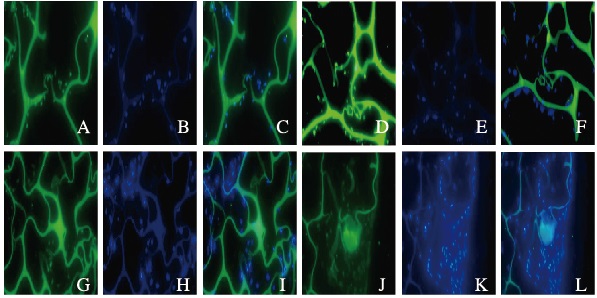
|
| A-C:7 d; D-F:14 d; G-I:21 d; J-L:28 d; A, D, G, J:Type Ⅱ collagen; B, E, H, K:Nucleus marked by DAPI; C, F, I, L:Mixed photos of type Ⅱ collagen and nucleus. 图 3 PVA/ι-CA支架材料上ATDC-5细胞中Ⅱ型胶原的表达(免疫荧光,×400) Figure 3 Expressions of type Ⅱcollagen in ATDC-5cells on PVA/ι-CA composite scaffold material (Immunofluorescence, ×400) |
|
|
与支架材料共培养的ATDC-5细胞胞浆呈紫红色,胞核呈深蓝色,且随培养时间的延长,细胞数量增加明显。见图 4(插页二)。
|
| A:7 d; B:14 d; C:21 d. 图 4 PVA/ι-CA支架材料上ATDC-5细胞形态表现(甲苯胺蓝,×200) Figure 4 Morphology of ATDC-5 cells on PVA/ι-CA composite scaffold material(Toluidine blue, ×200) |
|
|
ATDC-5细胞与支架材料共培养7 d时,可见少量细胞呈多角形;14 d时细胞数量增多,且形态饱满、相互融合,并伸出伪足状细长突起,伸入材料间,形成锚状结构,牢固地黏附于材料表面。随着培养时间的延长,细胞密度明显增加,21~28 d时通过材料网状孔隙观察,材料上附着的细胞分泌大量的细胞外基质(ECM)包裹材料。见图 5。
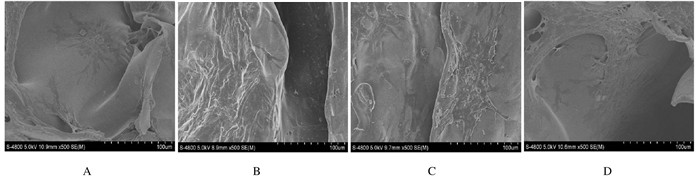
|
| A:7 d; B.14 d; C:21 d; D:28 d. 图 5 SME下观察PVA/ι-CA支架材料上ATDC-5细胞形态表现(Bar=100 μm) Figure 5 Morphology of ATDC-5 cells on PVA/ι-CA scaffold material under SEM(Bar=100 μm) |
|
|
ADTC-5细胞呈现明显增长趋势,7~14 d增殖较快,21~28 d增殖较慢,实验组和对照组细胞增殖率比较差异无统计学意义(P>0.05)。见表 1。
| (n=3, x ±s, η/%) | |||||
| Group | Proliferative rate of ADTC5 cells | ||||
| (t/d) | 7 | 14 | 21 | 28 | |
| Negative control | 26.8±0.60 | 65.40±1.90 | 89.3±0.80 | 96.5±0.90 | |
| Experimental | 22.5±2.70 | 6.00±0.83 | 85.3±0.83 | 91.2±18.6 | |
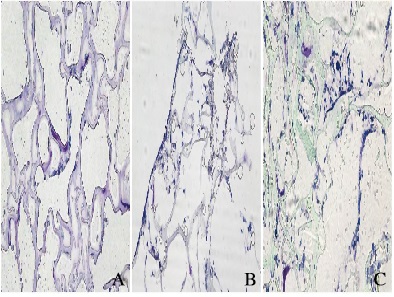
大体标本观察:所有大鼠切口愈合良好,无感染现象。分别在术后1、2、3和4周以过量麻醉药分次注射,使动物深度麻醉,在背部原切口部位切开皮肤,发现多数材料无移位,在材料周围1 cm处整块切下组织,在包埋部位未发现感染、积液及材料碎裂现象。术后1周,材料完整,易于剥离;术后2周,分离后材料表面可见细小出血点;术后3周,材料表面可见少数毛细血管;术后4周,材料与组织粘连紧密,不易剥离,血管较之前增多。皮下包埋后1、2、3和4周后病理学染色观察:①HE染色,胶原纤维呈伊红色, 细胞核呈蓝色;②Masson’ s Trichrome染色,胶原纤维呈蓝色, 细胞核呈黑蓝色;③Van Gieson染色,胶原纤维呈红色,细胞核呈蓝色。术后1周时无组织坏死现象,可见细胞向材料边缘长入,并有少量的中性粒细胞、淋巴细胞散在分布,未见明显的巨噬细胞、多核巨细胞(图 6A~C,见插页三);术后2周时组织细胞逐渐长入材料深部,炎性细胞减少,新生的血管和成纤维细胞长入(图 6D~F,见插页三);术后3周时部分材料内部充满成纤维细胞、毛细血管,并可见多核巨细胞及淋巴细胞(图 6G~I,见插页三);术后4周时材料的微孔状结构未消失,但间隙出现纤细的胶原纤维,排列较规律,可见较多血管(图 6J~L,见插页三)。
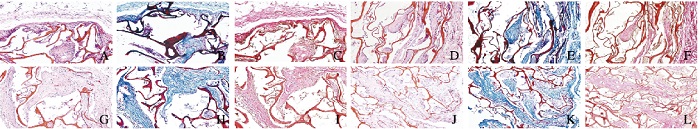
|
| A-C:1 week after operation; D-F:2 weeks after operation; G-I:3 weeks after operation; J-L:4 weeks after operation; A, D, G, J:HE; B, E, H, K:Masson's Trichrome; C, F, I, L:Van Gieson. 图 6 术后支架材料和组织的相容性(×200) Figure 6 Compatibility of composite scaffold material and tissue after operation(×200) |
|
|
理想的三维支架材料应该仿生细胞外基质的生理环境,进而促进和维持细胞的表型和功能。PVA主链连接大量的羟基,主要通过与醋酸乙烯酯聚合后再水解得到。PVA水凝胶具有粘弹性,无毒,力学性能高且加工过程简单,在生物医药领域有广泛的应用,比如伤口敷料、口服药物和组织工程[5-7]。本实验采用物理交联制备PVA水凝胶,不需要添加任何化学试剂,无毒性,所得到的水凝胶力学强度优异,并且得到的PVA水凝胶的力学强度与人体的关节软骨及其相似,因此该凝胶在软骨组织工程领域有重要的应用价值。
但与其他合成水凝胶类似,PVA水凝胶缺乏固有的识别位点以吸附蛋白,因此与细胞之间的相互作用较差,目前有很多研究通过化学改性或者物理共混的方法提高PVA水凝胶的生物活性。这样既可以保持PVA水凝胶自身良好的力学强度,又能增加PVA水凝胶的活性位点,有利于细胞的黏附和增殖,从而提高其生物应用领域的范围。
藻类多糖卡拉胶是一种红藻提取物,对于卡拉胶水凝胶的研究主要集中在药物递送、酶固定以及制药领域[8]。另外卡拉胶广泛应用于动物模型的抗感染研究,可以用来确定感染过程中的分子和细胞媒介和测试抗感染治疗的效果[9]。卡拉胶具有良好的生物活性,其骨架结构与天然细胞外基质成分硫酸软骨素十分相似,从仿生角度出发,可以从组分上模拟细胞生存的微环境[10-11]。在长期的细胞培养过程中,卡拉胶体系可以促进多种细胞的成活和增殖,可以很好地促进封装细胞的生长和分化[12]。与此同时卡拉胶还具有促进细胞产生有序的细胞外基质的能力。上述结果表明:软骨组织工程支架材料中加入卡拉胶成分有益于促进三维细胞的培养,从而应用于软骨组织修复领域中。
卡拉胶与蛋白质反应是通过其所带硫酸基团和蛋白质分子上的荷电离子发生的离子反应,因此具有一定的蛋白吸附能力,可以吸附一些特殊的氨基酸序列,促进细胞的黏附及生长。因此,藻类多糖卡拉胶组分的加入可以明显改善材料的生物活性,提高细胞的黏附和增殖活性。
本实验将PVA水凝胶与卡拉胶复合构建适合软骨细胞生长的三维复合材料。细胞复合支架材料修复骨缺损的必要条件之一是细胞能够很好地黏附在支架材料上并且能够有效地增殖和分化,这要求支架材料具有很好的生物相容性,对细胞无毒害作用[13-14]。该支架材料具有大小合适的孔径、较高的孔隙率和类似自然骨的连通微孔结构,这些网状结构增加了材料的拓扑结构,利于细胞的黏附生长、营养物质的渗入和废物的排出,并促进细胞在材料上的迁移和增殖。
本研究通过将ATDC-5细胞与PVA/ι-CA复合材料共培养,直接观察细胞的贴附生长和增殖情况,细胞在材料上生长良好,分布均匀,结合牢固,无排斥反应发生。免疫组织化学和免疫荧光染色,一方面可以检测细胞的功能性,另一方面可以观察ECM的成分及其在支架中的空间分布情况。本研究中,ATDC-5细胞与支架材料共培养过程中,可见细胞胞浆棕黄色阳性信号逐渐增多,表明ATDC-5细胞分泌软骨细胞特定的标志物;支架中细胞外基质成分呈现出甲苯胺蓝阳性染色,表明ATDC-5细胞分泌了软骨细胞特有的蛋白多糖成分;SEM检测结果表明:复合材料不仅适合细胞的存活和增殖,而且可以引导内部种植细胞的行为,维持细胞的活力和表型,细胞均能够分泌细胞外基质。本研究结果表明:PVA/ι-CA复合材料具有适合细胞生长的微环境,该材料适合种子细胞的停泊、生长、黏附和增殖。
体内植入实验将复合材料植入大鼠背部皮下,可以从宏观和微观水平评价材料对组织的局部反应,包括早期的炎症反应和后期血管化及纤维增生情况[15-16]。Masson’ s Trichrome和Van Gieson染色结果表明:埋植1周后,支架周围形成较薄的纤维组织包裹,将支架与周围组织结合在一起。随着埋植时间的延长,更多成纤维细胞浸入支架生长,并产生大量的胶原纤维,说明了进入支架的细胞能够正常分泌细胞外基质,保持良好的细胞活力及功能性,体现了支架具有很好的生物相容性。影响复合支架材料血管化的因素主要包括支架材料的结构和性质、促进血管形成的生长因子以及其所处的局部环境等。该材料引起体内的炎症反应轻微且持续时间很短,2周左右即明显缓解,在3~4周可见大量新生血管的形成,表现出良好的组织相容性,复合支架能够与周围组织进行很好的融合,能够引导宿主细胞的长入和增殖,为新生组织提供适宜的生存环境,有望成为软骨组织工程生物材料。
| [1] | Shen Y, Fu Y, Wang J, et al. Biomaterial and mesenchymal stem cell for articular cartilage reconstruction[J]. Curr Stem Cell Res Ther, 2014, 9(3): 254–267. DOI:10.2174/1574888X09666140213202700 |
| [2] | 甘洪全, 王茜, 张辉, 等. 精氨酸-甘氨酸-天冬氨酸多肽表面修饰多孔钽对软骨细胞黏附、增殖和分泌功能的促进作用[J]. 吉林大学学报:医学版, 2015, 41(3): 510–516. |
| [3] | Stocco E, Barbon S, Dalzoppo D, et al. Tailored PVA/ECM scaffolds for cartilage regeneration[J]. Biomed Res Int, 2014, 2014: 762189. |
| [4] | Lange J, Follak N, Nowotny T, et al. Results of salucartilage implantation for stage Ⅳ chondral defects in the knee joint area[J]. Unfallchirurg, 2006, 109(3): 193–199. DOI:10.1007/s00113-005-1025-x |
| [5] | Baker MI, Walsh SP, Schwartz Z, et al. A review of polyvinyl alcohol and its uses in cartilage and orthopedic applications[J]. J Biomed Mater Res Part B Appl Biomater, 2012, 100(5): 1451–1457. |
| [6] | Abedi G, Sotoudeh A, Soleymani M, et al. A collagen-poly(vinyl alcohol) nanofiber scaffold for cartilage repair[J]. J Biomater Sci Polym Ed, 2011, 22(18): 2445–2455. DOI:10.1163/092050610X540503 |
| [7] | Anirudhan TS, Parvathy J, Nair AS. A novel composite matrix based on polymeric micelle and hydrogel as a drug carrier for the controlled release of dual drugs[J]. Carbohydr Polym, 2016, 136: 1118–1127. DOI:10.1016/j.carbpol.2015.10.019 |
| [8] | Cunha L, Grenha A. Sulfated seaweed polysaccharides as multifunctional materials in drug delivery applications[J]. Marine Drugs, 2016, 14(3): 42. DOI:10.3390/md14030042 |
| [9] | Bhattacharyya S, Tobacman JK. Molecular signature of kappa-carrageenan mimics chondroitin-4-sulfate and dermatan sulfate and enables interaction with arylsulfatase B[J]. J Nutr Biochem, 2012, 23(9): 1058–1063. DOI:10.1016/j.jnutbio.2011.05.012 |
| [10] | Liu J, Zhan X, Wan J, et al. Review for carrageenan-based pharmaceutical biomaterials:favourable physical features versus adverse biological effects[J]. Carbohydr Polym, 2015, 121: 27–36. DOI:10.1016/j.carbpol.2014.11.063 |
| [11] | Mihaila SM, Popa EG, Reis RL, et al. Fabrication of endothelial cell-laden carrageenan microfibers for microvascularized bone tissue engineering applications[J]. Biomacromolecules, 2014, 15(8): 2849–2860. DOI:10.1021/bm500036a |
| [12] | Popa E, Reis R, Gomes M. Chondrogenic phenotype of different cells encapsulated in κ-carrageenan hydrogels for cartilage regeneration strategies[J]. Biotechnol Appl Biochem, 2012, 59(2): 132–141. DOI:10.1002/bab.v59.2 |
| [13] | 张晓燕, 李正强, 孙莹, 等. 丝素蛋白/左旋聚乳酸复合组织工程纳米材料的生物相容性及安全性评价[J]. 吉林大学学报:医学版, 2014, 40(3): 578–582. |
| [14] | 于祥茹, 韩晓谦, 袁浩天, 等. PLGA/CPC支架材料复合骨髓基质干细胞构建组织工程骨的体外效果评价[J]. 吉林大学学报:医学版, 2014, 40(2): 294–299. |
| [15] | 李琦, 刘海峰, 王建六, 等. 大鼠盆底重建组织工程补片的初步构建及其在体研究[J]. 中华医学杂志, 2014, 94(41): 3273–3276. DOI:10.3760/cma.j.issn.0376-2491.2014.41.019 |
| [16] | 罗鹏刚, 熊龙, 曾建华, 等. 中空羟基磷灰石复合rhBMP-2修复骨缺损过程的再血管化研究[J]. 中国临床解剖学杂志, 2014, 32(2): 196–200. |
 2017, Vol. 43
2017, Vol. 43


