扩展功能
文章信息
- 朱文赫, 柳玉, 张家琦, 李艳, 刘微, 董媛, 刘磊, 王会岩
- ZHU Wenhe, LIU Yu, ZHANG Jiaqi, LI Yan, LIU Wei, DONG Yuan, LIU Lei, WANG Huiyan
- T-2毒素对人肝癌HepG2细胞的增殖抑制作用及促凋亡作用
- Inhibitory effect of proliferation and promotion effect of apoptosis induction of T-2 toxin on human hepatocellular carcinoma HepG2 cells
- 吉林大学学报(医学版), 2017, 43(06): 1087-1091
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1087-1091
- 10.13481/j.1671-587x.20170604
-
文章历史
- 收稿日期: 2017-04-10
2. 吉林医药学院检验学院 生物技术教研室, 吉林 吉林 132013
2. Department of Biotechnology, College of Medical Laboratory, Jilin Medical University, Jilin 132013, China
T-2毒素是单端孢霉烯族毒素中的典型代表,具有三环骨架的单端孢霉烷的母体结构,属倍半萜烯类化合物。T-2毒素是镰孢菌次生代谢产物,毒性强,性质稳定,清除难,具有广泛的毒性作用,主要为细胞毒性和免疫系统毒性,其细胞毒性主要包括抑制细胞蛋白质和遗传物质合成,引发细胞氧化应激导致DNA损伤[1-4]。T-2毒素主要作用于细胞增殖旺盛的组织或器官,如胸腺、淋巴和骨髓等,因此在肿瘤治疗中展现了潜在的应用价值。近年相关研究[5]表明:T-2毒素可明显抑制某些肿瘤细胞的增殖。Huang等[6]发现:T-2毒素能导致U937细胞凋亡并具有显著的形态学和生物学特征。研究[7]表明:T-2毒素能够通过改变人宫颈癌HeLa细胞的氧化应激水平,从而使得细胞DNA损伤,发生细胞凋亡。虽然T-2毒素在抗肿瘤治疗中起一定作用,但其具体的作用机制还需进一步研究。本研究以人HepG2肝癌细胞作为研究对象,研究T-2毒素对细胞增殖、细胞周期及细胞凋亡的影响,初步探讨T-2对肿瘤细胞的作用机制,为其临床应用奠定基础。
1 材料与方法 1.1 细胞、主要试剂和仪器人肝癌细胞株HepG2(吉林省教育厅现代生物制药重点实验室保存)。T-2毒素(本实验室分离纯化,纯度≥99%),小牛血清(杭州四季青产品),RPMI-1640培养液(美国Hyclone公司),碘化丙啶(PI)(美国Sigma公司),Annexin Ⅴ-FITC/PI双染凋亡试剂盒(广州碧云天公司),其他试剂均为国产分析纯。CKX41-A32PH倒置显微镜(日本奥林巴斯公司),Airtech医用型洁净工作台(苏州安泰空气技术有限公司),Bio-Rad 550酶标仪(美国Bio-Rad公司),流式细胞仪(美国贝克曼公司),MCO-18AIC恒温CO2培养箱(日本三洋公司),680型全自动酶标仪(美国Bio Rad公司)。
1.2 细胞培养和形态表现观察人HepG2细胞的培养基含RPMI-1640、10%小牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素,置于5% CO2的细胞培养箱中37℃培养。倒置显微镜下动态观察HepG2细胞在接触T-2毒素前后细胞形态表现和生长状况。
1.3 MTT实验检测各组HepG2细胞增殖抑制率取对数生长期细胞进行实验,调整细胞密度为1×105 mL-1,按每孔100 μL接种于96孔培养板,每组设5个复孔。培养24 h后,细胞分为实验组和对照组,实验组分别加入浓度为0.25、2.50、25.00、250.00和2500.00 μg·L-1 T-2毒素,对照组加入培养液,每孔100 μL。24 h后,弃去旧培养液,每孔加入200 μL含有0.5 g·L-1的MTT溶液,37℃培养4 h后吸出孔内液体,加入150 μL DMSO,振荡10 min,采用酶标仪检测490 nm处各孔吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值) ×100%。
1.4 流式细胞术检测细胞周期将1×105个HepG2细胞接种至96孔板中,培养24 h后,不同浓度(2.5、25.0和250.0μg·L-1)T-2毒素作用24 h,收集细胞,PBS洗涤2次后固定,加入75%冷乙醇,上机前通过离心去除乙醇,PBS洗涤2次,加入100 mg·L-1 RNase,加入5 g·L-1PI染色剂,避光染色20 min,采用流式细胞术检测细胞周期变化。采用ModFit分析软件进行细胞DNA水平分析,根据各组细胞周期的细胞DNA水平计算各组细胞周期各时相细胞的百分率。
1.5 流式细胞术检测HepG2细胞凋亡率取生长状态良好的HepG2细胞,在6孔板上接种细胞密度为每孔2×106个,分别设置对照组和T-2毒素组,培养24 h后T-2毒素组分别加入终浓度为2.5、25.0和250.0 μg·L-1 T-2毒素处理24 h,收集上清和细胞,依据双染细胞检测试剂盒Annexin Ⅴ-FITC/PI中的说明书进行操作,采用流式细胞术检测细胞凋亡情况[7]。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.6 Hoechst 33258荧光染色检测HepG2细胞凋亡形态表现取对数生长期的HepG2细胞,在6孔板上接种细胞密度为每孔2×106个,分别设置对照组和T-2毒素组,培养24 h后T-2毒素组分别加入终浓度为2.5、25.0和250.0 μg·L-1T-2毒素处理24 h后,按照Hoechst 33258染色说明书进行操作。荧光显微镜下观察细胞凋亡形态表现。
1.7 HepG2细胞中caspase-3活性检测采用胰蛋白酶消化T-2毒素组及对照组细胞后,细胞裂解液裂解收集的细胞,12 000 r·min-1离心10 min后取上清,采用BCA法测定蛋白浓度。将caspase-3底物加入上清中,37 ℃孵育60 min,采用酶标仪测定405 nm处的A值,根据标准曲线计算HepG2细胞中caspase-3的活性。
1.8 统计学分析采用SPSS 13.0统计软件进行统计学分析。各组细胞HepG2细胞中caspase-3活性以x ±s表示,多组间比较采用单因素方差分析,各组间均数两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组HepG2细胞形态表现对照组HepG2细胞生长状态良好,细胞贴壁生长,细胞触角较短,轮廓清晰,增殖较快,伸展透亮,细胞之间排列紧密。经浓度为0.25、2.50、25.00、250.00和2500.00 μg·L-1 T-2毒素处理HepG2细胞24 h后,细胞数量明显减少,细胞皱缩变形,体积缩小,细胞增殖受到抑制。见图 1(插页二)。
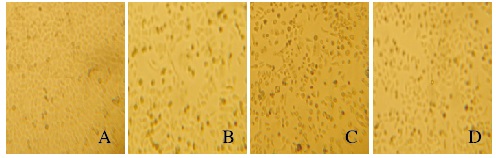
|
| A: Control group; B: 2.50 μg·L-1 T-2 toxin group; C: 25.00 μg·L-1 T-2 toxin group; D: 250.00 μg·L-1 T-2 toxin group. 图 1 倒置显微镜下观察各组HepG2细胞形态表现(×200) Figure 1 Morphology of HepG2 cells in various groups observed under inverted microscope (×200) |
|
|
MTT检测,与对照组比较,0.25、2.50、25.00、250.00和2500.00 μg·L-1 T-2毒素组HepG2细胞增殖率明显升高(P < 0.01),且具有明显的浓度依赖性。随着T-2毒素浓度的增加,抑制作用明显增加。见图 2。
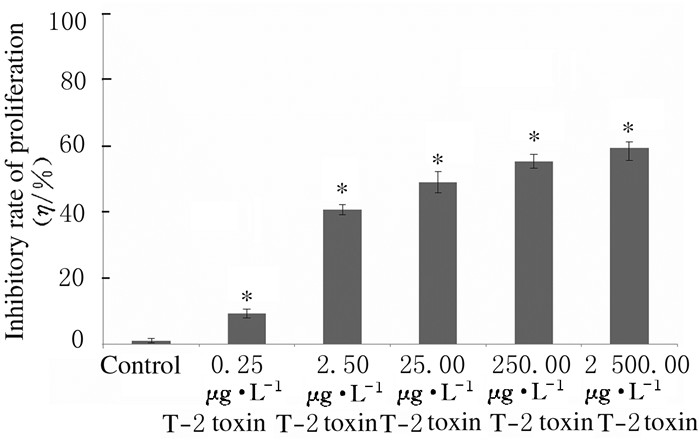
|
| *P < 0.01 vs control group. 图 2 各组HepG2细胞的增殖抑制率 Figure 2 Inhibitory rate of proliferation of HepG2 cells in various groups |
|
|
流式细胞术PI单染法分析2.5、25.0和250.0 μg·L-1 T-2毒素作用24 h对HepG2细胞周期的影响。SubG1期细胞比例明显升高,对照组SubG1期细胞比例为4.52%,而2.5、25.0和250.0 μg·L-1 T-2毒素作用后,SubG1期细胞比例分别为9.14%、10.18%和16.44%。见图 3。
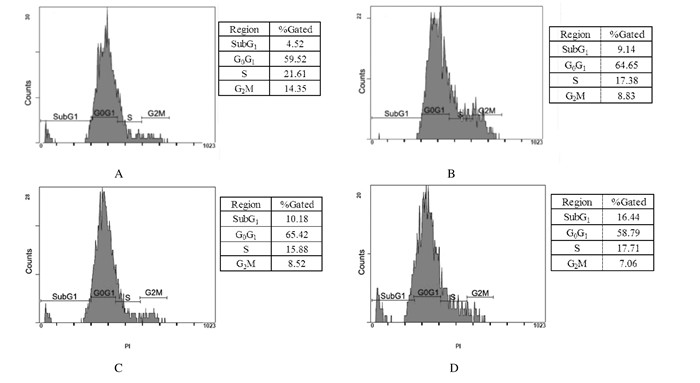
|
| A: Control group; B: 2.5 μg·L-1 T-2 toxin group; C: 25.0 μg·L-1 T-2 toxin group; D: 250.0 μg·L-1 T-2 toxin group. 图 3 各组HepG2细胞的细胞周期 Figure 3 Cycles of HepG2 cells in various groups |
|
|
流式细胞术检测,对照组细胞凋亡率为2.58%。经2.5、25.0和250.0 μg·L-1T-2毒素作用24 h后,HepG2细胞凋亡率升高,细胞凋亡率分别为6.75%、10.25%和17.01%。见图 4。
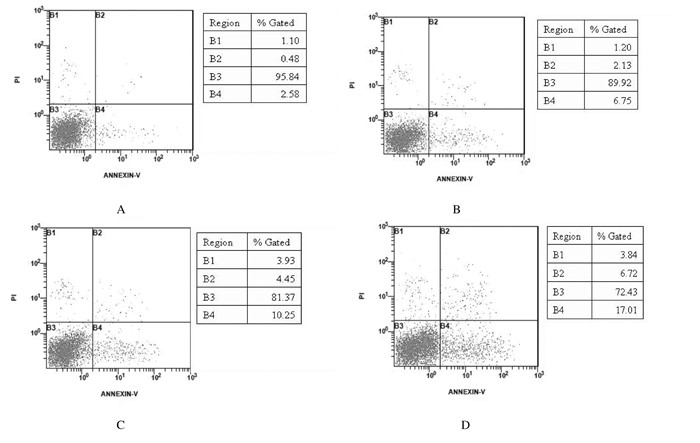
|
| A: Control group; B: 2.5 μg·L-1 T-2 toxin group; C: 25.0 μg·L-1 T-2 toxin group; D: 250.0 μg·L-1 T-2 toxin group. 图 4 流式细胞术检测各组HepG2细胞凋亡情况 Figure 4 Apoptosis of HepG2 cells in various groups detected by flow cytometry |
|
|
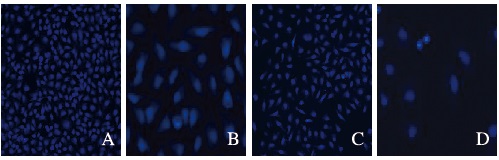
33258核染色,与对照组比较,T-2毒素组细胞呈现出典型的凋亡细胞特征,细胞染色质固缩,细胞核呈致密浓染色,且细胞核变小。见图 5(插页二)。
|
| A: Control group; B: 2.50 μg·L-1 T-2 toxin group; C: 25.0 μg·L-1 T-2 toxin group; D: 250.0 μg·L-1T-2 toxin group. 图 5 各组HepG2细胞凋亡形态表现 Figure 5 Apoptotic morphology of HepG2 cells in various groups |
|
|
经过T-2毒素作用后,HepG2细胞中caspase-3活性明显升高。2.5、25.0和250.0 μg·L-1 T-2毒素组HepG2细胞中caspase-3活性分别为0.451±0.03、0.518±0.08和0.547±0.06,对照组HepG2细胞中caspase-3活性为0.348±0.06,各浓度T-2毒素组HepG2细胞中caspase-3活性均高于对照组(P < 0.01)。
3 讨论全球肝癌的发病率呈升高趋势,且多数患者就诊时已进入晚期,患者死亡率高。现有的抗肿瘤药物存在着不良反应多等缺点,因此探寻绿色无毒且治疗效果好的药物是目前研究抗肝癌药物的一个难点[8-9]。T-2毒素是镰刀菌次生代谢产物,是一类单端孢霉烯族真菌毒素中具有代表性的毒素。研究[10]显示:T-2毒素对肿瘤细胞具有较强的杀伤作用,但其作用机制仍需进一步的研究。因此,本研究以人肝癌HepG2细胞作为研究对象,探讨T-2毒素抑制肝癌细胞增殖及诱导细胞凋亡的作用。
肿瘤发生的一个原因可能为细胞大量增殖,另一原因可能为凋亡抑制延长了细胞的生存周期[11]。因此,寻找通过干扰肿瘤生长代谢及增殖过程,最终诱发肿瘤凋亡的药物对于肿瘤治疗具有重要意义。本研究结果显示:不同浓度T-2毒素作用人肝癌HepG2细胞24 h,细胞褶皱变形,数量明显减少,细胞增殖活性明显受到抑制,并呈现一定的剂量依赖性,表明T-2毒素对HepG2细胞增殖具有抑制作用;流式细胞术检测结果显示:T-2毒素作用后,SubG1期细胞比例明显升高,未见明显细胞周期阻滞,与文献[12]报道相符。表明其具有诱导细胞发生凋亡的作用,但是未见明显细胞周期阻滞,其具体机制仍然有待进一步研究。
文献[13-14]报道:T-2毒素能够引发许多高增殖活性细胞的凋亡,因此在肿瘤治疗中展现了潜在的应用价值。本研究结果显示:不同浓度T-2毒素作用于HepG2细胞后,随着给药浓度的升高,细胞凋亡现象非常明显。细胞出现染色质固缩,细胞核呈致密浓染色,且细胞核变小,出现典型的细胞凋亡特征。流式细胞术检测结果显示:与对照组比较,T-2毒素组细胞凋亡比例明显升高。caspase家族在介导细胞凋亡的过程中扮演着重要的角色,其中关键的执行分子为caspase-3,在凋亡的早期阶段被激活,可裂解相应的胞质胞核底物,执行凋亡功能[13-15]。本研究中caspase-3活性检测结果表明:T-2毒素作用HepG2细胞后,caspase-3活性明显升高,说明细胞发生了凋亡。
综上所述,T-2毒素对人肝癌细胞HepG2具有明显的增殖抑制作用,能够诱导细胞凋亡。本研究结果虽然表明T-2毒素具有诱导人肝癌HepG2细胞发生凋亡的作用,但是具体作用机制有待进一步研究。
| [1] | McCormick SP, Kato T, Maragos CM, et al. Anomericity of T-2 toxin-glucoside:masked mycotoxin in cereal crops[J]. J Agr Food Chem, 2015, 63(2): 731–738. DOI:10.1021/jf504737f |
| [2] | De Boevre M, Di Mavungu JD, Maene P, et al. Development and validation of an LC-MS/MS method for the simultaneous determination of deoxynivalenol, zearalenone, T-2-toxin and some masked metabolites in different cereals and cereal-derived food[J]. Food Addit Contam A, 2012, 29(5): 819–835. DOI:10.1080/19440049.2012.656707 |
| [3] | Fang H, Wu Y, Guo J, et al. T-2 toxin induces apoptosis in differentiated murine embryonic stem cells through reactive oxygen species-mediated mitochondrial pathway[J]. Apoptosis, 2012, 17(8): 895–907. DOI:10.1007/s10495-012-0724-3 |
| [4] | Wu QH, Wang X, Yang W, et al. Oxidative stress-mediated cytotoxicity and metabolism of T-2 toxin and deoxynivalenol in animals and humans:an update[J]. Arch Toxicol, 2014, 88(7): 1309–1326. DOI:10.1007/s00204-014-1280-0 |
| [5] | Capcarova M, Petruska P, Zbynovska K, et al. Changes in antioxidant status of porcine ovarian granulosa cells after quercetin and T-2 toxin treatment[J]. J Environ Sci Health B, 2015, 50(3): 201–206. DOI:10.1080/03601234.2015.982425 |
| [6] | Huang P, Akagawa K Y, Nohara K, et al. T-2 toxin initially activates caspase-2 and induces apoptosis in U937 cells[J]. Toxicol Lett, 2007, 170(1): 1–10. DOI:10.1016/j.toxlet.2006.05.017 |
| [7] | 周明, 王雪雯, 杨莉, 等. As2O3联合γ分泌酶抑制剂对HepG2细胞凋亡的诱导作用及其机制[J]. 吉林大学学报:医学版, 2015, 41(3): 470–475. |
| [8] | Dong QZ, Zhang XF, Zhao Y, et al. Osteopontin promoter polymorphisms at locus -443 significantly affect the metastasis and prognosis of human hepatocellular carcinoma[J]. Hepatology, 2013, 57(3): 1024–1034. DOI:10.1002/hep.26103 |
| [9] | Alarifi S, Ali D, Alkahtani S, et al. Arsenic trioxide-mediated oxidative stress and genotoxicity in human hepatocellular carcinoma cells[J]. Onco Targets Ther, 2013, 6: 75–84. |
| [10] | Albarenque SM, Doi K, Albarenque SM, et al. T-2 toxin[J]. Exp Mol Pathol, 2005, 78(2): 144–149. DOI:10.1016/j.yexmp.2004.07.005 |
| [11] | Pu X, Storr SJ, Zhang Y, et al. Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357–368. DOI:10.1007/s10495-016-1323-5 |
| [12] | Doi K, Shinozuka J, Sehata S. T-2 Toxin and Apoptosis[J]. J Toxicol Pathol, 2006, 19(1): 15–27. DOI:10.1293/tox.19.15 |
| [13] | Zhang X, Vallabhaneni R, Loughran PA, et al. Changes in FADD levels, distribution, and phosphorylation in TNFalpha-induced apoptosis in hepatocytes is caspase-3, caspase-8 and BID dependent[J]. Apoptosis, 2008, 13(8): 983–992. DOI:10.1007/s10495-008-0228-3 |
| [14] | 朱文赫, 沈楠, 徐俊杰, 等. 微波辐射对大鼠能量代谢及心肌细胞凋亡的影响[J]. 中国病理生理杂志, 2015, 31(4): 647–651. |
| [15] | Pu X, Storr SJ, Zhang Y, et al. Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357–368. DOI:10.1007/s10495-016-1323-5 |
| [16] | 黄晓巍, 王艳玲, 李哲, 等. 鹿茸多肽对冈田酸致大鼠海马神经元损伤时Tau、Bcl-2和Caspase-3表达的影响[J]. 吉林大学学报:医学版, 2017, 43(1): 26–31. |
 2017, Vol. 43
2017, Vol. 43


