扩展功能
文章信息
- 孟峻, 侯艳军, 刘珊, 樊淑珍, 韩艳秋
- MENG Jun, HOU Yanjun, LIU Shan, FAN Shuzheng, HAN Yanqiu
- 14-3-3ε蛋白在小鼠卵母细胞减数分裂恢复过程中对Cdc25B定位的影响
- Effect of 14-3-3ε protein on localization of Cdc25B during meiotic resumption of mouse oocytes
- 吉林大学学报(医学版), 2017, 43(06): 1080-1086
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1080-1086
- 10.13481/j.1671-587x.20170603
-
文章历史
- 收稿日期: 2017-05-02
14-3-3蛋白是一种高度保守的酸性蛋白家族, 其相对分子质量约为28 000~31 000[1]。在哺乳动物中14-3-3蛋白有7个亚型,分别为β、γ、ε、σ、ζ、τ和η,各亚型均有其特殊的功能。14-3-3蛋白通常作为一种“调质蛋白”或“伴侣蛋白”在细胞核与细胞质间来回穿梭,以调节与之结合的靶蛋白的功能[2-3]。Cdc25蛋白家族是一种丝氨酸/苏氨酸双特异性磷酸化酶,包括Cdc25A、Cdc25B和Cdc25C,是有丝分裂必不可少的蛋白质[4-7]。Uchida等[8]证实:14-3-3蛋白的β和ε型可以与磷酸化的Cdc25B-309位的丝氨酸结合,导致Cdc25B定位于细胞质。对爪蟾卵母细胞的研究[9]显示:PKA通过磷酸化Cdc25B-287位的丝氨酸(磷酸化后的Cdc25B与14-3-3蛋白结合)控制Cdc25B在细胞内定位,抑制其活性,卵母细胞发生G2期阻滞。但是14-3-3ε在小鼠卵母细胞减数分裂恢复过程中对Cdc25B定位作用的研究尚未见报道。本实验通过间接和直接免疫荧光技术对小鼠卵母细胞中14-3-3ε蛋白和Cdc25B定位情况进行研究,通过沉默14-3-3ε基因,观察Cdc25B的定位和检测Cdc2-Tyr15的磷酸化状态, 进一步探讨14-3-3ε在小鼠卵母细胞减数分裂恢复即G2期阻滞解除过程中对Cdc25B分布的影响。
1 材料与方法 1.1 实验动物、主要试剂和仪器100只SPF级昆明系雌性小白鼠(3~4周,体质量15~18 g),由内蒙古大学实验动物中心提供,批号:SCXK(内蒙古)2014-0001。孕马血清促性腺激素(PMSG)(宁波激素三厂), 二丁酰环磷酸腺苷(dbcAMP)、M2培养液、矿物油和牛血清白蛋白(BSA)(Sigma公司, 美国),LB培养基、Waymouth MB 752/1培养液(Invitrogen公司, 美国),[γ-32P]三磷酸腺苷(北京福瑞公司), Hoechst33258(上海碧云天生物技术公司), FITC标记的山羊抗兔IgG和TRITC标记的兔抗山羊IgG(北京中杉金桥生物技术有限公司), DH5α感受态菌株(北京全式金生物技术有限公司), 各种限制性内切酶及pfu DNA聚合酶(Fermentas公司, 美国), Taq DNA聚合酶和T4 DNA连接酶(NEB公司, 美国), 去内毒素质粒中量提取试剂盒(OMEGA公司, 美国), DNA快速纯化/回收试剂盒(上海生工有限公司), 质粒DNA纯化试剂盒、克隆载体pGEM-T vector和表达载体pmax-FP-red-C(Promega公司, 美国), 14-3-3ε siRNA及对照siRNA由美国Invitrogen公司合成。低温超速离心机(Sigma公司,美国),台式高速离心机(TGL-16B,上海安亭科学仪器厂),凝胶自动成像仪GDS8000(BIO-RAD公司,美国),紫外分光光度仪(Phannacia公司,美国),细菌培养箱、空气浴振荡器(哈尔滨东明医疗仪器厂),实体显微镜SZ12型(Olympus公司,日本),相差显微镜OPTIPHOT/DIC型(Nikon公司,日本),显微操作系统(Eppendorf Tramferman公司,英国),Ⅸ-70倒置显微镜(Olympus公司,日本),CO2培养箱CBll5(WTB-binder公司,德国),LS3801液闪计数仪(Beckman公司,美国)。
1.2 小鼠卵母细胞的采集和培养根据Zhang等[11]的方法,取3~4周龄昆明系雌性小鼠,腹腔注射PMSG 10 IU/只,自由采食与饮水,48 h后颈椎脱臼法处死小鼠,剖开腹腔取出卵巢,置于含125 μmol·L-1 dbcAMP的M2培养液中,在体视显微镜下用1 mL注射器针头剔除卵巢周围脂肪及结缔组织,刺破大的有腔卵泡,轻压后释放出生发泡(GV)期裸卵母细胞,采用口径略大于卵母细胞直径的吸卵管反复吹打去除周围附着的颗粒细胞,获得含完整GV的裸卵母细胞,在M2培养液中洗涤3次,在MB培养液[7](在Waymouth MB752/1培养液的基础上添加100 mg· L-1丙酮酸钠、0.05 U· L-1青霉素、50 mg· L-1链霉素和3 g·L-1BSA)中培养,上面覆盖矿物油,在37℃、5%CO2、饱和湿度的CO2培养箱内培养到GV破裂即得到生发泡破裂(GVBD)卵母细胞。卵母细胞接受注射后,转移到含180 μmol·L-1 dbcAMP的MB培养液中,培养条件同上。
1.3 pmax-FP-Red-HA-14-3-3ε重组载体的构建将pcDNA3.1-ZEO-HA-14-3-3ε和pmax-FP-Red-C载体分别用EcoRⅠ单酶切,酶切反应体系为20 μL:pcDNA3.1-ZEO-HA-14-3-3ε/pmax-FP-Red-C 2 μL,10×Buffer 2 μL,EcoRⅠ1 μL,ddH2O 15 μL,37℃过夜,消化完的pmax-FP-Red-C加入1 μL,CIP,37℃过夜, 消化完的pmax-FP-Red-C加1 μL CIP,37℃、1 h去磷酸基,1.5%琼脂糖凝胶电泳,从胶中回收HA-14-3-3ε片段和酶切后的pmax-FP-Red-C载体, 回收片段经电泳确定相应的浓度,进行连接反应,反应体系为25 μL (HA-14-3-3ε cDNA与pmax-FP-Red-C按摩尔比3:1混合,10×T4连接酶缓冲液2.5 μL,T4 DNA连接酶350 U,ddH2O补足25 μL)。16℃反应过夜,将反应产物转化到感受态E.coli DH5α,取连接产物2 μL,加入100 μL冰中溶化的E.coli DH5α感受态细胞中,混匀后冰浴30 min,42℃水浴45 s,迅速放入冰中骤冷2 min,然后加入500 μL LB培养基,225 r·min-1于37℃振荡培养l h后,取100 μL涂布于Kana+的琼脂平板培养基中,37℃培养过夜。挑取单菌落于Kana+LB培养基中培养12~16 h,测其吸光度(A)值约为2~3时,用OMEGA去内毒素质粒提取试剂盒提取质粒,质粒用EcoRⅠ单酶切, 酶切反应体系为10 μL:10×Buffer 1 μL,pmax-FP-Red-HA-14-3-3ε1 μL,EcoRⅠ 0.5 μL,ddH2O 7.5 μL,37℃、1.5 h,1.5%琼脂糖电泳检测酶切结果, 选择酶切片段大小与预期相符合的阳性克隆保存并进一步行序列测定分析。构建成含HA-14-3-3ε红色荧光融合蛋白表达载体pmax-FP-Red-HA-14-3-3ε。测序后挑选鉴定正确的阳性克隆与pmax-FP-Red-C载体同时用EcoRⅠ酶切后连接,构建成pmax-FP-Red-HA-14-3-3ε融合表达载体, 重组载体经测序鉴定基因插入正确。其他构建体pEGFP-Cdc25B-WT和pEGFP-Cdc25B-Ser321A均为本实验室构建保存。
1.4 间接免疫荧光法检测14-3-3ε蛋白和Cdc25B蛋白的亚细胞定位收集GV期、GVBD前期和GVBD期的卵母细胞,用洗液(体积分数为1%BSA的PBS)洗涤3次。置入体积分数为4%多聚甲醛(用PBS溶解稀释)室温下固定1 h,或4℃固定过夜。PBST(PBS加入体积分数为0.01%Tween20)洗涤3次,体积分数为0.1%Triton X-100(美国Sigma公司,采用PBS溶解稀释)打孔30 min。采用封闭液(含体积分数为5%BSA的PBS)封闭1 h。将卵母细胞转入14-3-3ε一抗(稀释比例为1:800)和Cdc25B多克隆抗体(稀释比例为1:200)中4℃过夜,洗液洗涤3次,每次5 min。将卵母细胞转入FITC标记的羊抗兔IgG(1:100稀释)和TRITC标记的兔抗山羊IgG(1:100稀释)中,室温下避光孵育1 h,采用洗液洗涤3次,每次5 min。采用Hoechst33258(终浓度为10 mg·L-1)染色10 min,使DNA染色。激光共聚焦扫描显微镜观察并照相。标尺采用20 μm。每组实验重复3次,每次至少观测30个卵母细胞,选取典型的细胞形态(占全部观察细胞的95%以上)。
1.5 直接免疫荧光法检测14-3-3ε蛋白和Cdc25B蛋白的亚细胞定位将GV期卵母细胞移入到M2培养液中,用持卵针将卵母细胞固定,注射针刺入细胞后,将1 ng去内毒素的pmax-FP-Red-HA-14-3-3ε红色荧光融合表达载体注入胞核,在1 h后将1ng去内毒素的pEGFP-Cdc25B-WT、pEGFP-Cdc25B-S321A绿色荧光融合表达载体分别注入上述卵母细胞的胞核中,在含500 μmol·L-1 dbcAMP的MB培养液中培养36 h后观察定位情况。为尽量减少显微注射对卵母细胞的影响,一般注入到卵内的样品体积为10 pL(相当于其总体积的5%)。每组实验重复3次,每次至少观测30个卵母细胞,选取典型的细胞形态(占全部观察细胞的95%以上)。
1.6 显微注射观察小鼠卵母细胞GVBD的发生率显徽注射应用Eppendorf Transferman显微操作系统及OlympusⅨ-70倒置显微镜。注射时,将GV期卵母细胞移入含有125 μmol·L-1 dbcAMP的M2液滴中,用持卵针将卵固定,将注射针吸好10 pL siRNA刺入细胞将样品注入胞浆,为尽量减少显微注射对卵的影响,注入到卵母细胞内的样品体积为5 pL(20 μmol·L-1)。显微注射后,卵母细胞被转移到含有180 μmol·L-1 dbcAMP的MB培养液中,在37℃、5%CO2和饱和湿度的CO2培养箱内培养24 h。以control siRNA作为control siRNA注射组,不注射siRNA组作为未注射组,注射14-3-3εsiRNA作为14-3-3ε siRNA注射组。每组注射100个卵母细胞,每组重复3次,观测卵母细胞GVBD的发生率。
1.7 Western blotting法检测14-3-3ε蛋白和Cdc2-pTyr15蛋白的表达收集培养到指定时间的各组卵母细胞各200个,加入20 μL蛋白提取缓冲液,反复冻融3次,加入SDS样品缓冲液,100℃煮沸5 min,离心后上样,以体积分数为12%的SDS-PAGE电泳分离,然后将蛋白转至PVDF膜上,用含50 mg · L-1脱脂奶粉的TBST(pH7.4)于室温封闭1 h,与14-3-3ε抗体(1:800稀释)、Cdc2-pTyr15磷酸化抗体(1:500稀释)及β-actin抗体(1:500稀释)4℃孵育过夜。经TBST洗涤后,分别于相应的HRP偶联二抗室温孵育2 h,洗膜后,ECL化学发光法显影成像。
1.8 放射自显影检测各组卵母细胞的成熟促进因子(MPF)活性根据实验需要收集不同时期MB培养液中的小鼠卵母细胞各5个,转移到含有5 μL收集液的Eppendorf管中,随后立即置-70℃速冻保存直至检测活性前。收集液成分为含有1 mg·L-1聚乙烯醇、5 mmol·L-1 EDTA、10 mmol·L-1Na3VO4和10 mmol·L-1 NaF的磷酸盐缓冲液(pH7.4)。将收集的卵母细胞反复冻融3次,使细胞裂解,加入MPF反应液25 μL,置30℃水浴反应7 min。取25 μL点在Whatman P81强阳离子交换滤纸上(1 cm×2 cm),以75 mmol·L-1磷酸溶液反复洗3次终止反应,最后将滤纸置于含10 mL蒸馏水的液闪瓶内,以H1组蛋白为底物,采用Beckman液闪计数仪测定H1激酶每分钟放射活性(cpm值), 实验重复3~4次。
1.9 统计学分析采用SPSS13.0统计软件进行统计学分析。卵母细胞GVBD发生率、Cdc2-pTyr15的相对表达水平、到达第二次减数分裂中期(metaphase Ⅱ,MII)卵母细胞的比例和卵母细胞的MPF活性以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 pmax-FP-Red-HA-14-3-3ε重组表达载体的构建将HA-14-3-3εcDNA片段连接至pmax-FP-Red-C表达载体中,重组质粒经EcoRⅠ单酶切鉴定,可见约4800 bp的载体带及800 bp的目的条带,与预期结果一致。构建体经上海生工公司测序确认构建成功。见图 1。

|
| Lane l: pmax-FP-Red-HA-14-3-3ε; Lane 2:pmax-FP-Red-C; M:DL2000 DNA marker. 图 1 pmax-FP-Red-HA-14-3-3ε质粒经EcoRⅠ单酶切电泳图 Figure 1 Electrophoregram of pmax-FP-Red-HA-14-3-3ε plasmid digested by EcoRⅠ |
|
|
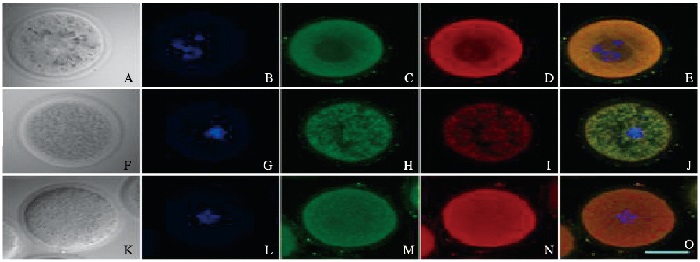
间接免疫荧光检测显示:在GV期,绿色荧光标记的14-3-3ε蛋白和红色荧光标记的Cdc25B蛋白共定位于细胞质;在GVBD前期,红色荧光标记的Cdc25B穿梭进入细胞核;在GVBD后,14-3-3ε蛋白和Cdc25B蛋白又均匀地分布于整个细胞。见图 2(插页一)。
|
| A-E: GV; F-J: Before GVBD; K-D: GVBD; A, F, K:Bright field; B, G, L:DNA; C, H, M:14-3-3ε; D, I, N:Cdc25B; E, J, O: Merge. 图 2 内源性14-3-3ε和Cdc25B蛋白在小鼠卵母细胞中的定位(Bar=20 μm) Figure 2 Localization of endogenous 14-3-3ε and Cdc25B proteins in mouse oocytes(Bar=20 μm) |
|
|
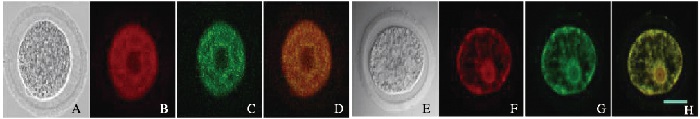
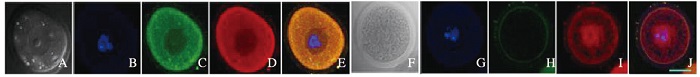
胞核显微共注射pEGFP-Cdc25B-WT和pmax-FP-Red-HA-14-3-3ε可见:红色荧光标记的14-3-3ε蛋白和绿色荧光标记的Cdc25B蛋白共定位于卵母细胞的细胞质中;胞核显微共注射pEGFP-Cdc25B-S321A和pmax-FP-Red-HA-14-3-3ε可见:绿色荧光标记的Cdc25B-S321A蛋白由细胞质进入细胞核。见图 3(插页一)。14-3-3εsiRNA注射后Cdc25B的定位结果显示:对照组14-3-3ε(绿色荧光)和Cdc25B(红色荧光)共定位于细胞质中; 14-3-3εsiRNA注射组中14-3-3ε的表达量非常低,Cdc25B(红色荧光)主要集中定位于细胞核内。见图 4(插页二)。
|
| A-D:Cdc25B-WT; E-H: Cdc25B-S321A; A, E:Bright field; B, F: Red-HA-14-3-3ε; C:EGFP-Cdc25B-WT; G:EGFP-Cdc25B-S321A; D-H:Merge. 图 3 外源性14-3-3ε与Cdc25B在小鼠卵母细胞中的定位(Bar=20 μm) Figure 3 Localization of exogenous 14-3-3ε and Cdc25B proteins in mouse oocytes (Bar=20 μm) |
|
|
|
| A-E: Normal control; F-J: 14-3-3εsiRNA; A, F:Bright field; B, G: DNA; C, H:14-3-3ε; D, I: Cdc25B; E, J: Merge. 图 4 14-3-3ε siRNA注射后Cdc25B的亚细胞定位(Bar=20 μm) Figure 4 Subcellular localization of Cdc25B after 14-3-3ε siRNA microinjection(Bar=20 μm) |
|
|
未注射组、control siRNA注射组注射后24 h均未发生GVBD,14-3-3ε siRNA注射组注射后22和24 h的GVBD率高于注射后20h时,注射24 h后有(9.30±0.82)%的卵母细胞到达MII,达MII百分比高于未注射组和control siRNA注射组(P < 0.01)。见表 1。
| (n=5, η/%) | ||||||
| Group | GVBD rate | MⅡ | ||||
| (t/h) 20 | 22 | 24 | 24 | |||
| Non-injection | 0 | 0 | 0 | 0 | ||
| Control siRNAinjection | 0 | 0 | 0 | 0 | ||
| 14-3-3ε siRNAinjection | 0 | 12.00±1.52*△ | 36.00±1.58*△ | 9.30±0.82*△ | ||
| *P < 0.01 vs non-injection group;△P < 0.01 vs control siRNA injection group. | ||||||
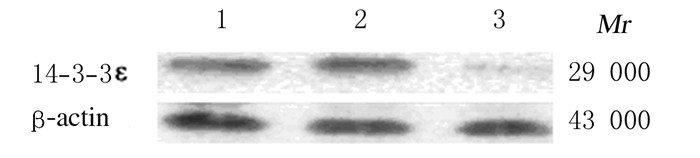
在GV期卵母细胞中注射14-3-3εsiRNA 24 h后, 检测到内源性14-3-3ε蛋白的表达水平降低(降低80%)。见图 5。未注射组、control siRNA注射组和14-3-3ε siRNA注射组处于GV期的卵母细胞中Cdc2-Tyr15处于磷酸化状态,而14-3-3ε siRNA注射组发生GVBD的卵母细胞中检测到微弱磷酸化的Cdc2-Tyr15,其相对表达水平低于未注射组GV卵母细胞中Cdc2-Tyr15的相对表达水平(P < 0.01)。见表 2。
|
| Lane l: Non-injection; Lane 2: Control siRNA injection group; Lane 3: 14-3-3 εsiRNA jection group. 图 5 显微注射14-3-3ε siRNA 24 h后14-3-3ε蛋白表达电泳图 Figure 5 Electrophoregram of expressions of 14-3-3ε protein 24 h after micro-injection of 14-3-3 εsiRNA |
|
|
| (n=5, x ±s) | ||
| Group | Relative expression level of Cdc2-pTyr15 | |
| GV oocytes | GVBD oocytes | |
| Non-injection | 0.89±0.11 | 0 |
| Control siRNAinjection | 0.88±0.13 | 0 |
| 14-3-3ε siRNAinjection | 0.90±0.12 | 0.22±0.02* |
| * P < 0.01 vs non-injection group. | ||
未注射组和control siRNA注射组卵母细胞MPF活性一直处于较低水平,而14-3-3ε siRNA注射组注射后20~30 h内,卵母细胞MPF活性呈现周期性变化,在注射后20 h时MPF活性很低,然后逐渐升高,在第一次减数分裂中期(注射后24h)达到第1个峰值,随后迅速降入低谷,注射后27 h达到第2个峰值,并在此维持数小时。注射后22~30 h,14-3-3ε siRNA注射组卵母细胞MPF活性高于未注射组(P < 0.01)。见表 3。
| (n=5, x ±s, cpm) | ||||||
| Group | MPF activity | |||||
| (t/h)20 | 22 | 24 | 25 | 27 | 30 | |
| Non-injection | 400.00±22.53 | 395.00±21.23 | 390.00±20.51 | 388.00±20.10 | 391.00±19.80 | 396.00±18.96 |
| Control siRNA injection | 401.00±21.50 | 397.00±20.82 | 396.00±18.52 | 389.00±16.53 | 386.00±15.68 | 392.00±17.85 |
| 14-3-3ε siRNAinjection | 400.00±18.68 | 821.00±36.75* | 1 653.00±68.96* | 558.00±25.63* | 1 115.00±40.62* | 1 005.00±38.45* |
| *P < 0.01 vs non-injection group. | ||||||
小鼠卵母细胞的发育阻滞于GV期,由GV期向GVBD期的转换,即卵母细胞恢复第一次减数分裂,相似于G2/M过渡[10]。在GV期阻滞的卵母细胞中,减数分裂的启动子MPF的催化亚基Cdc2-Thr14/Tyr15被磷酸化,MPF的活性受到抑制,卵母细胞发生GV期阻滞。14-3-3蛋白是一种真核细胞普遍存在的蛋白质,在细胞周期进程中常作为“脚手架”蛋白发挥作用。小鼠卵母细胞的研究[11-14]证实:蛋白激酶A (protein kinase A, PKA)通过Cdc25B的第321位丝氨酸磷酸化修饰引起GV期阻滞,PKA/Cdc25B通路在小鼠卵母细胞减数分裂中发挥重要作用,Cdc25B能促进减数分裂的重新启动,其突变体(S321A)能完全解除PKA引起的GV期阻滞。Uchida等[8]的实验结果显示:在HEK293细胞中14-3-3ε蛋白能与Cdc25B的309位丝氨酸结合并且控制Cdc25B的细胞质定位。但是在小鼠卵母细胞减数分裂恢复过程中,14-3-3ε蛋白是否对Cdc25B的细胞内定位有影响未见报道。本研究利用间接免疫荧光技术首次证明小鼠卵母细胞中14-3-3ε蛋白和Cdc25B蛋白在GV期共定位于细胞质,在GVBD前,部分Cdc25B从细胞质进入细胞核,而在GVBD后,14-3-3ε蛋白和Cdc25B均匀地分布于整个细胞, 提示在GV期,14-3-3ε蛋白和Cdc25B可能存在相互作用,导致Cdc25B不能进入细胞核,从而不能使MPF的催化亚基Cdc2-Thr14/Thy15脱磷酸化,因而不能激活MPF,卵母细胞发生GV期阻滞。而在GVBD前,14-3-3ε蛋白和Cdc25B去结合,Cdc25B从细胞质进入细胞核启动减数分裂。这与文献[15-18]报道相似,即14-3-3ε蛋白控制Cdc25B的细胞质定位。为了进一步证明14-3-3ε蛋白控制Cdc25B的胞浆定位,本课题组构建了pcDNA3.1-ZEO-HA-14-3-3ε、pEGFP-Cdc25B-WT和pEGFP-Cdc25B-S321A融合表达载体,显微注射到GV期卵母细胞中,以期观测14-3-3ε蛋白和Cdc25B(野生型、突变性)的共定位,直接免疫荧光实验显示:野生型Cdc25B和14-3-3ε蛋白共定位于细胞浆,而当Cdc25B的第321位丝氨酸突变为丙氨酸时,Cdc25B的细胞浆定位被取消,提示S321位点可能是14-3-3ε蛋白和Cdc25B蛋白的作用位点。小干扰RNA的干涉实验结果显示:下调14-3-3ε蛋白的表达,Cdc25B的细胞浆定位被取消,Cdc25B由细胞浆进入细胞核;下调14-3-3ε蛋白的表达,能激活MPF, 提高小鼠卵母细胞的GVBD发生率,进一步证明14-3-3ε蛋白可能与Cdc25B存在相互作用,下调14-3-3ε蛋白的表达,Cdc25B蛋白失去结合配体,由浆入核,激活MPF,表明Cdc25B蛋白的定位确实与14-3-3ε蛋白有关。本课题组前期实验研究[12]证实: 14-3-3ε蛋白通过Cdc25B的第321位丝氨酸磷酸化和脱磷酸化调控卵母细胞由GV期向GVBD的过渡。结合本研究进一步证明本文作者的假设:在小鼠卵母细胞中, PKA使Cdc25B-S321磷酸化,磷酸化的丝氨酸与14-3-3ε蛋白结合于胞浆,卵母细胞停滞于GV期,在某种磷酸酶的作用下,Cdc25B-S321脱磷酸而不能与14-3-3ε蛋白结合,Cdc25B入核激活MPF,小鼠卵母细胞恢复减数分裂,即14-3-3ε蛋白通过Cdc25B的第321位丝氨酸控制Cdc25B的细胞内定位。
综上所述,小鼠卵母细胞中14-3-3ε蛋白调控Cdc25B的细胞内定位,321位丝氨酸是实现调控的重要靶位点。14-3-3ε蛋白和Cdc25B蛋白是否存在相互作用以及具体的作用位点是否为S321值得进一步研究。接下来本课题组将进行免疫共沉淀实验,进一步研究PKA/Cdc25B-S321/14-3-3ε通路在小鼠卵母细胞减数分裂恢复中的调控机制。这一通路研究可为探讨小鼠受精卵细胞发育的分子调控机制提供实验依据,也为人类不孕不育的治疗提供理论支持。
| [1] | Aitken A. 14-3-3 proteins; a historic overview[J]. Semin Cancer Biol, 2006, 16(3): 162–172. DOI:10.1016/j.semcancer.2006.03.005 |
| [2] | Cotelle V, Leonhardt N. 14-3-3 proteins in guard cell signaling[J]. Front Plant Sci, 2015, 6: 1210. |
| [3] | Freeman AK, Morrison DK. 14-3-3 Proteins:diverse functions in cell proliferation and cancer progression[J]. Semin Cell Dev Biol, 2011, 22(7): 681–687. DOI:10.1016/j.semcdb.2011.08.009 |
| [4] | Lund G, Dudkin S, Borkin D, et al. Inhibition of CDC25B phosphatase through disruption of protein-protein interaction[J]. ACS Chem Biol, 2015, 10(2): 390–394. DOI:10.1021/cb500883h |
| [5] | Pandey AN, Chaube SK. Reduction of nitric oxide level leads to spontaneous resumption of meiosis in diplotene-arrested rat oocytes cultured in vitro[J]. Exp Biol Med(Maywood), 2015, 240(1): 15–25. DOI:10.1177/1535370214545024 |
| [6] | Li HL, Ma Y, Ma Y, et al. The design of novel inhibitors for treating cancer by targeting CDC25B through disruption of CDC25B-CDK2/CyclinA interaction using computational approaches[J]. Oncotarget, 2017, 8(20): 33225–33240. |
| [7] | Kim J, Singh AK, Takata Y, et al. LSD1 is essential for oocyte meiotic progression by regulating CDC25B expression in mice[J]. Nat Commun, 2015, 6: 10116. DOI:10.1038/ncomms10116 |
| [8] | Uchida S, Kuma A, Ohtsubo M, et al. Binding of 14-3-3beta but not 14-3-3 sigma controls the cytoplasmic localization of CDC25B:binding site preferences of 14-3-3 subtypes and the subcellular localization of CDC25B[J]. J Cell Sci, 2004, 117(Pt14): 3011–3020. |
| [9] | Yang J, Winkler K, Yoshida M, et al. MaIntenauce of G2 arrest in the Xonopus oocyte:a role for 14-3-3-mediated inhibition of Cdc25 nuclear import[J]. EMBO J, 1999, 18(8): 2174–2183. DOI:10.1093/emboj/18.8.2174 |
| [10] | Gao LL, Zhou CX, Zhang XL, et al. ZP3 is required for germinal vesicle breakdown in mouse oocyte meiosis[J]. Sci Rep, 2017, 7(2): 1–8. |
| [11] | Zhang Y, Zhang Z, Xu XY, et al. Protein kinase A modulates Cdc25B activity during meiotic resumption of mouse oocytes[J]. Dev Dyn, 2008, 237(12): 3777–3786. DOI:10.1002/dvdy.v237:12 |
| [12] | 孟峻, 侯艳军, 张永梅, 等. 14-3-3ε and Cdc25B在小鼠卵母细胞生发泡期阻滞中的作用[J]. 吉林大学学报:医学版, 2016, 42(2): 215–220. |
| [13] | Zhao X, Feng C, Yu D, et al. Successive recruitment of p-CDC25B-Ser351 and p-cyclin B1-Ser123 to centrosomes contributes to the release of mouse oocytes from prophase Ⅰ arrest[J]. Dev Dyn, 2015, 244(2): 110–121. DOI:10.1002/dvdy.v244.2 |
| [14] | Jeong SO, Seung JH, Marco C. Wee1B, Myt1 and Cdc25 function in distinct compartments of the mouse oocyte to control meiotic resumption[J]. J Cell Biol, 2010, 188(2): 199–207. DOI:10.1083/jcb.200907161 |
| [15] | Cui C, Ren X, Liu D, et al. 14-3-3 epsilon prevents G2/M transition of fertilized mouse eggs by binding with CDC25B[J]. BMC Dev Biol, 2014, 14(1): 33–46. DOI:10.1186/s12861-014-0033-x |
| [16] | Leal MF, Ribeiro HF, Rey JA. YWHAE silencing induces cell proliferation, invasion and migration through the up-regulation of CDC25B and MYC in gastric cancer cells:new insights about YWHAE role in the tumor development and metastasis process, oncotarget[J]. 2016, 7(51):85393-85410. http://www.ncbi.nlm.nih.gov/pubmed/27863420 |
| [17] | Astuti P, Boutros R, Ducommun B, et al. Mitotic phosphorylation of Cdc25B-Ser321 disrupts 14-3-3 binding to the high affinity ser323 site[J]. J Biol Chem, 2010, 285(45): 34364–34370. DOI:10.1074/jbc.M110.138412 |
| [18] | Sur S, Agrawal DK. phosphatases and kinases regulating CDC25 activity in the cell cycle:clinical implications of CDC25 overexpression and potential treatment strategies[J]. Mol Cell Biochem, 2016, 416(1/2): 33–46. |
 2017, Vol. 43
2017, Vol. 43


