扩展功能
文章信息
- 王云检, 张珉, 蒙博, 尤国华
- WANG Yunjian, ZHANG Min, MENG Bo, YOU Guohua
- 大黄牡丹汤对胰腺癌大鼠的治疗作用和肝肾保护作用
- Treatment effect of Da Huang Mu Dan Tang in rats with pancreatic carcinoma and protective effects on liver and kindey function
- 吉林大学学报(医学版), 2017, 43(06): 1069-1073
- Journal of Jilin University (Medicine Edition), 2017, 43(06): 1069-1073
- 10.13481/j.1671-587x.20170601
-
文章历史
- 收稿日期: 2017-04-11
胰腺癌发病率占常见恶性肿瘤发病率的1%~2%,近年来其发病率呈明显升高趋势[1]。目前胰腺癌临床治疗的手段有多种,包括手术治疗和姑息性治疗等,但均未取得良好疗效[2-3]。大黄牡丹汤源自东汉医圣张仲景所著的《金匮要略》,由大黄、桃仁、丹皮、芒硝和冬瓜子五味药物组成[4]。大黄牡丹汤对多种消化道器官炎症有明显的改善和治疗作用,张艳霞等[5]证实大黄牡丹汤对急性胰腺炎大鼠有明显的治疗作用。目前尚无采用大黄牡丹汤治疗胰腺癌的相关报道。胰腺癌发病过程中伴随的肝肾功能损害是降低患者生存质量的重要原因之一。本研究采用二甲基苯蒽(DMBA)胰腺包埋法制备大鼠胰腺癌模型,探讨大黄牡丹汤对胰腺癌的治疗作用及其机制,同时探讨大黄牡丹汤对胰腺癌大鼠肝肾功能的影响。
1 材料与方法 1.1 实验动物65只SD大鼠,雄性,SPF级,体质量180~220 g,购自河南省实验动物中心,动物合格证号:SCXK(豫) 2005-0001。于SPF级别环境中饲养,温度22 ℃~25 ℃,湿度30%~50%。
1.2 药物、主要试剂和仪器大黄、桃仁、丹皮、芒硝和冬瓜子购于北京同仁堂药业有限公司,按照处方比例混合药物,使用8倍量蒸馏水提取,每次1 h,随后旋转蒸发浓缩药液至生药量为1 g·L-1,按照20、40、80 mg·kg-1灌胃大鼠,每天1次[6];氟尿嘧啶购于西安海欣药业,使用生理盐水稀释,按照12 mg·kg-1尾静脉注射给药,每天1次。DMBA(美国Sigma公司),TUNEL(POD,美国罗氏公司),Trizol(美国Life Technology公司),RevertAid First Strand cDNA Synthesis Kit、Maxinma SYBR Green/ROX Qpcr Mastr Mix(美国Qiagen公司),其他化学试剂均为国产分析纯。高速低温离心机(美国Sigma公司),全自动生化仪(日本株式会社日立制作所),荧光定量PCR仪(美国Thermo公司),万分之一天平(瑞士梅特勒公司)。
1.3 动物分组和给药65只SD雄性大鼠分为对照组(10只)和造模组(55只)。造模组大鼠手术前禁食不禁水24 h,以3%戊巴比妥钠按照1 mL·kg-1体质量腹腔注射麻醉。待大鼠完全失去意识后,上腹部正中切口于胃部下方寻找胰腺,于胰腺体尾部切开胰腺被膜及部分胰腺实质,深度约为1 mm,植入9 mg DMBA,手术缝合切口,并撒上少量青霉素预防感染[7-9]。3个月后,再次手术腹部正中切口,肉眼观测肿瘤形成情况。选取肿瘤形成良好的大鼠50只,分为模型组(10只,存活8只),氟尿嘧啶组(10只,存活9只),低(10只,存活10只)、中(10只,存活8只)和高(10只,存活9只)剂量大黄牡丹汤组。氟尿嘧啶组大鼠尾静脉注射12 mg·kg-1氟尿嘧啶,低、中和高剂量大黄牡丹汤组大鼠分别灌胃给药20、40和80 mg·kg-1大黄牡丹汤水溶液。对照组和模型组大鼠灌胃等量的蒸馏水,共给药10周。
1.4 大鼠血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)及总胆红素(TBiL)水平的检测10周后,采用戊巴比妥钠麻醉大鼠,腹主动脉取血,静置4 h等待全血凝固后,3000 r·min-1离心10 min,取血清,采用全自动生化仪检测大鼠血清中ALT、AST、BUN、Cr和TBiL水平。
1.5 大鼠胰腺肿瘤质量和抑制率的测定大鼠麻醉取血完成后,大剪暴露大鼠腹腔,完整剥离整个胰腺组织,于冰上分离实体肿瘤部分,分析天平称质量,计算肿瘤抑制率。肿瘤抑制率=(模型组肿瘤平均质量-给药组肿瘤平均质量)/模型组肿瘤平均质量×100%。
1.6 TUNEL法检测大鼠胰腺肿瘤组织中细胞凋亡率肿瘤组织称质量后,切取部分组织,石蜡切片常规脱水,3%过氧化氢室温孵育10 min阻断内源性过氧化酶,蛋白酶K孵育30 min,PBS清洗后按照TUNEL试剂盒说明书方法,混合TUNEL反应液,37 ℃孵育组织1 h,PBS清洗后拍照,随后采用DAB显色液孵育10 min,中性树胶封片。每个样品计数3个视野,计算细胞亡率。细胞凋亡率=光镜下凋亡细胞数/光镜下凋亡细胞总数×100%。
1.7 Q-PCR法检测大鼠胰腺肿瘤组织中SST2R、Bax和Bcl-2基因表达水平称取约100 mg胰腺肿瘤组织,置于Trizol液中,液氮急冻保存至提取RNA。按照Trizol试剂盒说明书,使用氯仿沉淀蛋白,取上清液,使用异丙醇沉淀RNA,超纯水溶解后,使用核酸蛋白仪测定RNA浓度及纯度,以A(260)/A(280)的值在1.8~2.0为合格样品。随后按照试剂盒说明书逆转录mRNA得到相应的cDNA。按照Q-PCR试剂盒说明书检测胰腺肿瘤组织中SST2R、Bax及Bcl-2的基因表达水平。以空白对照组作为参照,采用2-ΔΔCt法分析并计算。SST2R扩增条件为95 ℃、5 min、95 ℃、40 s,60 ℃、60 s,72 ℃、60 s,共40个循环。Bax及Bcl-2扩增条件为95℃、3 min、95℃、8s,60℃、35s,共35个循环。β-actin使用上述2个扩增方案均可以获得良好扩增。引物序列见表 1。
| Gene | Sequence(5′-3′) | Primer length (bp) |
| β-actin | CACAATGGCTGACCATTCAG ATCCATGCCCTGAGTCCAC |
135 |
| SST2R | GAGGACACGATGGCCTGG CACGCGCGGAACTTTGA |
92 |
| Bax | TCACACCGATGTCCTGACGA CTGTCATGCAGATGGTCATC |
263 |
| Bcl-2 | GGTATGTCTGGATTGAGCCA ATGCCACCAGTTGAAGTGAG |
123 |
采用SPSS 16.0统计软件进行统计学分析。各组大鼠血清中ALT、AST、BUN、Cr、TBiL水平,肿瘤质量,肿瘤组织中细胞凋亡率,肿瘤组织中SST2R、Bax及Bcl-2基因表达水平以x ±s表示,多组间比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠血清中ALT、AST、BUN、Cr和TBiL水平与对照组比较,模型组大鼠血清中ALT、AST、BUN、Cr和TBiL水平明显升高(P < 0.01)。与模型组比较,氟尿嘧啶组和低、中、高剂量大黄牡丹汤组大鼠血清中ALT、AST、BUN、Cr和TBiL水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (x ±s) | ||||||
| Group | n | ALT [λB/(U·L-1)] |
AST [λB/(U·L-1)] |
BUN [cB/(mmol·L-1)] |
Cr [cB/(μmol·L-1)] |
TBiL [cB/(μmol·L-1)] |
| Control | 10 | 58.35±5.91 | 155.53±9.97 | 7.12±0.16 | 40.27±3.55 | 7.34±0.30 |
| Model | 8 | 188.95±10.95* | 370.70±10.81* | 18.32±1.14* | 169.30±5.46* | 32.42±2.46* |
| 5-Fu | 9 | 157.77±10.30△ | 320.90±9.89△ | 15.03±0.31△ | 130.46±6.62△ | 28.84±2.65△ |
| DHMDT | ||||||
| Low dose | 10 | 110.02±7.91△△ | 256.84±9.01 | 12.46±0.26△△ | 110.09±4.30△△ | 20.29±1.42△△ |
| Middledose | 8 | 100.89±8.22△△ | 222.72±10.01△ | 11.08±0.19△△ | 104.24±3.79△△ | 14.52±0.79△△ |
| High dose | 9 | 74.67±6.47△△ | 190.24±9.10 | 8.91±0.11△△ | 82.59±4.49△△ | 9.94±0.11△△ |
| *P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. | ||||||
给药完成后,与对照组比较,模型组大鼠胰腺处可见明显的肿胀,有硬质肿瘤存在。与模型组比较,氟尿嘧啶组和中、高剂量大黄牡丹汤组大鼠胰腺肿瘤质量明显降低(P < 0.05或P < 0.01)。氟尿嘧啶组和中、高剂量大黄牡丹汤组大鼠胰腺肿瘤抑制率分别为42.5%、25.2%和33.9%。见表 3。
| Group | n | Weightof tumor (m/g) |
Inhibitory rate of tumor(η/%) |
| Control | 10 | 0.000±0.000 | - |
| Model | 8 | 1.098±0.301* | - |
| 5-Fu | 9 | 0.631±0.091△△ | 42.5 |
| DHMDT | |||
| Low dose | 10 | 0.978±0.114 | 10.9 |
| Middle dose | 8 | 0.821±0.102△ | 25.2 |
| High dose | 9 | 0.726±0.087△ | 33.9 |
| *P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. “-”: No data. | |||
与模型组比较,氟尿嘧啶组和低、中、高剂量大黄牡丹汤组大鼠胰腺肿瘤组织中细胞凋亡率明显升高(P < 0.05或P < 0.01)。见表 4和图 1(插页一)。
| (x ±s, η/%) | ||
| Group | n | Apoptotic rate |
| Control | 10 | 0 |
| Model | 8 | 2.18±0.13 |
| 5-Fu | 9 | 21.38±3.96** |
| DHMDT | ||
| Low dose | 10 | 8.22±1.75* |
| Middle dose | 8 | 9.61±1.51* |
| High dose | 9 | 14.73±2.07* |
| *P < 0.05, * * P < 0.01 compared with model group. | ||
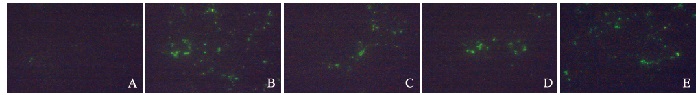
|
| A: Model group; B: 5-Fu group; C: Low dose of DHMDT group; D: Middle dose of DHMDT group; E: High dose of DHMDT group. 图 1 各组大鼠胰腺肿瘤组织形态表现(TUNEL, ×200) Figure 1 Morphology of pancreatic tumor tissue of rats in various groups (TUNEL, ×200) |
|
|
与对照组比较,模型组大鼠胰腺肿瘤组织中SST2R和Bax基因表达水平明显降低(P < 0.01),Bcl-2基因表达水平明显升高(P < 0.01)。与模型组比较,氟尿嘧啶组大鼠胰腺肿瘤组织中Bax基因表达水平明显升高,Bcl-2基因表达水平明显降低(P < 0.05);低、中和高剂量大黄牡丹汤组大鼠胰腺肿瘤组织中SST2R基因表达水平明显升高(P < 0.05);中和高剂量大黄牡丹汤组大鼠胰腺肿瘤组织中Bax基因表达水平明显升高(P < 0.05),Bcl-2基因表达水平明显降低(P < 0.05)。见表 5。
| (x ±s) | ||||
| Group | n | SST2R gene | Bax gene | Bcl-2 gene |
| Control | 10 | 1.002±0.009 | 1.025±0.008 | 1.010±0.011 |
| Model | 8 | 0.739±0.025* | 0.607±0.040* | 1.798±0.059* |
| 5-Fu | 9 | 0.612±0.049 | 0.814±0.016△ | 1.104±0.032△ |
| DHMDT | ||||
| Low dose | 10 | 0.817±0.009△ | 0.692±0.013 | 1.719±0.027 |
| Middle dose | 8 | 0.824±0.021△ | 0.745±0.024△ | 1.548±0.016△ |
| High dose | 9 | 0.879±0.026△ | 0.779±0.030△ | 1.359±0.020△ |
| *P < 0.01 compared with control group; △P < 0.05 compared with model group. | ||||
胰腺癌是目前最难治疗的恶性肿瘤之一,近些年来,胰腺癌的发病率在世界范围内呈明显的升高趋势,由于缺乏特异性的肿瘤标记物,导致其早期诊断率较低[10-11]。胰腺癌的早期症状主要是肿瘤阻塞胆管后,胰液、胆汁等分泌受阻,直至发展到一定程度出现黄疸,出现明显的黄疸症状平均时间为3个月,最长可达22个月。由于诊断困难,目前胰腺癌的5年生存率不足5%。《金匮要略》记载大黄牡丹汤具有泻热破淤、散结消肿的作用,是治疗胃肠道疾病的经典药方之一。
本研究通过手术开腹、采用DMBA胰腺包埋法制备大鼠胰腺癌模型,探讨大黄牡丹汤治疗胰腺癌的作用,同时还探讨了大黄牡丹汤对胰腺癌诱发肝肾功能损害的保护作用。一个稳定的胰腺癌模型是探讨药物作用的关键所在,本研究采用DMBA胰腺包埋法制备大鼠胰腺癌动物模型,该模型与人类胰腺癌疾病发展进程具有高度的相似性,具有结缔组织增生、胆道梗阻、神经浸润及多种癌症基因高表达的特性,是探讨药物治疗作用的可靠模型[12-13]。本研究结果证实:大黄牡丹汤能够保护胰腺癌所诱发的大鼠肝肾功能损害,同时对于胰腺肿瘤的生长亦有一定的抑制作用,该作用与调控凋亡基因Bax和Bcl-2促进胰腺肿瘤细胞凋亡有关[14]。由于大黄牡丹汤具有保护肝肾功能的作用,因此在使用多种药物联合治疗时可以适当提高用药量,增强疗效。此外,本研究还探讨了大黄牡丹汤对SST2R基因的作用,证实大黄牡丹汤可以上调SST2R基因的表达水平。SST2R可以与自分泌或者旁分泌的生长素抑素结合从而起到抗组织增生和抗肿瘤的作用[15]。体外胰腺癌细胞的基因表达研究[16]表明:胰腺癌细胞中SST2R基因表达水平明显降低,而这种表达水平降低在应用生长素进行治疗后会更为明显。本研究结果提示:使用大黄牡丹汤联合外源性生长抑制素类似物,可能会增强药物对于胰腺癌的治疗作用。
| [1] | 李慧超, 王宁, 郑荣寿, 等. 中国2010年胰腺癌发病和死亡分析[J]. 中国肿瘤, 2015, 24(3): 163–169. DOI:10.11735/j.issn.1004-0242.2015.03.A001 |
| [2] | 刘海林, 王磊. 胰腺癌早期诊断与治疗的研究进展[J]. 世界华人消化杂志, 2009, 17(34): 3475–3479. DOI:10.3969/j.issn.1009-3079.2009.34.001 |
| [3] | 金莉. 胰腺癌中医治疗进展[J]. 浙江中医杂志, 2012, 47(11): 855–857. DOI:10.3969/j.issn.0411-8421.2012.11.056 |
| [4] | 胡英兴, 胡望景, 吴斌斌. 大黄牡丹汤不同给药途径治疗阑尾脓肿的临床疗效观察[J]. 中国中医药科技, 2016, 23(1): 62–63. |
| [5] | 张艳霞, 张延英, 舒畅, 等. 大黄牡丹汤组方对急性胰腺炎大鼠的保护作用[J]. 中医研究, 2015, 28(2): 55–58. |
| [6] | 刘丽, 尹运涵, 吴健, 等. HPLC法同时测定大黄牡丹汤中大黄酸、丹皮酚和芍药苷的含量[J]. 中国药物警戒, 2010, 7(3): 139–141. |
| [7] | Satake K, Yoshimoto T, Mukai R, et al. Estrogen receptors in 7, 12-dimethylbenz (a) anthracene (DMBA) induced pancreatic carcinoma in rats and in human pancreatic carcinoma[J]. Clin Oncol, 1982, 8(1): 49–54. |
| [8] | 敖澜. 高强度聚焦超声消融胰腺原位癌后大鼠胰岛结构和内分泌功能的转归[D]. 重庆: 西南大学, 2016. http://d.wanfangdata.com.cn/Thesis/D01042874 |
| [9] | 李清龙. SD大鼠胰腺癌模型及其DNA损伤修复蛋白和癌干细胞标记蛋白在诱癌中的作用[D]. 长沙: 中南大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10533-2010185921.htm |
| [10] | Yamada R, Tanaka K, Naota H, et al. A long surviving case with undifferentiated pancreatic carcinoma[J]. Intern Med, 2016, 55(22): 3403–3404. DOI:10.2169/internalmedicine.55.6877 |
| [11] | Danoy M, Shinohara M, Rizki-Safitri A, et al. Alteration of pancreatic carcinoma and promyeloblastic cell adhesion in liver microvasculature by co-culture of hepatocytes, hepatic stellate cells and endothelial cells in a physiologically-relevant model[J]. Integr Biol (Camb), 2017, 9(4): 350–361. DOI:10.1039/C6IB00237D |
| [12] | Wang L, Liu H L, Li Y, et al. Proteomic analysis of pancreatic intraepithelial neoplasia and pancreatic carcinoma in rat models[J]. World J Gastroenterol, 2011, 17(11): 1434–1441. DOI:10.3748/wjg.v17.i11.1434 |
| [13] | Li F, El-Dika S, Modi R M, et al. Poorly differentiated pancreatic carcinoma with sarcomatoid differentiation:confocal endomicroscopy of an uncommon pancreatic cystic lesion[J]. Endoscopy, 2016, 48(S01). |
| [14] | Xi H, Fan X, Zhang Z, et al. Bax and Bcl-2 are involved in the apoptosis induced by local testicular heating in the boar testis[J]. Reprod Domest Anim, 2017, 52(3): 359–365. DOI:10.1111/rda.2017.52.issue-3 |
| [15] | Qin RY, Fang RL, Gupta MK, et al. Alteration of somatostatin receptor subtype 2 gene expression in pancreatic tumor angiogenesis[J]. World J Gastroenterol, 2004, 10(1): 132–135. DOI:10.3748/wjg.v10.i1.132 |
| [16] | 秦仁义, 裘法祖. 奥曲肽对胰腺癌组织SST2R和SST2R mRNA表达的影响[J]. 胰腺病学, 2002(1): 41–44. |
 2017, Vol. 43
2017, Vol. 43


