扩展功能
文章信息
- 邹运, 韩青, 徐晓麟, 杨莹莹, 张客松, 杨科荣, 秦彦国, 邹永巍, 王金成, 张首依
- ZOU Yun, HAN Qing, XU Xiaolin, YANG Yingying, ZHANG Kesong, YANG Kerong, QIN Yanguo, ZOU Yongwei, WANG Jincheng, ZHANG Shouyi
- 骨科和口腔颌面外科3D打印模型的精度验证和可靠性分析
- Accuracy verification and reliability analysis of three-dimensional printing model in orthopedics and maxillofacial surgery
- 吉林大学学报(医学版), 2017, 43(05): 996-1001
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 996-1001
- 10.13481/j.1671-587x.20170526
-
文章历史
- 收稿日期: 2017-03-19
2. 吉林大学口腔医院口腔颌面外科, 吉林 长春 130021
2. Department of Maxillofacial Surgery, Stomatology Hospital, Jilin University, Changchun 130021, China
3D打印是一种基于计算机辅助设计(computer assistant design, CAD)通过打印材料的逐层堆积来制造三维实体的技术,其数据来源于影像学[1]。该技术大致可分为金属打印和非金属打印两大类,其中金属打印包括选择激光熔融(selective laser melting, SLM)、电子束熔融(electron beam melting, EBM)和选择激光烧结(selective laser sintering, SLS)等,非金属打印包括立体光固化、三维绘图(3D-printing, 3DP)、熔融沉积成型(fused deposition molding, FDM)和分层实体制造(laminated object manufacturing, LOM)等[2-4]。
近年来,3D打印技术被广泛应用于医学领域,尤其是3D打印骨骼模型在骨科及口腔颌面外科临床诊疗过程中的应用屡见报道,诸如骨盆、锁骨、股骨、桡骨及跟骨等复杂骨折的术前设计,以及颌面部缺损和畸形、脊柱侧凸和膝关节创伤性关节炎等疾病的辅助诊断[5-17],其中SLA模型技术应用在骨及颌面外科术前诊断最为常见。与X线、计算机断层扫描(CT)及磁共振成像(MRI)等传统影像学辅助诊断手段比较,3D打印模型具有立体、直观、清晰和可操作等优势,方便医生进行术前设计及模拟手术,同时便于医患沟通,确定个体化治疗方案。但随着3D打印技术应用的增多,其存在的问题也日益凸显。在模型制作过程中,很多因素会影响模型的精度,而目前国内外尚无相关的系统研究证实模型精确与否;一些研究者对模型的精度存在质疑,并怀疑其临床应用的可靠性,例如模型尺寸、长骨髓腔直径和不规则骨解剖径线等参数对于术前设计及模拟手术至关重要,如果精度误差过大,则3D打印技术的优势将不存在,其应用将受到限制,甚至会导致如术前设计失败等不良后果;且3D打印模型价格较高,会给患者造成一定经济负担。基于上述原因,对模型精度的验证及应用可靠性的分析势在必行。本研究通过对SLA-3D打印光固化树脂模型的尺寸、长骨髓腔直径及不规则骨解剖径线等参数进行测量,并与原始影像学数据进行对比,探讨模型的精确度并分析可能的影响因素,为3D打印光固化树脂模型的临床应用提供理论依据。
1 资料与方法 1.1 原始数据收集及分组随机选择2015年9月—2017年2月在吉林大学第二医院骨科诊疗中心进行模型打印的患者33例(未行模拟手术破坏),依据其特点分为长骨组10例(肱骨4例、尺骨4例和股骨2例)、不规则骨组12例(肩胛骨3例、全骨盆3例、部分骨盆2例、距骨2例和下颌骨3例)和假体组(肩关节假体2例、肘关节假体3例和股骨假体5例)。原始数据来源于吉林大学第二医院骨科中心诊治的骨科疾病患者及吉林大学口腔医院口腔颌面外科诊治的颌面部畸形的患者,采集患者的CT(飞利浦256排超高清CT)数据,并以DICOM格式导出。将DICOM格式的文件导入MIMICS17.0(比利时Materialise公司)软件内,进行图像的三维重建。最后输出标准化三角语言(standardized trigonometric language, STL)文件。以上涉及患者数据信息均签署知情同意书,本研究获吉林大学第二医院伦理委员会及吉林大学口腔医院伦理委员会批准。
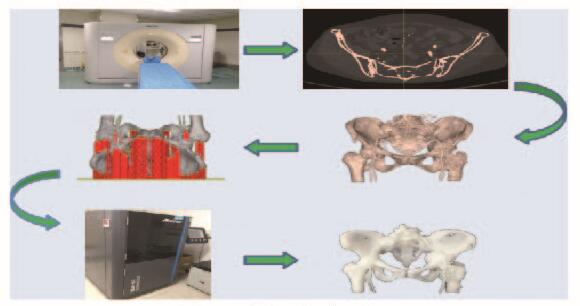
1.2 3D打印模型和模型CT回扫将获得的STL数据文件,输入至MAGICS 18.0(比利时Materialise公司)软件中,经过修复模型、调整位置、添加支撑等一系列处理后,以Magics格式文件输出至3D打印设备(SLA-450, 中国Shining公司)进行打印。最后将打印好的模型取出进行去支撑、有机溶剂清洗及进一步紫外固化等后期处理后,得到可以应用的模型。上述步骤均在吉林大学第二医院骨科3D打印手术设计中心进行(图 1,见插页六)。取得模型后,采用CT回扫的方法取得模型的CT数据,并重复上述步骤,得到模型CT数据的三维重建文件。
|
| 图 1 模型打印过程 Figure 1 Printing process of model |
|
|
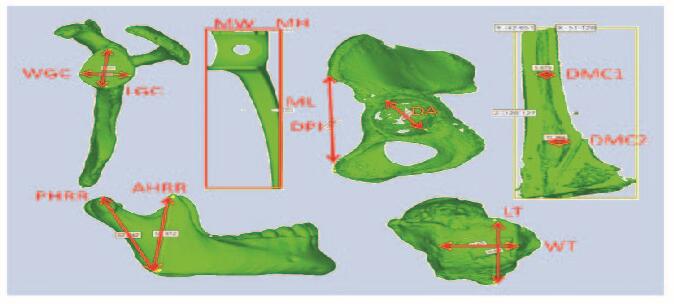
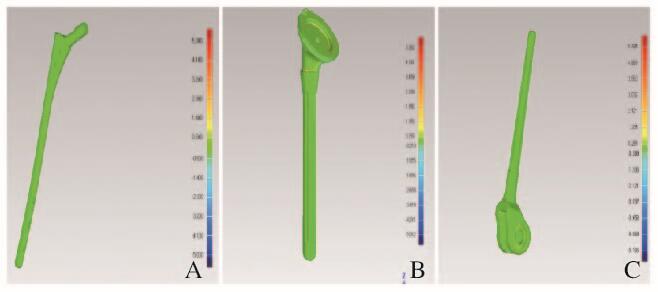
本研究纳入的33例模型(长骨10例、不规则骨13例和假体10例)均未行模拟手术破坏。依据不同模型临床应用特点,选择一些解剖径线及尺寸参数在MAGICS18.0软件中分别对模型数据和原始数据进行测量,包括最大高径(max height,MH)、最大长径(max length,ML)、最大宽径(max width,MW)、滑车宽径(width of trochlear,WT)、滑车长径(length of trochlear,LT)、关节盂长径(length of glenoid cavity,LGC)、关节盂宽径(width of glenoid cavity,WGC)、髂前上棘到耻骨结节距离(distance of pubic tubercle-anterior superior iliac spine,DPI)、髋臼直径(diameter of acetabulum,DA)、髓腔直径(diameter of marrow cavity,DMC)、右下颌支前缘高度(anterior height of right ramus,AHRR)和右下颌支后缘高度(posterior height of right ramus,PHRR)(图 2,见插页六)。参数的绝对和相对误差计算公式:绝对误差(mm)=模型组数据—原始组数据;相对误差=(模型组数据-原始组数据)/原始组数据×100%。对于假体组,由于模型均为实体结构,不存在内部支撑残留影响,可选择Geomagic Studio 2012软件(美国Geomagic公司)进行空间误差分析(图 3,见插页六),其他2组(长骨和不规则骨)未行该项比对。
|
| Red arrows and lines indicated the parameters 图 2 模型相关参数 Figure 2 Related parameters of model |
|
|
|
| A:/femur prosthesis; B:Shoulder prosthesis; C:Elbow prosthesis 图 3 假体组空间误差的测量 Figure 3 Measurment of three dimensional errors in prothesis group |
|
|
采用SPSS 17.0统计软件进行统计学分析。各参数的模型数据和原始数据(包括MH、ML、MW、WT、LT、LGC、WGC、DPI、DA、DMC、AHRR和PHRR)均以x±s表示,组间比较采用配对t检验。以P<0.05为差异有统计学意义。应用组内相关系数(ICC)评价数据的一致性。
2 结果 2.1 各组SLA-3D打印模型参数的模型数据和原始数据模型数据和原始数据间各项参数ICC值均大于0.950;除不规则骨外,其余各项参数组间比较差异均无统计学意义(P>0.05);与原始数据组比较, 模型数据不规则骨MW值升高(P=0.028)。见表 1~3。
| (n=10, x±s, l/mm) | |||||
| Group | ML | MW | MH | DMC1 | DMC2 |
| Image | 42.12±5.51 | 112.27±63.17 | 72.06±59.26 | 8.16±2.76 | 8.29±3.28 |
| Model | 41.54±4.87 | 112.00±63.15 | 72.46±28.79 | 8.20±2.92 | 8.28±3.20 |
| t | 1.212 | 1.566 | -1.788 | -0.578 | 0.073 |
| P | 0.256 | 0.152 | 0.107 | 0.577 | 0.944 |
| ICC | 0.964 | 1.000 | 1.000 | 0.998 | 0.997 |
| (n=13, x±s, l/mm) | |||||
| Group | ML | MW | MH | D1 | D2 |
| Image | 150.23±75.62 | 110.56±44.60 | 131.91±70.32 | 46.16±15.44 | 74.86±45.21 |
| Model | 150.36±75.81 | 110.70±44.67 | 132.14±70.58 | 46.22±15.56 | 74.92±45.50 |
| t | -1.064 | -2.491 | -0.881 | -0.480 | -0.416 |
| P | 0.308 | 0.028 | 0.396 | 0.640 | 0.685 |
| ICC | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 |
| Note:D1 standed for WT, WGC, DA, AHRR; D2 standed for LT, LGC, DPI, PHRR. | |||||
| (n=10, x±s, l/mm) | |||
| Group | ML | MW | MH |
| Image | 22.94±5.08 | 165.22±123.59 | 67.56±37.44 |
| Model | 23.10±5.07 | 165.17±123.30 | 67.71±37.10 |
| t | -1.525 | 0.317 | -1.080 |
| P | 0.162 | 0.759 | 0.308 |
| ICC | 0.998 | 1.000 | 1.000 |
各组参数绝对和相对误差最大值分别为-0.58 mm和-1.37%,其均值分别为(0.18±0.16) mm和(0.35±0.37)%。见表 4。
| Group | Parameter | Absolute difference(l/mm) | Relative difference(η/%) |
| Irregular bone | ML | 0.13 | 0.09 |
| MW | 0.14 | 0.13 | |
| MH | 0.23 | 0.17 | |
| D1 | 0.11 | 0.27 | |
| D2 | 0.10 | 0.13 | |
| Long bone | ML | -0.58 | -1.37 |
| MW | -0.27 | -0.24 | |
| MH | 0.40 | 0.56 | |
| DMC1 | 0.04 | 0.49 | |
| DMC2 | -0.01 | -0.12 | |
| Prosthesis | ML | 0.16 | 0.70 |
| MW | -0.05 | -0.03 | |
| MH | 0.15 | 0.22 | |
| Total mean | 0.18±0.16 | 0.35±0.37 |
假体组模型与假体间空间最大正向误差、最大负向误差及最大平均误差分别为0.237、0.142和0.154 mm,平均正向误差、平均负向误差及总平均误差分别为(0.157±0.041)、(0.103±0.040) 和(0.132±0.018) mm。见表 5。
| (l/mm) | ||||
| Positive distance | Minus distance | Mean distance | Standard deviation | |
| 1 | 0.164 | 0.089 | 0.137 | 0.153 |
| 2 | 0.237 | 0.130 | 0.154 | 0.263 |
| 3 | 0.153 | 0.100 | 0.133 | 0.127 |
| 4 | 0.082 | 0.140 | 0.122 | 0.147 |
| 5 | 0.119 | 0.089 | 0.108 | 0.091 |
| 6 | 0.175 | 0.101 | 0.144 | 0.173 |
| 7 | 0.184 | 0.142 | 0.097 | 0.205 |
| 8 | 0.162 | 0.150 | 0.139 | 0.180 |
| 9 | 0.153 | 0.034 | 0.141 | 0.098 |
| 10 | 0.145 | 0.058 | 0.141 | 0.084 |
| Total mean | 0.157±0.041 | 0.103±0.040 | 0.132±0.018 | 0.152 |
诊断和治疗复杂骨科及颌面外科疾病,是骨科及口腔颌面外科医生需要面对的难题。在诊断方面,仅凭现有的影像学手段,很难对一些复杂骨缺损、骨折、畸形和骨肿瘤给出直观精确的诊断结论;在治疗方面,现有的商品骨科假体和颌面部植入物因规格形状统一,而未达到与每个患者个性化匹配的要求。3D打印技术的发展为上述问题的解决提供了一个新思路。然而随着3D打印技术在临床上应用的增加[10-20],其精度及可靠性受到质疑,而国内外尚无针对临床应用3D打印模型精度的研究,本研究即针对该问题进行探讨。
研究[4]显示:CT图像的空间误差为0.9%~2.16%, 当图像数据转化为STL格式时,模型表面则转换为大量精确三角,这可以提升图像质量以及增加图像算法的精度[21],故转化为STL格式的CT图像被认为是精确可靠的。因此本研究选择逆向CT回扫技术对SLA-3D打印模型与对应原始骨骼及假体CT数据之间的误差进行分析。采用模型与原始数据相应参数间的ICC值、绝对及相对误差和空间误差等指标来评价模型的精度与可靠性。
在骨科诊疗过程中,股骨、胫骨、肱骨、尺骨和桡骨等长骨组织的髓腔空间尺寸往往是医生所关注的。例如关节置换时假体柄的植入、骨折时髓内针的插入等都需要考虑髓腔直径。而对于不规则骨,如髂骨、肩胛骨、下颌骨及距骨等,其关节盂及一些解剖标志点的距离,会对手术方案的制订及假体型号的选择产生影响,也因此被医生所关注。本研究结果显示:各组SLA-3D打印模型参数最大的绝对误差仅有-0.58 mm,平均绝对误差仅为(0.18±0.16) mm,而本次采用的CT设备层厚为0.9 mm,可考虑忽略该误差;同时,在骨科及口腔颌面外科疾病的实际临床诊治过程中,0.58 mm的最大误差是可以被接受的,因此SLA-3D打印模型的尺寸精度令人满意;本研究中最大相对误差为-1.37%,平均相对误差(0.35±0.37)%,远低于激光选区烧结(SLS)、3DP以及PolyJet等技术打印产品相应值[4]。
空间误差指真实假体与3D打印假体模型的图像在三维重建软件中最佳拟合后、在空间上存在的矢量误差,由于假体空间误差的大小直接影响模拟手术的准确性,该误差验证也是必要的。假体模型为实体结构,无内部支撑结构影响,故可对假体组三维图像行空间误差分析。长骨和不规则骨模型因内部具有髓腔和松质骨等结构,在模型打印过程中会产生支撑,影响空间误差分析结果,故而未行空间误差分析。本研究结果显示:根据色谱条对比观察模型整体均呈现绿色(0 mm),可以直观地认为模型具有足够精度;量化数据示假体组中最大正向误差为0.237 mm,最大负向误差为0.142 mm,总平均误差为(0.132±0.018) mm,优于Otawa等[22]对于3D打印钛金属部件空间误差的分析结果,即对于精度为0.1 mm的3D打印设备及临床术前设计及术前辅助诊断等应用,该结果也是令人满意的。
此外,除不规则骨MW外,原始数据与模型数据的各项参数比较差异均无统计学意义,即模型的CT数据与真实骨骼及假体的CT扫描数据之间不存在统计学差异,并且ICC值均大于0.950,因此可以认为:SLA-3D打印模型与原始CT数据高度一致,其在术前设计和模拟手术中的应用是可靠的。本研究结果也优于Wu等[23]应用聚乳酸(PLA)材料打印模型精度研究的结果。
本研究中,假体模型空间误差最大值均出现在模型边缘,考虑是由于模型进行CT扫描时存在部分容积效应,而真实模型与原始CT图像则应该更为一致。原始数据与模型数据的不规则骨MW间比较差异有统计学意义,考虑是由于其不规则的形态引起打印时材料热形变,最终导致边缘翘起。另外,模型打印过程中,CT扫描伪影、不同数据间的转换、温湿度影响、模型支撑处理以及后期人工处理等因素也会影响研究结果。目前本课题组正在进一步探索优化流程,以减少人为误差。本研究的不足之处包括骨骼种类不全、部分模型为骨骼局部及样本量较少等,本课题组将继续积累样本,进行更深入的探究。
综上所述,对于复杂的骨折、骨关节炎、颌面部畸形和骨肿瘤等骨科和颌面外科疾病,可以选择采用3D打印模型进行辅助诊断、术前设计和模拟手术。3D打印技术可以帮助医生提高对疾病的诊疗水平,同时也可以使患者直观地了解自身的病情,增加医患双方对诊疗过程的满意度[15]。与传统影像学方法比较,3D打印模型技术应用于临床具有直观、清晰及可操作等优势,其在术前设计方面的应用更可以减少手术时间并降低术中创伤[10, 24-26]。SLA-3D打印模型的空间误差及绝对/相对误差在一个可以接受的范围内,并且模型数据与原始CT数据是高度一致的,可以认为该技术在骨科及颌面外科疾病诊断和治疗过程中的应用是准确可靠的。本研究为SLA-3D打印模型临床应用的精度及可靠性提供了一定的理论支持。本课题组下一步将会对采用3D技术诊治的患者进行长期随访,并与非应用者进行回顾性对比分析,观察3D打印技术应用的远期效果。
| [1] | Rengier F, Mehndiratta A, von Tengg-Kobligk H, et al. 3D printing based on imaging data:review of medical applications[J]. Int J Comput Assist Radiol Surg, 2010, 5(4): 335–341. DOI:10.1007/s11548-010-0476-x |
| [2] | Haverman TM, Karagozoglu KH, Prins HJ, et al. Rapid prototyping:a very promising method[J]. Ned Tijdschr Tandheelkd, 2013, 120(3): 136–141. DOI:10.5177/ntvt.2013. |
| [3] | Webb PA. A review of rapid prototyping (RP) techniques in the medical and biomedical sector[J]. J Med Eng Technol, 2000, 24(4): 149–153. DOI:10.1080/03091900050163427 |
| [4] | Ibrahim D, Broilo TL, Heitz C, et al. Dimensional error of selective laser sintering, three-dimensional printing and PolyJetTM models in the reproduction of mandibular anatomy[J]. J Craniomaxillofac Surg, 2009, 37(3): 167–173. DOI:10.1016/j.jcms.2008.10.008 |
| [5] | Bagaria V, Deshpande S, Rasalkar DD, et al. Use of rapid prototyping and three-dimensional reconstruction modeling in the management of complex fractures[J]. Eur J Radiol, 2011, 80(3): 814–820. DOI:10.1016/j.ejrad.2010.10.007 |
| [6] | Starosolski ZA, Kan JH, Rosenfeld SD, et al. Application of 3-D printing (rapid prototyping) for creating physical models of pediatric orthopedic disorders[J]. Pediatr Radiol, 2014, 44(2): 216–221. DOI:10.1007/s00247-013-2788-9 |
| [7] | Chen Y, Niu F, Yu B, et al. Three-dimensional preoperative design of distraction osteogenesis for hemifacial microsomia[J]. J Craniofac Surg, 2014, 25(1): 184–188. DOI:10.1097/SCS.0000000000000391 |
| [8] | Klammert U, Gbureck U, Vorndran E, et al. 3D powder printed calcium phosphate implants for reconstruction of cranial and maxillofacial defects[J]. J Craniomaxillofac Surg, 2010, 38(8): 565–570. DOI:10.1016/j.jcms.2010.01.009 |
| [9] | Chung KJ, Hong DY, Kim YT, et al. Preshaping plates for minimally invasive fixation of calcaneal fractures using a real-size 3D-printed model as a preoperative and intraoperative tool[J]. Foot Ankle Int, 2014, 35(11): 1231–1236. DOI:10.1177/1071100714544522 |
| [10] | Kim HN, Liu XN, Noh KC. Use of a real-size 3D-printed model as a preoperative and intraoperative tool for minimally invasive plating of comminuted midshaft clavicle fractures[J]. J Orthop Surg Res, 2015, 10(10): 91. |
| [11] | Wu XB, Wang JQ, Zhao CP, et al. Printed three-dimensional anatomic templates for virtual preoperative planning before reconstruction of old pelvic injuries:initial results[J]. Chin Med J (Engl), 2015, 128(4): 477–482. DOI:10.4103/0366-6999.151088 |
| [12] | Wang D, Wang Y, Wang J, et al. Design and fabrication of a precision template for spine surgery using selective laser melting (SLM)[J]. Materials, 2016, 9: 608. DOI:10.3390/ma9070608 |
| [13] | Zeng CJ, Xing WR, Wu ZL, et al. A combination of three-dimensional printing and computer-assisted virtual surgical procedure for preoperative planning of acetabular fracture reduction[J]. Injury, 2016, 47(10): 2223–2227. DOI:10.1016/j.injury.2016.03.015 |
| [14] | Park JH, Lee Y, Shon OJ, et al. Surgical tips of intramedullary nailing in severely bowed femurs in atypical femur fractures:Simulation with 3D printed model[J]. Injury, 2016, 47(6): 1318–1324. DOI:10.1016/j.injury.2016.02.026 |
| [15] | Bizzotto N, Tami I, Tami A, et al. 3D Printed models of distal radius fractures[J]. Injury, 2016, 47(4): 976–978. DOI:10.1016/j.injury.2016.01.013 |
| [16] | 邹运, 韩青, 徐晓麟, 等. 3D打印光固化树脂模型在精确评估膝关节损伤及其个体化治疗方案制定中的应用[J]. 吉林大学学报:医学版, 2017, 43(1): 141–146. |
| [17] | Yang MY, Li C, Li YM, et al. Application of 3D rapid prototyping technology in posterior corrective surgery for lenke1 adolescent idiopathic scoliosis patients[J]. Medicine(Baltmore), 2015, 94(8): e582. |
| [18] | Tan H, Yang K, Wei P, et al. A novel preoperative planning technique using a combination of CT angiography and three-dimensional printing for complex toe-to-hand reconstruction[J]. Reconstr Microsurg, 2015, 31(5): 369–377. DOI:10.1055/s-00000029 |
| [19] | Hurson C, Tansey A, O'Donnchadha B, et al. Rapid prototyping in the assessment, classification and preoperative planning of acetabular fractures[J]. Injury, 2007, 38(10): 1158–1162. DOI:10.1016/j.injury.2007.05.020 |
| [20] | Li H, Wang L, Mao Y, et al. Revision of complex acetabular defects using cages with the aid of Rapid prototyping[J]. J Arthroplasty, 2013, 28(10): 1770–1775. DOI:10.1016/j.arth.2012.12.019 |
| [21] | Winder J, Bibb R. Medical rapid prototyping technologies:state of the art and current limitations for applications in oral and maxillofacial surgery[J]. J Oral Maxillofac Surg, 2005, 63(7): 1006–1015. DOI:10.1016/j.joms.2005.03.016 |
| [22] | Otawa N, Sumida T, Kitagaki H, et al. Custom-made titanium devices as membranes for bone augmentation in implant treatment:Modeling accuracy of titanium products constructed with selective laser melting[J]. J Cranio-maxillo-facial Surg, 2015, 43(7): 1289–1295. DOI:10.1016/j.jcms.2015.05.006 |
| [23] | Wu AM, Shao ZX, Wang JS, et al. The accuracy of a method for printing three-dimensional spinal models[J]. PLoS One, 2015, 10(4): e0124291. DOI:10.1371/journal.pone.0124291 |
| [24] | Chae MP, Lin F, Spychal RT, et al. 3D-printed haptic "reverse" models for preoperative planning in soft tissue reconstruction:a case report[J]. Microsurgery, 2015, 35(2): 148–153. DOI:10.1002/micr.v35.2 |
| [25] | 鲍跃, 姚青山, 阎龙, 等. 3D-CTA与3D-DSA在测量颅内动脉瘤方面的对比研究[J]. 中国实验诊断学, 2015, 19(7): 1141–1143. |
| [26] | 李佳乐, 夏轶超, 澈力格尔, 等. 三维打印双相磷酸钙陶瓷支架在骨组织工程中的应用[J]. 中国实验诊断学, 2017, 21(5): 878–881. |
 2017, Vol. 43
2017, Vol. 43


