扩展功能
文章信息
- 陈琼, 赵立君
- CHEN Qiong, ZHAO Lijun
- 有氧运动对老年男性单纯性肥胖患者血流动力学和运动能力的改善作用
- Improvement effect of aerobic exercise on haemodynamics and exercise endurance of male old patients with simple obesity
- 吉林大学学报(医学版), 2017, 43(05): 990-995
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 990-995
- 10.13481/j.1671-587x.20170525
-
文章历史
- 收稿日期: 2017-01-06
研究[1]发现:肥胖程度随年龄增长而升高。由于肥胖是高血压、糖尿病和血脂异常的独立危险因素[2],因此老年人因肥胖而伴发的各种心血管疾病和代谢性疾病的发生率明显增加。肥胖患者由于自主神经功能异常导致心脏负荷加重、外周阻力增加,血液动力学出现异常,表现为安静时和运动中的心率和血压水平升高,最终导致运动耐力下降,生活质量降低[3]。运动疗法特别是规律的有氧运动可有效改善肥胖患者身体成分并改善生活质量[4-5],但长期有氧训练对运动中的血液动力学参数的影响鲜有关注。本研究拟观察老年男性单纯性肥胖患者12周低强度有氧运动前后身体成分、运动耐力、安静时以及递增负荷运动实验中血液动力学参数的变化,为特异性运动康复方案制定提供理论依据。
1 资料与方法 1.1 研究对象选取2016年8—10月吉林省长春市富强社区老年男性188名,通过问卷调查等方式筛选单纯性肥胖患者。纳入标准:年龄>60周岁、体质量指数(body mass index,BMI)>28 kg·m-2的单纯性肥胖患者。排除标准:继发性以及药物性肥胖,患有心血管疾病、代谢性疾病以及骨关节疾病,吸烟饮酒,急慢性感染,半年内有规律运动习惯。将符合标准的46例单纯性肥胖患者按个人意愿与生活习惯分为对照组(n=19) 和运动组(n=27),对照组患者维持生活习惯不变,运动组患者则进行12周低强度有氧运动。患者自愿参加本研究,实验前签署知情同意书并保证按要求进行相关活动并完成全程观察。实验前2组患者在年龄、身高、体质量、BMI和最大吸氧量(maximal oxygen intake,VO2max)等基线变量之间比较差异均无统计学意义(P>0.05),表明2组间具有可比性。见表 1。
| (x±s) | ||||||
| Group | n | Age(year) | Height(l/m) | Weight(m/kg) | BMI(kg·m-2) | VO2max(mL·kg-1·min-1) |
| Control | 19 | 63.2±3.3 | 1.72±0.06 | 86.7±9.3 | 30.7±3.4 | 30.9±2.9 |
| Exercise | 27 | 65.5±3.9 | 1.73±0.07 | 90.5±8.4 | 29.1±4.2 | 32.5±3.6 |
患者于清晨(上午6:00~6:30) 空腹状态下进入标准运动生理学实验室,首先测定身高、体质量和安静时的血液动力学参数(心率和血压),体成分分析仪(Inbody 3.0,韩国)测定身体成分,就餐后2 h(上午8:30~9:00) 利用症状限制性递增负荷运动实验测定运动耐力并描绘运动过程中的心率曲线和血压曲线。测试结束后第2天运动组患者进行每周5次、共12周的有氧运动训练方案,对照组患者维持日常习惯。最后一次实验后24 h,所有患者返回实验室并重新测定上述参数。所有患者在各实验前48 h内清淡饮食,避免剧烈运动。
1.3 身体形态学参数测定利用体质测量组件测定身高、体质量并计算BMI,体质量计最大称重为200 kg,测量误差 < 0.1 kg,称重时要求轻装、赤足并排空大小便。利用体成分分析仪测定身体成分参数,包括脂肪质量(fat mass,FM)、瘦体质量(fat-free mass,FFM)和体脂百分比(per cent of body fat,PBF)。
1.4 血液动力学参数检测坐位休息5~10 min后佩戴遥测心率表(Polar FT1,芬兰)记录5 min心率,通过软件将5 min心率积分值换算为平均心率作为安静心率(heart rate,HR)。随后利用台式血压计(经校准)测量患者右上臂肱动脉血压,包括收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP),测量3次,每次间隔5~10 min,取均值作为安静血压。
1.5 运动能力测定利用瑞典产Monark 839E型功率自行车进行症状限制性递增负荷运动实验测定运动能力以及运动中的各血液动力学指标。具体方案:先进行10~15 min准备活动(慢跑和牵伸),然后佩戴气体代谢系统(Cortex Ⅱ,德国)、遥测心率表和台式血压计在功率车上适应性蹬车2 min(15 W),然后将起始负荷设定为30 W,每2 min递增30 W,保持60 r·min-1的转速。若患者在心率、血压、心电图等任一参数出现异常或主诉力竭时即终止实验。实验过程中测定摄氧量(VO2),每级负荷末记录血压和心率。实验结束时的VO2即为VO2max并记录最大功率(maximal power,MP)和力竭时间(exhaust time,ET)。整个过程由运动生理学专家指导以及2名急诊医师陪同(佩戴心电监护仪)下进行,若测试中出现心慌、胸闷、呼吸困难和面色苍白等不良症状时立即终止实验。
1.6 运动处方运动组患者进行每周5次,共12周低强度有氧运动,运动方式为跑步。运动总时间为每次1 h,其中热身与整理活动各10 min,正式训练部分40 min。运动强度为50%VO2max对应的心率,运动过程中佩戴遥测心率系统(Polar team2,芬兰),患者根据设定的靶心率及时调整运动负荷。
1.7 质量控制实验前,所有工作人员均接受系统专业知识和操作技能培训。同一指标多次测试由同一工作人员完成。运动过程中,始终采用心率表监控运动强度。通过健康教育以及物质奖励等方式保证研究对象均能按研究观察的要求进行运动(运动组)或不运动(对照组)。
1.8 统计学分析采用SPSS 17.0软件包进行统计学分析。各组患者基线变量(年龄、身高、体质量、BMI和VO2max)、血液动力学参数(HR、SBP和DBP)及运动能力参数(VO2max、MP和ET)等均以x±s表示,2组间比较采用两独立样本t检验,同组实验前后比较采用配对t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组患者身体成分实验前,2组患者身体成分参数比较差异无统计学意义(P>0.05)。与实验前比较,实验后运动组患者FM和BF%降低(P < 0.05),对照组患者身体成分各指标均无明显变化(P>0.05)。与对照组比较,实验后,运动组患者FM和BF%降低(P < 0.05)。见表 2。
| (x±s) | ||||||
| Group | n | Weight (m/kg) | BMI(kg·m-2) | FM (m/kg) | FFM (m/kg) | PBF (η/%) |
| Control | 19 | |||||
| Pre-test | 86.7±9.3 | 30.7±3.4 | 24.5±2.9 | 62.2±10.0 | 28.6±4.5 | |
| Post-test | 89.1±7.4 | 30.3±3.9 | 25.2±2.4 | 63.8±7.0 | 28.4±2.9 | |
| Exercise | 27 | |||||
| Pre-test | 90.5±8.4 | 29.1±4.2 | 26.3±3.2 | 64.3±9.8 | 29.3±5.0 | |
| Post-test | 88.1±5.5 | 29.5±3.7 | 22.3±1.7*△ | 65.8±4.8 | 25.4±1.6*△ | |
| *P < 0.05 compared with pre-test; △P < 0.05 compared with control group. | ||||||
实验前,2组患者安静时心率和血压比较差异无统计学意义(P>0.05)。与实验前比较,实验后运动组患者HR、SBP和DBP下降(P < 0.05),对照组均无明显变化(P>0.05)。与对照组比较,实验后运动组患者HR、SBP和DBP降低(P < 0.05)。见表 3。
| (x±s) | ||||
| Group | n | HR (min-1) | SBP(P/mmHg) | DBP(P/mmHg) |
| Control | 19 | |||
| Pre-test | 79±5 | 135±9 | 87±4 | |
| Post-test | 80±4 | 137±7 | 89±4 | |
| Exercise | 27 | |||
| Pre-test | 81±4 | 138±7 | 88±5 | |
| Post-test | 72±3*△ | 129±6*△ | 82±3*△ | |
| *P < 0.05 compared with pre-test; △P < 0.05 compared with control group. | ||||
实验后,运动组患者递增负荷实验中的心率曲线和血压曲线均发生右移,而对照组患者各曲线均无明显变化。见图 1~3。
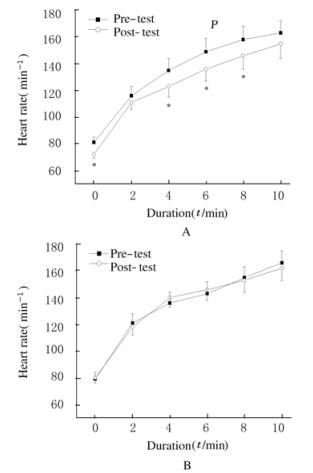
|
| A: Exercise group; B: Control group. *P < 0.05 compared with pre-test. 图 1 2组患者运动中心率曲线 Figure 1 Heart rate curves during exercise of patients in two groups |
|
|
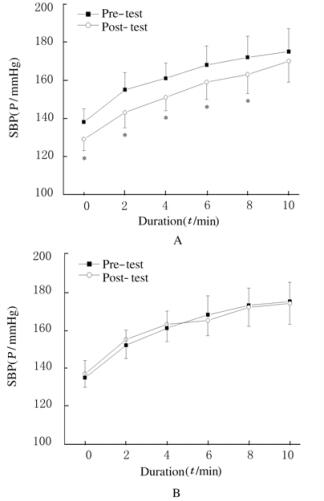
|
| A: Exercise group; B: Control group. *P < 0.05 compared with pre-test 图 2 2组患者运动中SBP曲线 Figure 2 SBP curves during exercise of patients in two groups |
|
|

|
| A: Exercise group; B: Control group. *P < 0.05 compared with pre-test 图 3 2组患者运动中DBP曲线 Figure 3 DBP curves during exercise of patients in two groups |
|
|
实验前,2组患者运动耐力各参数比较差异无统计学意义(P>0.05)。与实验前比较,实验后运动组患者VO2max、MP和ET升高(P < 0.05),对照组均无明显变化(P>0.05)。与对照组比较,实验后运动组患者VO2max、MP和ET升高(P < 0.05)。见表 4。
| (x±s) | ||||
| n | VO2max(mL·kg-1·min-1) | MP(W) | ET(t/s) | |
| Control | 19 | |||
| Pre-test | 30.5±3.0 | 150±12 | 528±51 | |
| Post-test | 29.2±3.3 | 148±11 | 506±65 | |
| Exercise | 27 | |||
| Pre-test | 32.6±2.3 | 146±10 | 512±43 | |
| Post-test | 36.5±2.5*△ | 158±9*△ | 589±50*△ | |
| *P < 0.05 compared with pre-test; △P < 0.05 compared with control group. | ||||
肥胖患者脂肪组织堆积,特别是腹腔和胸壁脂肪增厚导致膈肌升高而降低肺活量,肺通气不良,运动时易出现疲劳和呼吸困难等症状,造成运动能力特别是耐力水平降低,严重影响患者的生活质量。最近的一项大样本流行病学调查[6]发现:高血压患者心血管死亡率与运动耐力的相关性明显高于其他心血管危险因素,提示运动能力是心血管疾病患者预后的重要预测因素。本研究结果显示:实验后运动组患者脂肪质量和体脂百分比明显下降,VO2max、MP和ET升高,对照组患者各指标均无明显改变,提示规律有氧运动在有效改善体成分的同时增强了老年肥胖患者的运动耐力,进而降低心血管不良事件的发生率,改善生活质量。Nikseresht等[7]发现:经过长期训练(>6个月)后停训4~6周,通过规律体力活动获得的积极效应即逐渐减退。结合本研究结果本文作者建议老年肥胖患者应长期坚持规律的体力活动(以有氧运动为主)。
由于肥胖可导致外周血管阻力增加以及交感神经过度兴奋,因此安静时可发生血液动力学紊乱,心率和血压水平升高[8-10]。此外,运动中的心率和血压随运动强度的增加而升高[11],但肥胖患者运动时的心率和血压反应过高[12-13],即亚极量运动时的生理耐受程度下降,是导致运动耐力下降的重要原因之一。在本研究中,经过12周低强度有氧运动干预,运动组患者安静心率和血压下降,递增负荷实验中的心率和血压曲线右移,表明有氧运动在改善安静时血液动力学异常的同时对运动中的心率和血压反应也产生了积极的作用,即亚极量运动时的生理反应下降,运动耐力提高。
有氧运动改善血液动力学异常的机制尚不清楚,可能与脂肪含量下降有关。脂肪堆积造成糖脂代谢异常并发生胰岛素抵抗和继发性高胰岛素血症[14],高浓度的胰岛素可激活交感神经系统[15];脂肪组织作为内分泌器官可分泌炎症介质如白细胞介素(interleukin,IL)和肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α),后两者除间接激活交感神经外还可导致氧化损伤和炎症反应并造成内皮功能紊乱[16]。因此脂肪含量下降可抑制交感神经过度激活并改善内皮功能,安静时和运动中的心率和血压水平逐渐降低。此外,运动还可通过增加血管内血流切应力促进血管内皮细胞分泌一氧化氮(nitric oxide,NO)[17],NO具有改善血管内皮功能、舒张血管、降低外周阻力和心脏负荷等功效[18-20],推测运动诱导的NO增加也是肥胖患者血液动力学改善的原因之一。
综上所述,12周规律有氧运动可有效改善老年男性单纯性肥胖患者血液动力学异常,降低体脂百分比并增强运动耐力。
| [1] | Alfadda AA, Benabdelkamel H, Masood A, et al. Proteomic analysis of mature adipocytes from obese patients in relation to aging[J]. Exp Gerontol, 2013, 48(11): 1196–1203. DOI:10.1016/j.exger.2013.07.008 |
| [2] | Krzysztoszek J, Wierzejska E, Zielinska A. Obesity, an analysis of epidemiological and prognostic research[J]. Arch Med Sci, 2015, 11(1): 24–33. |
| [3] | Wang J, Sereika SM, Styn MA, et al. Factors associated with health-related quality of life among overweight or obese adults[J]. J Clin Nurs, 2013, 22(15/16): 2172–2182. |
| [4] | Moredich CA, Kessler TA. Physical activity and nutritional weight loss interventions in obese, low-income women:an integrative review[J]. J Midwifery Womens Health, 2014, 59(4): 380–387. DOI:10.1111/jmwh.12061 |
| [5] | Kitzman DW, Brubaker P, Morgan T, et al. Effect of caloric restriction or aerobic exercise training on peak oxygen consumption and quality of life in obese older patients with heart failure with preserved ejection fraction:a randomized clinical trial[J]. JAMA, 2016, 315(1): 36–46. DOI:10.1001/jama.2015.17346 |
| [6] | Faselis C, Doumas M, Panagiotakos D, et al. Body mass index, exercise capacity, and mortality risk in male veterans with hypertension[J]. Am J Hypertens, 2012, 25(4): 444–450. DOI:10.1038/ajh.2011.242 |
| [7] | Nikseresht M, Sadeghifard N, Agha-Alinejad H, et al. Inflammatory markers and adipocytokine responses to exercise training and detraining in men who are obese[J]. J Strength Cond Res, 2014, 28(12): 3399–3410. DOI:10.1519/JSC.0000000000000553 |
| [8] | Farah BQ, Prado WL, Tenrio TR, et al. Heart rate variability and its relationship with central and general obesity in obese normotensive adolescents[J]. Einstein (Sao Paulo), 2013, 11(3): 285–290. DOI:10.1590/S1679-45082013000300005 |
| [9] | 李光欣, 王占一, 吕薇, 等. 有氧运动对肥胖青少年心率变异性的影响[J]. 吉林大学学报:医学版, 2014, 40(5): 1093–1097. |
| [10] | Kwok SY, So HK, Choi KC, et al. Resting heart rate in children and adolescents:association with blood pressure, exercise and obesity[J]. Arch Dis Child, 2013, 98(4): 287–291. DOI:10.1136/archdischild-2012-302794 |
| [11] | Mortensen SP, Svendsen JH, Ersbøll M, et al. Skeletal muscle signaling and the heart rate and blood pressure response to exercise:insight from heart rate pacing during exercise with a trained and a deconditioned muscle group[J]. Hypertension, 2013, 61(5): 1126–1133. DOI:10.1161/HYPERTENSIONAHA.111.00328 |
| [12] | Abdelaal AA, Mohamad MA. Obesity indices and haemodynamic response to exercise in obese diabetic hypertensive patients:Randomized controlled trial[J]. Obes Res Clin Pract, 2015, 9(5): 475–486. DOI:10.1016/j.orcp.2014.11.001 |
| [13] | Dipla K, Kousoula D, Zafeiridis A, et al. Exaggerated hemodynamic and neural responses to involuntary contractions induced by whole-body vibration in normotensive obese versus lean women[J]. Exp Physiol, 2016, 101(6): 717–730. DOI:10.1113/EP085556 |
| [14] | Susilowati R, Sulistyoningrum DC, Witari NP, et al. Sexual dimorphism in interleukin 17A and adipocytokines and their association with insulin resistance among obese adolescents in Yogyakarta, Indonesia[J]. Asia Pac J Clin Nutr, 2016, 25(Suppl 1): S93–S101. |
| [15] | Curry TB, Hines CN, Barnes JN, et al. Relationship of muscle sympathetic nerve activity to insulin sensitivity[J]. Clin Auton Res, 2014, 24(2): 77–85. DOI:10.1007/s10286-014-0235-0 |
| [16] | Iacobellis G. Epicardial adipose tissue in endocrine and metabolic diseases[J]. Endocrine, 2014, 46(1): 8–15. DOI:10.1007/s12020-013-0099-4 |
| [17] | Mizuno M, Iwamoto GA, Vongpatanasin W, et al. Exercise training improves functional sympatholysis in spontaneously hypertensive rats through a nitric oxide-dependent mechanism[J]. Am J Physiol Heart Circ Physiol, 2014, 307(2): H242–H251. DOI:10.1152/ajpheart.00103.2014 |
| [18] | Vázquez-Torres A, Bäumler AJ. Nitrate, nitrite and nitric oxide reductases:from the last universal common ancestor to modern bacterial pathogens[J]. Curr Opin Microbiol, 2016, 29: 1–8. DOI:10.1016/j.mib.2015.09.002 |
| [19] | 孙漾丽, 白起君. 有氧运动对老年顽固性高血压患者心血管自主神经功能的影响[J]. 中国老年学杂志, 2015, 35(10): 4600–4602. |
| [20] | 王衍皓, 谭纳宇, 于泽洋, 等. 急性脑梗死患者TICI脑血流动力学评估临床研究[J]. 中国实验诊断学, 2017, 21(2): 191–193. |
 2017, Vol. 43
2017, Vol. 43


