扩展功能
文章信息
- 崔银星, 孔菲, 赵旭, 高普均
- CUI Yinxing, KONG Fei, ZHAO Xu, GAO Pujun
- O-GlcNAc转移酶在肝细胞癌组织中的表达及其临床意义
- Expression of O-GlcNAc transferase in hepatocellular carcinoma tissue and its clinical significance
- 吉林大学学报(医学版), 2017, 43(05): 980-984
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 980-984
- 10.13481/j.1671-587x.20170523
-
文章历史
- 收稿日期: 2017-04-18
2. 吉林大学第一医院肝胆胰内科, 吉林 长春 130021
2. Department of Hepatobiliary, First Hospital, Jilin University, Changchun 130021, China
原发性肝癌是常见恶性肿瘤,原发性肝细胞癌(hepatocellular carcinoma, HCC)是其最常见的病理类型,约占原发性肝癌90%以上,其发病率居全球恶性肿瘤发病率第6位,病死率居全球恶性肿瘤死亡率的第3位[1]。中国是HCC发病率最高的国家,其发病率和病死率均占全球的50%以上[2]。HCC具有高死亡率和预后差等特点,其原因可能与HCC早期诊断、检查方法尚不完善有关,因此寻找HCC新的诊断靶点是目前研究的重点。氧连氮-乙酰葡萄糖胺转移酶(O-linked β-N-acetylglucosamine transferase, OGT)是参与氧连氮-乙酰葡萄糖胺(O-linked β-N-acetylglucosamine, O-GlcNAc)糖基化修饰的关键酶。O-GlcNAc糖基化修饰是指单个N-乙酰葡糖胺以O-糖苷键与蛋白质的丝氨酸或苏氨酸的羟基相连,其广泛存在于细胞核及细胞质中,是一种动态的、可诱导的蛋白质翻译后修饰方式[3-4],参与翻译、信号转导、蛋白酶解等多种生物学过程的调控。OGT最早发现于肝脏,人体内有3种不同的亚型[5],每种亚型在不同细胞和组织中的表达水平有差异,不同的亚型可能有不同的功能[6]。OGT催化O-GlcNAc糖基化反应,其表达水平与细胞功能有关,在实验中沉默OGT之后,氨基酸代谢、线粒体功能、应激反应和老化等相关的基因表达受到影响[7]。有研究[8-11]表明:异常的O-GlcNAc修饰与多种肿瘤密切相关,如乳腺癌、结肠癌、胰腺癌和喉癌等肿瘤组织中OGT表达水平明显升高。研究[12]表明:OGT在非酒精性肝癌中表达水平升高,OGT通过激活棕榈酸诱导的内质网应激影响肝细胞癌的发展。OGT在HCC中表达情况的研究尚少,本研究利用蛋白免疫印迹法及酶联免疫吸附试验(ELISA)检测HCC患者体内OGT表达情况,为后续实验中寻找HCC新的诊断靶点和治疗方法奠定理论基础。
1 资料与方法 1 研究对象选择2005—2007年韩国加图立大学首尔圣母医院手术切除的HCC组织和相对应癌旁组织20例,其中男性14例,女性6例,患者年龄(55.9±16.1) 岁。入选标准:① 术后病理学证实为HCC;② 术前均未接受诸如放化疗和射频消融(RFA)等抗肿瘤治疗。选取2012年韩国加图立大学首尔圣母医院收治的肝硬化及肝癌患者血清标本20例,其中男性15例,女性5例,患者年龄(51.4±17.6) 岁。同时选取健康志愿者血清标本20名,其中男性11名,女性9名,平均年龄(49.3±12.7) 岁。所有患者均签署知情同意书,本研究已获得韩国生命伦理审核委员会批准。实验所用的8例肝癌细胞株即HepG2、Huh7、Hep3B、C3A、PLC、SK-Hep1、SNU449和SNU475均由韩国加图立大学WHO肝炎研究所培养。研究对象在年龄、性别构成方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 主要试剂和仪器鹅抗兔OGT单克隆抗体、辣根过氧化物酶标记鹅抗兔IgG和辣根过氧化物酶标记鹅抗鼠IgG购自美国Santa Cruz公司,鼠抗人β-actin单克隆抗体购自美国Sigma公司,正常人肝细胞裂解物购自英国Abcam公司,标准蛋白参照物Marker购自美国PIERCE公司,ECL发光试剂和ELISA试剂盒购自美国Bio-Rad公司,硝酸纤维素膜转印膜购自英国Whatman公司。图像分析软件(Quantity One)和酶标仪(iMark)购自美国Bio-Rad公司。
1.3 Western blotting法检测肝癌组织及其癌旁组织中OGT蛋白表达从冰冻肝细胞癌组织和相对应癌旁肝组织标本中取约20 mg的组织块,加入0.5 mL裂解液,匀浆10 min进行裂解后加1 mL组织抽提试剂充分混匀后室温静置10 min,4℃、13 000r·min-1离心10 min,取上清液分装于EP管中于-80℃保存。用考马斯亮蓝法,利用酶标仪测定吸光度(A)值,绘制标准曲线,计算各标本蛋白浓度,制作样本。提取样本经SDS-PAGE电泳分离后,转印至硝酸纤维素膜(100 V, 90 min),50 g·L-1脱脂奶粉室温封闭1 h,经TBST(20 mmol·L-1 Tris-HCl,500 mmol·L-1 NaCl,0.5 mL·L-1 Tween-20) 冲洗3次,加入稀释的OGT单克隆抗体(1:500) 和β-actin单克隆抗体(1:1 000) 置4℃孵育过夜后,弃去一抗,TBST洗膜3次,加入稀释的鹅抗兔IgG(1:5 000) 和鹅抗鼠IgG(1:5 000),室温孵育2h,TBST洗3次,用显色试剂(ECL)覆盖膜后,用图像分析软件显像并测定各样本显色的灰度,以β-actin作为内对照,以目的蛋白与β-actin的蛋白产物条带灰度值之比作为蛋白相对表达水平。
1.4 Western blotting法检测肝癌细胞株及正常人肝细胞裂解物中OGT蛋白表达将处于生长期的细胞弃去培养液,用预冷的PBS洗3次,每瓶细胞加入500μL细胞裂解液,冰上放置30 min进行裂解后用细胞刮刀刮下细胞,将细胞及裂解液移入1.5mL EP管中,4℃、12 000r·min-1离心20 min。吸出上清液,移入新的EP管中,-80℃冰箱保存。后利用上述方法制备样本及行Western blotting法检测,用图像分析软件显像并测定各样本显色的灰度,以β-actin作为内参,以目的细胞株与β-actin的蛋白产物条带灰度值之比作为蛋白相对表达水平。
1.5 ELISA法检测血清OGT表达水平全血样本在室温自然凝固20 min后,3000r·min-1离心15 min,收集上清液。采用改良过碘酸钠法制备酶标抗体,利用ELISA试剂盒依次经过加样、加酶标抗体、显色和终止反应等步骤完成实验,并利用酶标仪在450nm波长处测定各孔的A值。
1.6 统计学分析采用Excel表格收集整理数据,采用SPSS18.0软件进行数据统计分析。组织、细胞和血清中OGT蛋白表达水平以x±s表示,灰度差异率以例数(百分数表示)。多组间样本均数比较采用单因素方差分析,两组间样本均数比较采用两独立样本t检验。以P<0.05表示差异有统计学意义。
2 结 果 2.1 Western blotting法检测HCC肿瘤组织及其癌旁组织中OGT蛋白表达水平Western blotting电泳结果显示:OGT在HCC肿瘤组织及相应癌旁组织中均有表达,HCC肿瘤组织OGT蛋白表达水平灰度值为2.38±2.06,癌旁组织为1.67±1.63,20例样本中13例(65%)患者肿瘤组织条带灰度值高于相应癌旁组织(P < 0.05)。见图 1。
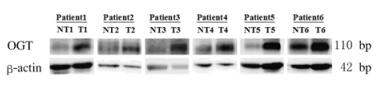
|
| 图 1 Western blotting法检测HCC肿瘤组织和相对应癌旁组织中OGT蛋白表达电泳图 Figure 1 Electrophoregram of expressions of OGT protein in HCC tissue and non-tumor tissue detected by Western blotting method |
|
|
Western blotting法电泳结果检测显示:OGT在肝细胞癌株及正常人肝细胞裂解物中均有表达,8例肝癌细胞株中OGT蛋白表达水平灰度值为2.62±1.05,正常人肝细胞裂解物为0.33±0.21,8例肝癌细胞株中条带灰度均高于正常人肝细胞裂解物(P < 0.05)。见图 2。
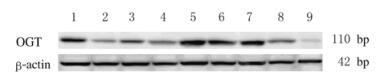
|
| Lane 1:Hun7;Lane 2:HepG2;Lane 3:Hep3B;Lane 4:C3A;Lane 5:PLC; Lane 6:SK-Hepl; Lane 7:SNU449;Lane 8:SNU475;Lane 9:Normal liver cell lysate 图 2 Western blotting法检测肝癌细胞株及正常人肝细胞裂解物中OGT蛋白表达电泳图 Figure 2 Electrophoregram of expressions of OGT protein in HCC cell strain and normal liver(human) cell lysate detected by Western blotting method |
|
|
20例肝硬化患者血清中OGT蛋白表达水平为0.210±0.028,明显高于健康志愿者(0.157±0.014,P < 0.05),同时肝癌患者血清中OGT表达水平(0.225±0.020) 明显高于健康志愿者(P < 0.05),但肝硬化患者及肝癌患者血清中OGT表达水平比较差异无统计学意义(P>0.05)。
3 讨论肝癌属于常见的消化道恶性肿瘤,是全球癌症相关死亡的第二大原因,每年约85万例新发病例,HCC约占所有原发性肝癌病例的90%[13]。虽然随着对肿瘤的基础研究和分子生物学技术的发展,人类对肝癌的诊断已经取得了长足进步[14-15],但是肝癌的发病机制尚不明确,早期诊断尚缺乏明确的标准,因此肝癌患者的生存率仍然很低,仅为6~20个月[16]。研究肝癌新的诊断靶点,可为肝癌的诊断和治疗提供参考依据。
蛋白质的O-GlcNAc糖基化修饰参与细胞的多种生命活动,并在多种疾病的发生发展中发挥重要作用。近年来,肿瘤组织中蛋白质O-GlcNAc修饰水平的研究受到关注。研究[17]表明:O-GlcNAc糖基化修饰参与不同的细胞应激,而肿瘤细胞的生长受到多种应激刺激的影响,包括活性氧、营养缺乏和缺氧等。蛋白质O-GlcNAc糖基化修饰水平及OGT、OGA表达水平的研究目的主要是为了找寻能够早期识别并诊断肿瘤的一项指标。目前研究[8-11]表明:在大部分恶性肿瘤中恶性程度高的组织中蛋白质O-GlcNAc修饰水平和OGT蛋白表达水平高于恶性程度低的组织,但目前国内尚缺少OGT在HCC中的研究。
本研究采用Western blotting法检测HCC患者肿瘤组织及相应瘤旁组织OGT蛋白表达量,结果显示:在20例原发性HCC患者中,肿瘤组织中OGT蛋白表达水平明显高于相应癌旁组织。同时利用Western blotting法鉴定8例肝癌细胞株及正常人肝细胞裂解物中OGT蛋白表达情况发现:8例肝癌细胞株中OGT蛋白表达水平均明显高于正常人肝细胞裂解物。本实验结果与O-GlcNAc糖基化修饰在肝脏移植后肝癌复发的实验结果相一致[18]。本研究采用ELISA法测定健康志愿者、肝硬化患者及HCC患者血清中OGT表达情况发现:肝癌及肝硬化患者血清中OGT表达水平均高于健康志愿者,进一步认证了OGT表达水平在大部分肿瘤组织中表达增高的实验结果,待进一步扩大样本量验证,OGT可能成为肝细胞癌新的诊断靶点。
而ELISA法检测结果显示:HCC患者血清中OGT表达水平及肝硬化患者血清中的表达水平均升高,但差异无统计学意义,这可能与此次实验样本例数少有关。在肝硬化患者中OGT表达水平升高趋势提示OGT与肝细胞的破坏及肝病的发生发展有关。本研究缺乏肝癌组织中O-GlcNAc修饰水平及OGA表达情况,而研究发现O-GlcNAc修饰及OGA表达水平会在肿瘤中发生变化,因此肝癌组织中O-GlcNAc修饰及OGA表达水平有待进一步研究。
O-GlcNAc修饰在某些细胞迁移过程的调节中发挥作用。此次实验未研究O-GlcNAc修饰对肝癌细胞迁移能力的影响,但证明了肝癌细胞及组织中OGT表达水平升高,OGT是O-GlcNAc修饰中的关键酶,在大部分肿瘤中OGT表达水平与O-GlcNAc修饰水平呈正比,考虑为O-GlcNAc修饰可能通过一些机制影响肝癌的发生发展。在肿瘤的发生发展过程中,肿瘤细胞受到如缺氧、营养缺乏等多种应激反应的影响,而O-GlcNAc修饰参与多种应激反应。因此,抑制OGT表达水平及O-GlcNAc修饰有待成为肝细胞癌新的治疗方法之一。
1963年以来,肝脏移植成为HCC治疗的主要手段,但其效果并不理想[19]。肝癌的复发转移率较高,而侵袭性转移是肝癌患者预后差的主要原因之一[20-23],因此研究延缓或阻止侵袭性转移,找到肝脏移植后的治疗手段成为肝细胞癌研究的重要课题。曾有研究[18]表明:肝癌组织OGT表达水平明显高于正常肝组织,同时肝癌患者肝移植术后肿瘤发生复发转移的患者的肝癌组织中O-GlcNAc修饰水平明显高于无复发转移的患者。考虑为随着O-GlcNAc修饰水平的升高,肝癌细胞的恶性程度升高。考虑O-GlcNAc修饰水平及OGT蛋白表达水平对HCC早期诊断和治疗均有较强的参考性,其O-GlcNAc修饰、OGT的表达对肝细胞癌的发生、发展及预后等方面的内容还需要进一步的深入研究。
综上所述,本研究采用分子生物学方法检测OGT在HCC组织中的表达情况,为后续实验中找出肝细胞癌诊断靶点和新的治疗方法奠定了理论基础。
| [1] | Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005[J]. CA Cancer J Clin, 2005, 55(1): 10–30. DOI:10.3322/canjclin.55.1.10 |
| [2] | 刘会春. 中国原发性肝癌治疗指南解读[J]. 肝胆外科杂志, 2013, 21(1): 12–14. |
| [3] | Wells L, Vosseller K, Hart GW. Glycosylation of nucleocytoplasmic proteins:signal transduction and O-GlcNAc[J]. Science, 2001, 291(5512): 2376–2378. DOI:10.1126/science.1058714 |
| [4] | Iyer SP, Hart GW. Roles of the tetratricopeptide repeat domain in O-GlcNAc transferase targeting and protein substrate specificity[J]. J Biol Chem, 2003, 278(27): 24608–24616. DOI:10.1074/jbc.M300036200 |
| [5] | Haltiwanger RS, Blomberg MA, Hart GW. Glycosylation of nuclear and cytoplasmic proteins. Purification and characterization of a ur-idine diphospho-N-acetylglucosamine:polypeptide beta-N-acetylgluco-saminyltransferase[J]. J Biol Chem, 1992, 267(13): 9005–9013. |
| [6] | Kreppel LK, Blomberg MA, Hart GW. Dynamic glycosylation of nuclear and cytosolic proteins. Cloning and characterization of a unique O-GlcNAc transferase with multiple tetratricopeptide repeats[J]. J Biol Chem, 1997, 272(14): 9308–9315. DOI:10.1074/jbc.272.14.9308 |
| [7] | Vaidyanathan K, Durning S, Wells L. Functional O-GlcNAc modifications:implications in molecular regulation and pathophysiology[J]. Crit Rev Biochem Mol Biol, 2014, 49(2): 140–163. DOI:10.3109/10409238.2014.884535 |
| [8] | Huang X, Pan Q, Sun D, et al. O-GlcNAcylation of cofilin promotes breast cancer cell invasion[J]. J Biol Chem, 2013, 288(51): 36418–36425. DOI:10.1074/jbc.M113.495713 |
| [9] | Yehezkel G, Cohen L, Kliger A, et al. O-linked β-N-acetylglucosaminylation (O-GlcNAcylation) in primary and metastatic colorectal cancer clones and effect of N-acetyl-β-D-glucosaminidase silencing on cell phenotype and transcriptome[J]. J Biol Chem, 2012, 287(34): 28755–28769. DOI:10.1074/jbc.M112.345546 |
| [10] | Ma Z, Vocadlo DJ, Vosseller K. Hyper-O-GlcNAcylation is anti-apoptotic and maintains constitutive NF-κB activity in pancreatic cancer cells[J]. J Biol Chem, 2013, 288(21): 15121–15130. DOI:10.1074/jbc.M113.470047 |
| [11] | Starska K, Forma E, Brzezińska-Blaszczyk E, et al. Gene and protein expression of O-GlcNAc-cycling enzymes in human laryngeal cancer[J]. Clin Exp Med, 2015, 15(4): 455–468. DOI:10.1007/s10238-014-0318-1 |
| [12] | Xu W, Zhang X, Wu JL, et al. O-GlcNAc transferase promotes fatty liver-associated liver cancer through inducing palmitic acid and activating endoplasmic reticulum stres[J]. J Hepatol, 2017. DOI:10.1016/j.jhep |
| [13] | Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018. DOI:10.1038/nrdp.2016.18 |
| [14] | Ang C, Miura JT, Gamblin TC, et al. Comprehensive multiplatform biomarker analysis of 350 hepatocellular carcinomas identifies potential novel therapeutic options[J]. J Surg Oncol, 2016, 113(1): 55–61. DOI:10.1002/jso.v113.1 |
| [15] | Hong SW, Hur W, Choi JE, et al. Role of ADAM17 in invasion and migration of CD133-expressing liver cancer stem cells after irradiation[J]. Oncotarget, 2016, 7(17): 23482–23497. DOI:10.18632/oncotarget.v7i17 |
| [16] | Byam J, Renz J, Millis JM. Liver transplantation for hepatocellularcarcinoma[J]. Hepatobiliary Surg Nutr, 2013, 2(1): 22–30. |
| [17] | Sohn KC, Lee KY, Park JE, et al. OGT functions as a catalytic chaperone under heat stress response:a unique defense role of OGT in hyperthermia[J]. Biochem Biophys Res Commun, 2004, 322(3): 1045–1051. DOI:10.1016/j.bbrc.2004.08.023 |
| [18] | Zhu Q, Zhou L, Yang Z, et al. O-GlcNAcylation plays a role in tumor recurrence of hepatocellular carcinoma following liver transplantation[J]. Med Oncol, 2012, 29(2): 985–993. DOI:10.1007/s12032-011-9912-1 |
| [19] | Starzl TE, Marchioro TL, Vonkaulla KN, et al. Homotransplantation of the liver in humans[J]. Surg Gynecol Obstet, 1963, 117: 659–676. |
| [20] | Carr BI. Hepatocellular carcinoma:current management and future trends[J]. Gastroenterology, 2004, 127(5 Suppl 1): S218–224. |
| [21] | 沈芝南, 卢军华. 肝细胞癌相关分子靶向治疗研究进展[J]. 临床肝胆病杂志, 2015, 31(1): 130–134. |
| [22] | 杨霄霄, 马红. 肝细胞癌肿瘤标志物的研究进展[J]. 临床肝胆病杂志, 2016, 32(4): 811–815. |
| [23] | 刘佳, 朱琴梅, 胡弘毅, 等. Hedgehog信号在肝细胞癌发生发展中的作用[J]. 临床肝胆病杂志, 2015, 31(2): 300–304. |
 2017, Vol. 43
2017, Vol. 43


