扩展功能
文章信息
- 赛依帕, 宋元春, 刘璟, 赵海燕
- SAI Yipa, SONG Yuanchun, LIU Jing, ZHAO Haiyan
- 淫羊藿苷联合胚胎干细胞对造影剂肾病大鼠模型肾上皮细胞凋亡的影响
- Effect of icariine combined with embryonic stem cells on apoptosis of kidney epithelial cells in contrast-induced nephropathy rat models
- 吉林大学学报(医学版), 2017, 43(05): 953-957
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 953-957
- 10.13481/j.1671-587x.20170518
-
文章历史
- 收稿日期: 2016-12-08
造影剂肾病(contrast-induced nephropathy,CIN)是由于使用含碘造影剂引起的肾病,急性肾衰竭为其主要表现。CIN发病机制复杂,研究[1-2]表明:肾小管上皮细胞的直接损伤和凋亡是CIN病理过程发生发展的主要机制。使用阿托伐他汀是临床预防CIN的常用方法,虽然有一定的疗效,但仍不满意。随着中医学的发展,中西医结合治疗方法逐渐应用于CIN的预防中。淫羊藿具有补肾阳、强筋骨和祛风湿的功效,《本草纲目》中记载其有“益精气,坚筋骨,补腰膝,强心力”之效用,现代药理学研究[3-5]表明:淫羊藿主要活性成分淫羊藿苷具有增强免疫功能、抗心肌细胞凋亡和抗肾脏肾纤维化等作用。研究[6]显示:干细胞可以促进肾脏的修复,通过下调炎症因子和上调抗炎症因子,促进肾小管细胞的转分化、增生,达到修复的目的。胚胎干细胞(embryonic stem cells, ESCs)是最原始干细胞,具有分化全能性的潜能以及体外培养无限增殖和低免疫原性的特点,并有自我更新和多向分化的特性[6]。目前已有研究对胚胎干细胞进行诱导分化后,成功使其转化为多种终末组织细胞,为细胞和器官移植等技术的发展提供了资源[7-10]。本实验结合了CIN发生机制的现状,并结合相关中医中药学的认识,通过探讨淫羊藿苷联合胚胎干细胞治疗CIN大鼠模型,阐明联合用药的治疗效果,为临床治疗CIN提供实验数据及理论依据。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器SPF级SD大鼠50只,雄性,体质量(180±20) g,购自甘肃省实验动物中心,动物合格证号:SCXK(甘)2013-0002。淫羊藿苷购自陕西慧科生物股份有限公司。胚胎干细胞来源:甘肃省实验动物中心的受孕大鼠,在无菌条件下获取胚胎,去除包膜,获得实验材料,制备成浓度为1.0×104 mL-1的单细胞作为供体。吲哚美辛(INDO)、N-硝基-LO-精氨酸甲酯(L-NAME, 美国Sigma公司),泛影葡胺(上海旭东海普药业有限公司),BCA蛋白浓度测定试剂盒(美国Thermo fisher公司),p38MAPK、caspase3和β-actin抗体(美国Cell Signaling Technology公司),相关引物由华大基因合成,其他试剂为国产分析纯。纯水仪(美国Millipore公司), 超低温冰箱(美国Forma Scientific公司), 全自动生化分析仪(美国Beckman Couliter公司),Leica DMI4000B显微镜(日本Olympus公司),ESP ELITE型流式细胞仪(美国Couliter公司),核酸电泳仪、蛋白垂直电泳仪和凝胶成像系统(美国Bio-Rad公司)。
1.2 CIN大鼠模型建立参照文献[11]方法建立CIN大鼠模型,大鼠造模前12 h禁水,自由进食。称体质量后按照0.32 mL·100 g-1腹腔注射10%水合氯醛麻醉,用酒精消毒后分离左股静脉,埋置留置针并固定,每15 min分别通过由大鼠尾静脉注射INDO(10 mg·kg-1)、L-NAME(10 mg·kg-1)和76%泛影葡胺(10 mL·kg-1)。
1.3 实验动物分组50只SD大鼠随机分为对照组(n=10) 和造模组(n=40);40只造模组大鼠制备CIN模型后再随机分为模型组、淫羊藿苷组、干细胞组和联合给药组,每组10只。于造模成功后第4周末处死大鼠。
1.4 药物干预淫羊藿苷组和干细胞组大鼠分别于造模当天通过尾静脉注射淫羊藿苷溶液(12 mg·kg-1)和胚胎干细胞DMEM培养液1 mL,联合给药组大鼠先通过尾静脉注射给予胚胎干细胞DMEM培养液1 mL后,尾静脉注射淫羊藿苷溶液(12 mg·kg-1),连续给药3 d。
1.5 各组大鼠活动情况和血肌酐(Scr)水平检测于造模前、造模后48 h及第4周实验结束时经大鼠眼眶静脉丛采血,离心后分离上清液,采用全自动生化分析仪测定Scr水平。
1.6 半定量RT-PCR法检测凋亡通路相关基因表达水平取部分组织标本,称质量后用液氮冷冻,用Trizol试剂提取法抽提总RNA,再反转录为cDNA,进行PCR反应,检测的相关基因为p38MAPK、caspase3和β-actin,其中β-actin为内参基因,所用引物序列参考文献[12]。PCR产物用1%琼脂糖凝胶电泳检测。
1.7 Western blotting法检测凋亡通路相关因子表达水平组织标本切片称质量,粉碎,加入组织裂解液提取蛋白,用BCA试剂盒进行蛋白定量。每组取30 μg蛋白进行SDS-PAGE,经转印后分别检测p38MAPK、caspase3和β-actin(内参)等蛋白表达,将显影得到的条带用Quantity One软件进行灰度分析。
1.8 流式细胞术检测肾上皮细胞凋亡率取肾组织适量,用70%乙醇固定,置于120目不锈钢网上,将组织剪碎,轻轻揉搓,用生理盐水冲洗、过滤,并收集细胞悬液,离心沉淀,用预冷PBS冲洗后,加500 μL Bingding Buffer悬浮细胞,加5 μL AnnexinⅤ-FITC混匀后,4℃避光孵育15 min,再加入PI 5 μL混匀,室温避光反应5~15 min,1 h内上机检测细胞凋亡率。
1.9 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠Scr水平和细胞凋亡率以x±s表示,组间比较采用双因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠活动状态和Scr水平对照组大鼠活动自如,模型组大鼠于注射造影剂48 h后活动减少。与对照组(29.21cg·L-1±4.08cg·L-1)比较,模型组大鼠Scr值(77.53cg·L-1±8.39cg·L-1)明显升高(P<0.05), 提示造模成功,造模过程中大鼠未出现死亡;与模型组比较,联合给药组给药后48 h后Scr值(37.05cg·L-1±5.28cg·L-1)有所下降,差异有统计学意义(P<0.05),淫羊藿苷组(59.52cg·L-1±8.24cg·L-1)和干细胞组(42.07cg·L-1±4.84cg·L-1)Scr值均有所下降(P < 0.05),介于模型组和联合给药组之间。
2.2 各组大鼠肾组织中caspase3和p38MAPK mRNA表达淫羊藿苷组、干细胞组及联合给药组大鼠肾组织中caspase3和p38MAPK mRNA表达水平明显降低,且干细胞组p38MAPK和caspase3的电泳条带均暗于淫羊藿苷组,联合给药组p38MAPK和caspase 3的条带在3个治疗组中表达最低。见图 1。
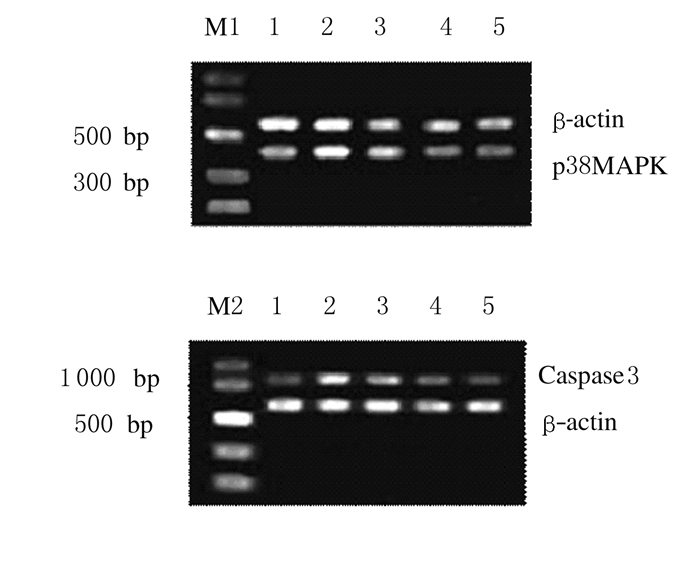
|
| M1:DL1200;M2:DL 2 000;Lane 1:Control group; Lane 2:Model group; Lane 3:Icariin group; Lane 4:Stem cell group; Lane 5:Combination group. 图 1 各组大鼠肾组织中p38MAPK和caspase3 mRNA表达电泳图 Figure 1 Electrophoregram of expressions of p38MAPK and caspase3 in kidney tissue of rats in various groups |
|
|
p38MAPK和caspase3蛋白出现条带,柱状图结果为各组蛋白表达水平相对于对照组为参照值1的倍数。对照组大鼠肾组织蛋白少量表达,CIN模型组表达水平明显增强,不同治疗组凋亡相关因子p38MAPK和caspase3蛋白的表达水平均明显降低(P < 0.05或P < 0.01);与淫羊藿苷组和干细胞组比较,联合给药组p38MAPK和caspase3蛋白表达水平明显降低(P < 0.05)。见图 2。
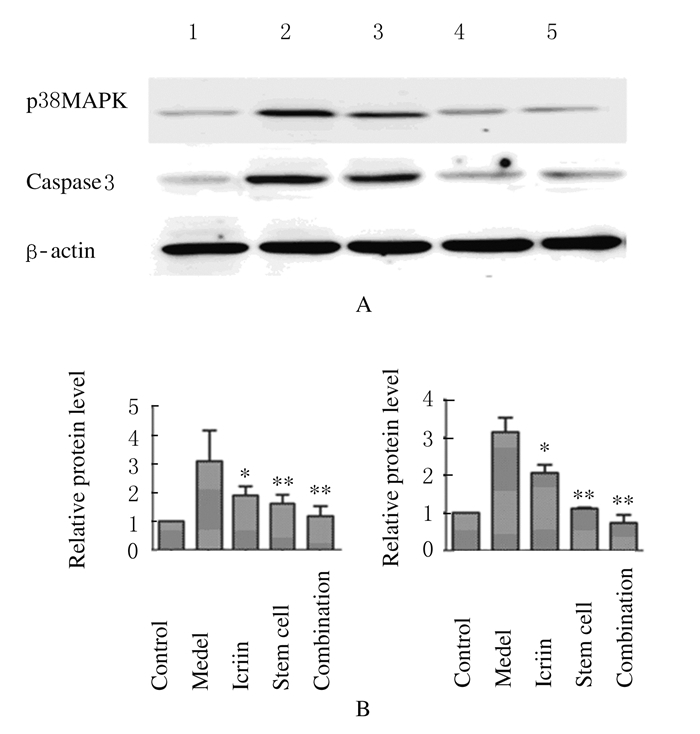
|
| Lane1:Control group; Lane 2:Model group; Lane 3:Icariin group; Lane 4:Stem cell group; Lane 5:Combination group. 图 2 各组大鼠肾组织中p38MAPK和caspase3蛋白表达电泳图(A)和直条图(B) Figure 2 Electrophoregram(A) and histogram(B) of expressions of p38MAPK and caspase3 protein in kidney tissue of rats in various groups |
|
|
流式细胞术检测结果显示:对照组大鼠肾上皮细胞凋亡率为(4.31±1.75)%,模型组为(42.34±7.58)%,淫羊藿苷组为(21.1±5.52)%,干细胞组为(13.87±6.43)%,联合给药组为(5.41±3.47)%。与对照组比较,模型组大鼠细胞凋亡率明显升高(P < 0.05);与模型组比较,淫羊藿苷组、干细胞组和联合给药组大鼠细胞凋亡率明显降低(P < 0.05);与淫羊藿苷组和干细胞组比较,联合给药组大鼠细胞凋亡率明显降低(P < 0.05)。表明联合给药组细胞凋亡的抑制作用最佳。见图 3。
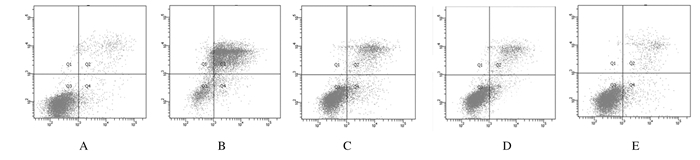
|
| A:Control group; B:Model group; C:Icariin group; D:Stem cell group; E:Combination group. 图 3 流式细胞术检测各组大鼠肾小管上皮细胞凋亡情况 Figure 3 Apoptosis of renal tubular epithelial cells of rats in various groups detected by flow cytometry |
|
|
目前,对于CIN的判断标准主要是造影剂应用48 h后无其他可解释原因的急性肾功能衰竭,通常以Scr值比使用前提高44 μmol·L-1或升高25%为标准[13]。本研究采用Goodman等[11]的造模方法,造模组于48 h测得Scr明显升高,提示造模成功。
CIN的发病机制较为复杂,目前研究水平仍无法阐明原因。近年来,有许多关于细胞因子介导肾小球足细胞凋亡的报道,caspase3是氧化应激引起足细胞凋亡的重要因子[14-15],而p38MAPK则是作为信号通路转导的交汇点,可被多种外刺激活化,对细胞生长、增殖和分化起调控作用[16-17]。Schiffer等[18]研究证实:TGF-β1刺激肾小球足细胞,于20 min时p38MAPK开始被激活,8 h内持续磷酸化;caspase3于6 h开始被激活。caspase3处于p38MAPK下游,激活p38MAPK会引起caspase3的活化。故本研究中以p38MAPK和caspase3 mRNA和蛋白的表达为检测指标。
本研究探讨淫羊藿苷联合胚胎干细胞对CIN模型的治疗作用,各治疗组的Scr均有所下降,其中联合给药组下降幅度最大;对细胞凋亡通路相关因子mRNA和蛋白表达的检测结果表明:不同治疗组较造模组有所下调,且联合给药组下调幅度最大,表明联合治疗组对P38MAPK和caspase3的表达有较强抑制作用。本研究流式细胞术检测结果表明:淫羊藿联合胚胎干细胞对肾小管上皮细胞凋亡的抑制作用在3个治疗组中最佳,表明其对肾病模型大鼠的肾上皮细胞有治疗作用,其作用机制可能与抑制细胞凋亡通路中相关因子有关。本研究较传统方法而言,联合胚胎干细胞具有很大优势,但对其研究只处于实验室阶段,后续将对淫羊藿和胚胎干细胞生物学特性和作用机制进行深入的了解和探究。
| [1] | Wichmann JL, Katzberg RW, Litwin SE, et al. Contrast-induced nephropathy[J]. Circulation, 2015, 12, 132(20): 1931–1936. |
| [2] | Gong XZ, Celsi G, Carlsson K, et al. N-acetylcysteine amide (NACA) protects renal proximal tubular epithelial cells against iohexol induced apoptosis by blocking p38MAPK/iNOS signaling[J]. Am J Nephrol, 2010, 31(2): 178–188. DOI:10.1159/000268161 |
| [3] | 国家药典委员会. 中国药典[M]. 北京: 中国医药科技出版社,2015. |
| [4] | 南敏伦, 李世财, 赵昱玮, 等. 淫羊藿苷元制备方法及药理活性研究进展[J]. 中国实验方剂学杂志, 2015, 7: 227. |
| [5] | 王焕珍, 柴艺汇, 陈云志, 等. 淫羊藿化学成分与药理作用研究进展[J]. 亚太传统医药, 2016, 12(7): 63–65. DOI:10.11954/ytctyy.201607024 |
| [6] | Rossant J. Stem cells from the mammalian blastocyst[J]. Stem Cells, 2001, 19(6): 477–482. DOI:10.1634/stemcells.19-6-477 |
| [7] | Lewis K, Falconer K. Human pluripotent stem-cell-derived cardiomyocytes in cardiovascular drug discovery and development[J]. Bio Discovery, 2015, 16(1): 1–9. |
| [8] | Katsuda T, Oki K, Ochiya K. Potential application of extracellular vesicles of human adipose tissue-derived mesenchymal stem cells in Alzheimer's disease therapeutics[J]. Methods Mol Biol, 2015, 1212: 171–181. |
| [9] | Liu J, Yu F, Sun Y, et al. Concise reviews:characteristics and potential applications of human dental tissue-derived mesenchymal stem cells[J]. Stem Cells, 2015, 33(3): 627–638. DOI:10.1002/stem.1909 |
| [10] | Ishidaa O, Haginoc I, Nagaya N, et al. Adipose-derived stem cell sheet transplantation therapy in a porcine model of chronic heart failure[J]. Translational Research, 2015, 165(5): 631–639. DOI:10.1016/j.trsl.2014.12.005 |
| [11] | Wang L, Ma R, Flavell RA, et al. Requirement of mitofen-activated protein kinase kinase3(MKK3) for activation of p38apha and p38delta MAPK isoforms by TGF-β1 in murine mesangial cells[J]. J Biol Chem, 2002, 277(49): 47257–47262. DOI:10.1074/jbc.M208573200 |
| [12] | 陈春美, 杨卫忠, 王春华, 等. NOS、p38MAPK、caspase-3介导大鼠脑缺血神经细胞凋亡可能通路的实验研究[J]. 国际神经病学神经外科学杂志, 2008, 35(2): 107–111. |
| [13] | Peter A. Nephrotoxicity and the role of contrastmedia[J]. Radial Med, 2004, 22(6): 377–378. |
| [14] | 孙文, 冯丽园, 赵宗江, 等. 三七总皂苷干预糖尿病肾病大鼠氧化应激及足细胞凋亡机制的实验研究[J]. 中华中医药杂志, 2011, 26(5): 1062–1067. |
| [15] | Cao AL, Wang L, Chen X, et al. Ursodeoxycholic acid and 4-phenylbutyrate prevent endoplasmic reticulum stress-induced podocyte apoptosis in diabetic nephropathy[J]. Lab Invest, 2016, 96(6): 610–622. DOI:10.1038/labinvest.2016.44 |
| [16] | 向少伟, 王小琴, 唐庆. 肾安提取液对糖尿病小鼠肾脏TGF-β1和p38MAPK表达的影响[J]. 时珍国医国药杂志, 2011, 22(2): 314–316. |
| [17] | Takekawa M, Tatebayashi K, Itoh F, et al. Smaddependent GADD45 beta expression mediates delayed activation of p38MAPKinase by TGF-β[J]. EMBO J, 2002, 21(1): 6473–6482. |
| [18] | Schiffer M, Bitzer M, Roberts IS, et al. Apoptosis in podocytes induced by TGF-β and Smad 7[J]. J Clin Invest, 2001, 108(6): 807–816. DOI:10.1172/JCI200112367 |
 2017, Vol. 43
2017, Vol. 43


