扩展功能
文章信息
- 田丹, 孙新, 安晓婷, 张立岩, 刘杨, 佟海滨, 李坦, 申野, 满枋霖, 颜伟群
- TIAN Dan, SUN Xin, AN Xiaoting, ZHANG Liyan, LIU Yang, TONG Haibin, LI Tan, SHEN Ye, MAN Fanglin, YAN Weiqun
- HSA-TP5融合基因表达载体的构建及其真核表达
- Construction and eukaryotic expression of recombinant HSA-TP5 fusion gene expression vector
- 吉林大学学报(医学版), 2017, 43(05): 948-952
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 948-952
- 10.13481/j.1671-587x.20170517
-
文章历史
- 收稿日期: 2017-04-27
2. 北京大学人民医院血液研究所骨髓移植病房, 北京 100044;
3. 北华大学附属医院骨外1科, 吉林 吉林 132013;
4. 吉林大学药学院生物工程教研室, 吉林 长春 130021
2. Institute of Hematology, People'sHospital, Beijing University, Beijing 100044, China;
3. First Department of Orthopaedics, Affiliated Hospital, Beihua University, Jilin 132013, China;
4. Department of Bioengineering, School of Pharmacy, Jilin University, Changchun 130021, China
胸腺五肽(TP5) 由精氨酸、赖氨酸、天门冬氨酸、缬氨酸和酪氨酸5种氨基酸组成,是胸腺生成素Ⅱ的活性中心,具有诱导T淋巴细胞及其亚群分化、成熟和活化的功能,能够使T淋巴细胞亚群比例趋于正常,具有增强巨噬细胞吞噬功能、提高红细胞及自然杀伤细胞的活力的作用[1-2]。目前,TP5被广泛应用于临床,是治疗免疫缺陷性疾病及恶性肿瘤等辅助用药的有效生化药物[3-6];但其另一个显著特征是在血中不稳定,半衰期很短,仅为30 s,如此短的半衰期只能通过增加给药次数来达到理想的治疗效果,这一特点也严重制约了TP5在临床上的应用[7]。人血清白蛋白(human serum albumin, HSA)是人体含量最丰富的蛋白质,具有维持血液渗透压、营养物质运输的重要作用,其半衰期长达19 d,是人体重要的药物载体。人血清白蛋白稳定性极好,无酶或免疫活性[8],作为载体融合蛋白在内皮抑素、干扰素、促红素及白细胞介素11和甲状旁腺激素等药物与人血清白蛋白融合的研究中有广泛的应用[9-11]。本实验利用基因重组技术构建HSA和TP5融合基因,并与毕赤酵母蛋白分泌表达载体pPICZαC重组,将该融合表达质粒整合至毕赤酵母宿主菌X-33菌种染色体DNA中,诱导表达融合蛋白HSA-TP5,并对其进行活性鉴定,为开发新型TP5药物奠定基础。
1 材料与方法 1.1 主要试剂和仪器HSA cDNA序列由本实验室从人胚胎肝组织提取基因重组获得,经测序,与文献发表一致。Taq DNA聚合酶为美国NEB公司产品,毕赤酵母蛋白分泌表达载体PPICZαC和毕赤酵母宿主菌X-33为美国Invitrogen公司产品,质粒小量提取试剂盒为日本TaKaRa公司产品,阳离子交换树脂为瑞典Pharmacia公司产品。PCR扩增仪,美国Thermo Electron公司;DNA测序仪,美国Beckman公司;电转化仪,美国BIO-RAD公司;全自动蛋白层析系统,瑞典Pharmacia公司;DU7400紫外分光光计和64R离心机,美国Beckman公司;Scientific Model 3111二氧化碳培养箱,美国FORMA公司。
1.2 HSA-TP5融合基因的构建以HSA-pMD18-T重组克隆质粒载体(吉林大学药学院实验室构建)为模板,设计引物将TP5序列设计至3′引物终止密码子前,引物序列分别为5′-GCGTTCGAAATGAAGTGGGTAACCTTTATTTCC-C-3′,5′-TATGGTACCTCAGTAAACGTCCTT-TCTTAAGCCTAAGGCAGC-3′。建立PCR反应体系,通过PCR扩增并将TP5序列引入HSA的3′末端使HSA与TP5融合。DNA纯化试剂盒纯化DNA片段通过琼脂糖凝胶电泳检测。
1.3 HSA-TP5-pPICZαC融合质粒的构建采用引入限制性酶切位点BstbⅠ和KpnⅠ对HSA-TP5融合基因片段及表达质粒pPICZαC分别进行酶切消化,并纯化回收消化后得到核酸片段,对得到的核酸片段进行连接,将连接产物转化至大肠杆菌感受态细胞,过夜培养,提取质粒。将得到的融合质粒以限制性内切酶XbaⅠ消化鉴定,采用琼脂糖凝胶电泳分析插入片段的正确性,将鉴定正确的单克隆菌落进行扩增,提取质粒进行测序。采用Sanger双脱氧链末端终止法进行测序。
1.4 阳性表达菌的制备和筛选将5~10 μg线性化重组表达质粒HSA-TP5-pPICZαC转化至80 μL毕赤酵母宿主菌X-33感受态菌中,同时以pPICZαC表达质粒空载体转化菌作为阴性对照,对于得到的转化单克隆菌落在BMGY培养基中30℃培养诱导表达7 d,每隔24 h补充一次甲醇,保持甲醇浓度为0.5%;每日取1 mL菌液收集菌体,离心取上清分析蛋白性质。对收集的菌体沉淀进行酵母基因组DNA的提取,以酵母基因组DNA为模板,建立PCR反应体系,通过琼脂糖凝胶电泳分析鉴定重组表达质粒HSA-TP5-pPICZαC是否整合至酵母基因组DNA中。分别取每个单克隆培养菌液72 h菌液上清,用SDS-PAGE进行蛋白质相对分子质量的测定和粗略定量分析。
1.5 HSA-TP5融合蛋白的纯化采用阳离子交换树脂进行上样洗脱纯化,对于洗脱液通过吸光度[A(280)]值及SDS-PAGE监测蛋白纯化。利用AKTA全自动多功能蛋白纯化系统通过sourceTM30 RPC反相疏水层析柱进一步纯化。将最终纯化产物SDS-PAGE电泳分析。
1.6 HSA-TP5融合蛋白作用下淋巴细胞的活性采用MTT法监测纯化蛋白作用下淋巴细胞的增殖,通过酶联免疫检测仪测定490 nm波长的A值,绘制细胞生长曲线。
2 结果 2.1 HSA-TP5cDNA的克隆以HSA-pMD18-T重组克隆质粒载体为模板采用PCR法扩增HSA-TP5cDNA序列,HSA-TP5融合基因cDNA序列碱基数为1 845 bp,琼脂糖凝胶电泳提示与预测结果相符(图 1)。
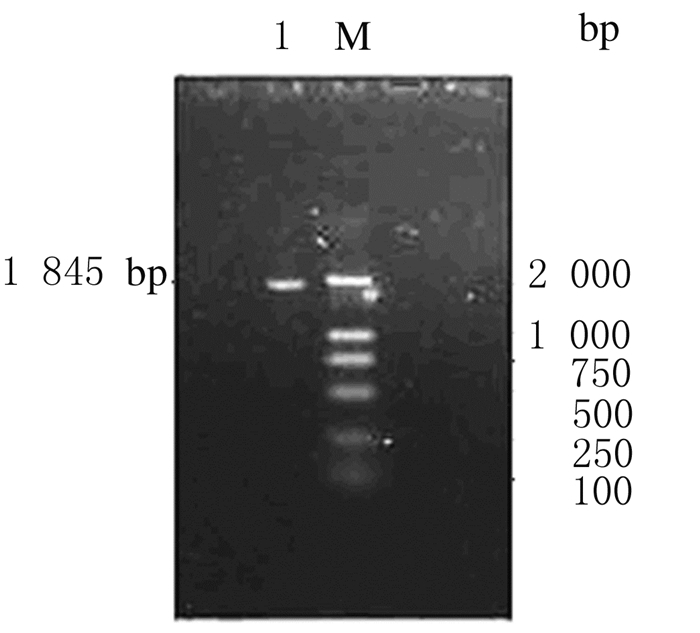
|
| Lane 1:HSA TP5 fusion gene; M:DL 2 000 marker. 图 1 HSA-TP5融合基因的琼脂糖凝胶电泳图 Figure 1 Agarose gel electrophoregram of HSA-TP5 fusion gene |
|
|
Xba Ⅰ分别存在于表达质粒pPICZαC和HSA的cDNA序列中的单一限制性酶切位点,用Xba Ⅰ单酶切消化融合质粒cDNA序列,应得到约707 bp大小的片段,说明外源基因正确插入表达质粒pPICZαC载体中(图 2)。
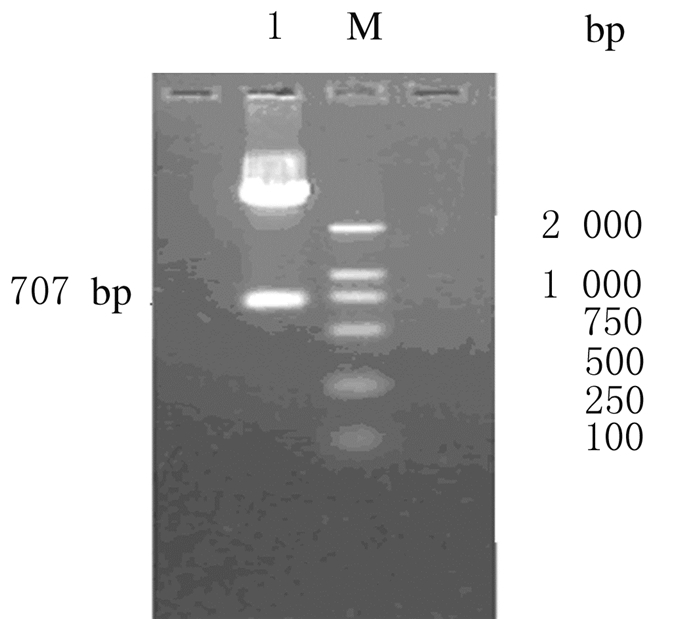
|
| Lane 1:HSA-TP5-pPICZαC digested with XbaⅠ; M:DL 2 000 marker. 图 2 XbaⅠ酶切鉴定重组质粒HSA-TP5-pPICZαC琼脂糖凝胶电泳图 Figure 2 Agarose gel electrophoregram of TP5-pPICZαC digested with Xba Ⅰ |
|
|
采用Sanger双脱氧链末端终止法进行测序,测序结果提示:HSA-TP5融合基因正向插入表达质粒pPICZαC序列中,成功构建HSA-TP5-pPICZαC融合表达质粒(图 3,见插页五)。

|
| 图 3 重组质粒PPICZα-HSA-TP5基因测序图谱 Figure 3 Sequencing maps of recombinant pPICZ α-HAS-TP5 plasmid |
|
|
通过PCR法筛选鉴定阳性表达菌落,以酵母菌基因组DNA为模板建立PCR反应体系,产物经电泳分析(图 4),可见在转化组出现预期特异性扩增条带1 845 bp,可以推测HSA-TP5融合基因整合到酵母菌基因组DNA中。

|
| M:DL 2 000 marker; Lane 1, 2 and 4:PCR products from different Pichia pastoris transformed with HSA-TP5-pPICZαC plasmid; Lane 3: PCR product from Pichia pastoris transformed by empty plasmid; Lane 5: PCR product from Pichia pastoris X-33 without transformation. 图 4 质粒HSA-TP5-pPICZαC转化酵母菌的PCR鉴定电泳图 Figure 4 Electrophoregram of Pichia pastoris transformed with HSA-TP5-pPICZαC identified by PCR |
|
|
取72 h后诱导表达上清50 μL进行SDS-PAGE分析(图 5)。人血清白蛋白相对分子质量为68 000,在甲醇诱导后72 h内,随着诱导时间延长,HSA-TP5融合蛋白表达量逐步升高(图 6)。
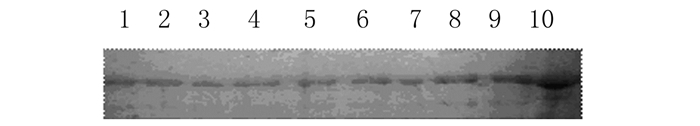
|
| Lane 1-9: Different fermentation supernatants from 9 transformants; Lane 10: Bovine serum albumin. 图 5 9个转化子诱导72 h后表达电泳图 Figure 5 Electrophoregram of expressions of 9 transformants 72 h after induction |
|
|

|
| Lane 1: Bovine serum albumin; Lane 2: Fermentation supernatants before methanol induction; Lane 3-9: Fermentation supernatants after methanol induction for 24, 48, 72, 96, 120, 144 and 168 h. 图 6 甲醇诱导不同时间后HSA-TP5融合蛋白表达电泳图 Figure 6 Electrophoregram of expressions of HSA-TP5 fusion protein after methanol induction for different time |
|
|
收集第4天表达上清, 利用阳离子交换树脂层析及AKTA多功能蛋白纯化系统疏水层析进行纯化,SDS-PAGE电泳分析洗脱液中HSA-TP5融合蛋白纯度(图 7),单一洗脱条带表明:经两步纯化法,能从发酵上清中获得高纯度的HSA-TP5融合蛋白。

|
| Lane 1-6:Electrophoregram of Stepwise elutions; Lane 7: Bovine serum albumin. 图 7 HSA-TP5融合蛋白纯化的SDS-PAGE电泳图 Figure 7 Electrophoregram of SDS-PAGE of purified HSA-TP5 fusion protein |
|
|
采用MTT法分别检测TP5和HSA-TP5对人外周血T淋巴细胞的促增殖活性,结果表明:100倍质量浓度的HSA-TP5与TP5的促增殖活性相当(图9)。由于TP5相对分子质量是679.77,HSA相对分子质量是68000,TP5约占整个HSA-TP5融合相对分子质量的1/100 (图 8)。

|
| A:TP5;B:HSA-TP5. 图 8 HSA-TP5融合蛋白对人T淋巴细胞增殖活性的促进作用 Figure 8 Promotion effect of HSA-TP5 fusion protein on proliferation activities of human T lymphocytes |
|
|
TP5是胸腺生成素Ⅱ的活性片段,胸腺生成素Ⅱ是从胸腺激素分离得到,含有49个氨基酸;但是,其中的5个氨基酸具有胸腺生成素Ⅱ的全部的生理活性,这5个氨基酸组成的肽链片段即为TP5,具有调节免疫系统,促进T淋巴细胞及其亚群增殖活化。在临床上,TP5作为肿瘤、自身免疫性疾病及重症感染等疾病的辅助用药已得到广泛应用,但是其含有5个氨基酸,相对分子质量为679.77,在体内的作用时间短,也使该药物在临床使用中受到制约,研究者也通过缓释剂及修饰等方法来解决这一缺陷。本研究利用HSA融合技术,构建融合蛋白。HSA是体内稳定的惰性蛋白,与其融合能够提高目的蛋白的稳定性,同时HSA经蛋白翻译系统与目的蛋白连接,不需要体外处理,与HSA构建的融合蛋白能稳定延长半衰期,较其他修饰半衰期更长[12-13]。目前,已有HSA融合蛋白(如生长激素、干扰素等产品)进入临床研究阶段。长效蛋白的开发已经成为基因工程药物开发的一个重要研究方向。本研究所利用的毕赤酵母表达系统是目前被广泛应用的外源蛋白表达体系,已经有多重外源蛋白在该体系成共表达,毕赤酵母表达体系有来自酵母本身的信号肽和来自外源蛋白的信号肽,本实验中利用的HSA具有自身的信号肽可以在酵母中成功分泌表达,并且具有很高的表达水平[14-17]。本研究利用PCR法成功将TP5与HSA融合,构建真核表达体系,并对融合蛋白的表达及影响因素(如时间)进行了研究,同时对活性也做了初步的分析。本研究结果表明:经鉴定及测序HSA-TP5融合基因成功构建,并能够在毕赤酵母X-33菌种中实现分泌表达,表现出对淋巴细胞刺激增殖活性。在后续工作中将对该融合蛋白进行蛋白测序及结构鉴定,对其在酵母中的表达条件、蛋白降解及活性进一步深入探讨。
| [1] | Schlesinger DH, Goldstein G. The amino acid sequence of thymopoietin Ⅱ[J]. Cell, 1975, 5(4): 361–365. DOI:10.1016/0092-8674(75)90054-9 |
| [2] | Cascinelli N, Clemente C, Bufalino R, et al. Perinodular injection of thymopentin(TP5) in cutaneous and subcutaneous metastases of melanoma[J]. Melanoma Res, 1993, 3(6): 471–476. DOI:10.1097/00008390-199311000-00011 |
| [3] | 何文杰, 涂长玲, 江波. 胸腺五肽对老年晚期非小细胞肺癌患者免疫功能的影响研究[J]. 实用心脑肺血管病杂志, 2015, 23(7): 72–74. |
| [4] | 王兴玲, 于明新. 苦参碱联合胸腺五肽对卵巢癌腹腔热化疗大鼠免疫功能的影响[J]. 实用药物与临床, 2017, 20(1): 4–8. |
| [5] | 金高娃, 秦迎春, 葛永利, 等. 胸腺五肽联合化疗治疗肺癌患者效果及对血清、呼气冷凝液ET-1和血清T淋巴细胞亚群水平的影响[J]. 疑难病杂志, 2016, 15(9): 896–899. |
| [6] | 耿书军, 刘建玲, 冯玉英, 等. 胸腺五肽联合常规抗结核方案治疗复治菌阳肺结核的疗效及对患者免疫功能的影响[J]. 中国现代医学杂志, 2015, 25(7): 51–53. |
| [7] | 谢婧, 张长平, 王咏梅. 胸腺五肽辅助用药的临床有效性循证评价[J]. 中国新药杂志, 2015, 24(22): 2599–2605. |
| [8] | 刘文慧, 吴敏, 沈其, 等. 人血清白蛋白融合技术研究进展[J]. 药学进展, 2015, 39(3): 199–203. |
| [9] | 张伟, 代晓朋, 王鲁燕, 等. 重组人血清白蛋白-干扰素α-2b融合蛋白体外抗乙型肝炎病毒活性评价[J]. 中国药理学与毒理学杂志, 2014, 28(4): 550–555. |
| [10] | 富岩, 杨小楠, 魏开华, 等. 具创新分子结构的更优长效性重组人血清白蛋白/促红素融合蛋白的表达、制备和特性研究[J]. 中国医药生物技术, 2017, 12(1): 6–18. |
| [11] | 李成媛, 张晶晶, 钱凯, 等. 人血清白蛋白-干扰素α2b融合蛋白在CHO细胞中的表达[J]. 中国生物工程杂志, 2016, 36(7): 7–14. |
| [12] | 杨刚刚, 马诚凯, 史世会, 等. 豹蛙抗瘤酶与人血清白蛋白融合蛋白的毕赤酵母高效表达与活性测定[J]. 生物技术通报, 2015, 31(10): 222–229. |
| [13] | 马义, 赵绍军, 洪岸. 新型人血清白蛋白特异结合肽ML的筛选及鉴定[J]. 中国生物工程杂志, 2015, 35(5): 74–80. |
| [14] | 陈通威, 杜莹莹, 薛冲, 等. 注射用重组人血清白蛋白-干扰素α2b融合蛋白生物学活性检测方法学研究[J]. 山西医药杂志, 2014, 43(5): 499–501. |
| [15] | 王芙蓉, 杜艳涛, 刘海雄. 人血清白蛋白融合技术在药物长效化改造中的应用[J]. 生命科学, 2015, 27(9): 1197–1205. |
| [16] | 李伟, 胡红梅, 陈彩芬, 等. Notch配体Delta-1基因真核表达载体的构建[J]. 中国老年学杂志, 2015, 35(11): 2898–2900. DOI:10.3969/j.issn.1005-9202.2015.11.007 |
| [17] | 李伟, 胡红梅, 陈彩芬, 等. 重组pcDNA3.1-HEGF基因真核表达载体的构建[J]. 中国老年学杂志, 2015, 35(14): 3807–3809. DOI:10.3969/j.issn.1005-9202.2015.14.006 |
 2017, Vol. 43
2017, Vol. 43


