扩展功能
文章信息
- 邢丽娜, 任金海, 王颖, 王福旭, 蔡圣鑫
- XING Lina, REN Jinhai, WANG Ying, WANG Fuxu, CAI Shengxin
- 氯喹抑制的自噬对地西他滨促进髓性白血病细胞凋亡的影响
- Influence of autophagy inhibited by chloroquine in apoptosisof myelogenous leukemia cells promoted by decitabine
- 吉林大学学报(医学版), 2017, 43(05): 937-942
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 937-942
- 10.13481/j.1671-587x.20170515
-
文章历史
- 收稿日期: 2017-02-07
白血病是一种造血系统的恶性肿瘤性疾病,是35岁以下人群中死亡率最高的肿瘤[1-2]。地西他滨具有抑制DNA甲基化转化酶的作用,2004年由美国食品药品委员会批准上市作为白血病的治疗药物[3]。研究[4]证实:地西他滨可以诱导白血病细胞凋亡。前期研究[4-5]显示:地西他滨在达到一定浓度后,其浓度增长并不能梯度性增加白血病细胞凋亡率。此外,有研究[6]指出:他滨类药物在治疗过程中会诱导细胞产生自噬。目前尚未有研究证实自噬系统的启动是否会对他滨类药物促进细胞凋亡的作用产生干扰。本实验基于此,采用自噬抑制剂氯喹作为干预药物,探讨自噬在地西他滨诱导白血病细胞凋亡中的作用,为其临床应用提供指导。
1 材料与方法 1.1 细胞、药物、主要试剂和仪器K562人慢性髓系白血病细胞由郑州大学第一附属医院血液科惠赠。人急性髓性白血病细胞KG-1a1Aor1a由本实验室保存。地西他滨购于荷兰Pharmachemie BV公司,规格为每瓶50 mg,用DMSO配置成浓度为0.2 mol·L-1的母液,实验时用含有10%FBS的PRMI 1640培养液稀释成实验浓度。氯喹购于美国Sigma公司,采用DMSO配置成0.1 mol·L-1的母液,实验时使用含有10%FBS的PRMI 1640培养液稀释。PRMI1640细胞培养基、胰蛋白酶和胎牛血清均购于美国Gibco公司,DMSO和罗丹明购于美国Sigma公司,细胞凋亡试剂盒、兔抗人LC3抗体及β-actin抗体购于美国Ebioscience公司,逆转录及转录试剂盒购于大连宝生物公司,CCK-8试剂盒购于日本同仁公司,细胞培养耗材均购于美国Corning公司。生物安全柜(新加坡ESCO公司),二氧化碳培养箱(美国Thermo Scientific公司),酶标仪(美国Bio-Rad公司),垂直电泳槽及电源(北京六一生物科技有限公司),化学发光仪(上海天能科技有限公司),荧光定量PCR仪(美国ABI公司,ABI7500),冷冻高速离心机(湖南湘仪有限公司),流式细胞仪(美国BD公司),分析天平(德国梅特勒公司)。
1.2 培养K562和KG-1a1Aor1a细胞K562和KG-1a1Aor1a细胞从液氮中取出后,于37℃条件下迅速解冻,酒精消毒后,150 g离心5 min,并使用新鲜的含有10%FBS的PRMI 1640培养液重悬并接种于细胞培养皿中。K562为悬浮细胞,48 h后传代,150 g离心5 min,使用新鲜培养液重悬后传代于2个培养皿即可。KG-1a1Aor1a为贴壁细胞,48 h后待细胞生长至铺满瓶底90%以上时,使用胰蛋白酶消化细胞,150 g离心5 min后,去除旧培养液使用新鲜培养液重悬细胞,接种于2个培养皿即可。离心去除旧培养液,使用含有10% DMSO、10% FBS和80%培养液重悬即可冻存细胞。
1.3 K562和KG-1a1Aor1a细胞实验分组和干预方法K562和KG-1a1Aor1a细胞传2代后分为空白对照组、地西他滨(10 μmol·L-1)组和氯喹(50 μmol·L-1)联用地西他滨组(联用组)。地西他滨组加入地西他滨干预24 h,终浓度为10 μmol·L-1;联用组先使用50 μmol·L-1氯喹干预6 h后,离心去药,再使用地西他滨干预24 h,终浓度为10 μmol·L-1。空白对照组使用等量DMSO干预24 h。
1.4 CCK-8法检测各组细胞增殖抑制率按照4×104个细胞接种于96孔板,将细胞分组药物干预,每个组别共设定10个复孔。于各组药物干预20和44 h后,每孔加入10 μL CCK-8溶液,孵育的吸收波长4 h后,在450 nm处检测各组细胞吸光度(A)值,按照公式计算细胞增殖抑制率,细胞增殖抑制率=(对照组A值-实验组A值)/对照组A值×100%。
1.5 流式细胞术检测各组细胞凋亡率和线粒体膜电位按照1×106个细胞接种于6孔板,将细胞分组药物干预,每个组别共设定6个复孔。于各组药物干预24和48 h后,使用4℃预冷的PBS清洗细胞1次(K562细胞清洗后按150 g离心5 min收集)。部分细胞采用75%乙醇固定,按照细胞凋亡试剂盒说明,先加入Annexin Ⅴ染色液,再加入PI染色液,避光染色10 min采用流式细胞术检测细胞凋亡率;部分细胞采用PRMI 1640培养液重悬细胞后,加入罗丹明使其终浓度为1 μmol·L-1,37℃避光孵育30 min后,4℃预冷的PBS清洗细胞1次,200 μL PBS重悬后流式细胞仪测定线粒体膜电位变化,以平均荧光强度代表线粒体膜电位变化。
1.6 Q-PCR法检测各组细胞中Atg7和Atg12基因表达水平按照1×107个细胞接种于6 cm培养皿,将细胞分组药物干预,每个组别共设定6个复孔。于各组药物干预24 h后,使用4℃预冷的PBS清洗细胞1次(K562细胞清洗后按150 g离心5 min收集后直接加入Trizol),每板加入2 mL Trizol裂解细胞,液氮急冻后置于-80℃保存。按照Trizol说明提取RNA,随后使用按照TaKaRa试剂盒说明书进行逆转录,并检测Atg7及Atg12基因表达水平。引物见表 1。数据以空白对照组作为参照,使用各样本Ct值,采用2-ΔΔCt法分析结果。反应条件:95℃、2 min;95℃、5 s,60℃、32 s,40个循环。
| Gene | Sequence |
| Atg7 | 5′-GAGGAGACCGTCTGAGCAAC-3′ |
| 5′-TGACACAGGAAGGTGCAA-3′ | |
| Atg12 | 5′-AAACGTGAGCCAAGGGATT-3′ |
| 5′-GGAAACTTGGTGCTGCTTGG-3′ | |
| β-actin | 5′-CTGAACCCTAAGGCCAACCGTGAAA-3′ |
| 5′-TGAAGCTGTAGCCACGCTCGGTC-3′ |
按照1×107个细胞接种于6 cm培养皿,将细胞分组药物干预,每个组别共设定3个复孔。于各组药物干预24 h后,使用4℃预冷的PBS清洗细胞1次(K562细胞清洗后按150 g离心5 min收集),RIPA裂解液(含有1 μmol·L-1 PMSF)裂解细胞提取总蛋白,BCA法测定蛋白浓度,上样30 μg进行电泳。湿转法转移至醋酸纤维素膜上,5%脱脂牛奶封闭1 h,兔抗人LC3抗体于冰盒内孵育过夜,洗膜后加入羊抗兔二抗室温孵育2 h,ECL曝光并使用天能自带软件分析光密度,以目标蛋白光密度与内参蛋白光密度比值分析结果,蛋白表达水平=目标蛋白光密度/内参蛋白光密度。
1.8 统计学分析采用SPSS 17.0软件进行统计学分析。各组细胞增殖抑制率、凋亡率、线粒体膜电位、Atg7及Atg12基因表达水平和LC3蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组细胞增殖抑制率孵育24及48 h后,与空白对照组比较,地西他滨和联用组K562和KG-1a1Aor1a细胞增殖抑制率明显升高(P < 0.05或P < 0.01)。与地西他滨组比较,联用组K562和KG-1a1Aor1a细胞增殖抑制率明显升高(P < 0.05)。见表 2。
| (n=10, x±s,η/%) | |||||
| Group | Inhibitory rate of proliferation of K562 cells | Inhibitory rate of proliferation of KG-1a1Aor1a cells | |||
| (t/h) 24 | 48 | 24 | 48 | ||
| Blankcontrol | 0 | 0 | 0 | 0 | |
| Decitabine | 31.0* | 34.4* | 19.1* | 28.7* | |
| Combined | 42.1**△ | 45.8**△ | 27.8**△ | 31.5**△ | |
| *P < 0.05, **P < 0.01 compared with blank control group; △P < 0.05 compared with decitabine group. | |||||
孵育24及48 h后,与空白对照组比较,地西他滨和联用组K562和KG-1a1Aor1a细胞凋亡率明显升高(P < 0.01);与地西他滨组比较,联用组K562和KG-1a1Aor1a细胞凋亡率明显升高(P < 0.05)。见表 3及图 1(插页一)。
| (n=6, x±s, η/%) | |||||
| Group | Apoptotic rate of K562 cells | Apoptotic rate of KG-1a1Aor1a cells | |||
| (t/h) 24 | 48 | 24 | 48 | ||
| Blank control | 1.9±0.1 | 2.8±0.3 | 1.4±0.1 | 1.9±0.4 | |
| Decitabine | 27.3±2.5* | 31.1±2.9* | 23.6±1.6* | 28.7±1.4* | |
| Combined | 33.4±1.4*△ | 38.9±2.7*△ | 30.9±2.0*△ | 36.4±1.5*△ | |
| *P < 0.01 compared with blank control group; △P < 0.05 compared with decitabine group. | |||||
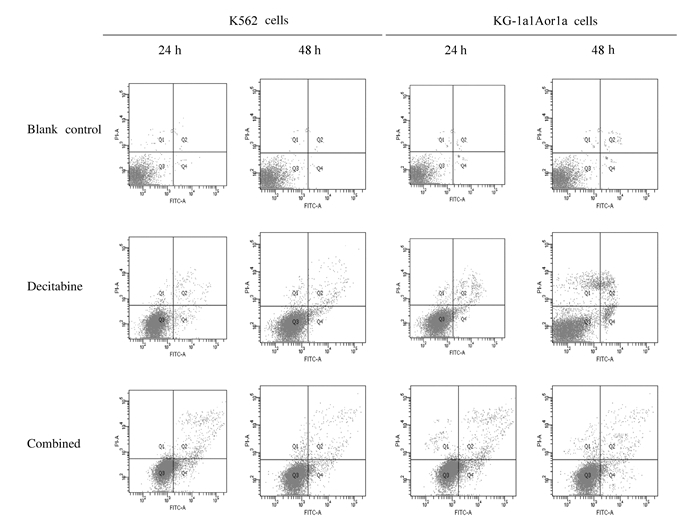
|
| 图 1 流式细胞术检测各组K562和KG-1a1Aor1a细胞凋亡率 Figure 1 Apoptotic rates of K562 and KG-1a1Aor1a cells detected by flow cytometry |
|
|
孵育24及48 h后,与空白对照组比较,地西他滨和联用组K562和KG-1a1Aor1a细胞线粒体膜电势明显增加(P < 0.05)。地西他滨组与联用组细胞线粒体膜电势比较差异无统计学意义(P>0.05)。见表 4。
| (n=6, x±s) | |||||
| Group | Mitochondrial membrane potential of K562 cells | Mitochondrial membrane potential of KG-1a1Aor1a cells | |||
| (t/h) 24 | 48 | 24 | 48 | ||
| Blank control | 5.4±0.9 | 5.8±0.6 | 5.1±0.8 | 6.3±0.8 | |
| Dectitabine | 58.9±7.1* | 66.7±8.2* | 54.1±4.2* | 60.3±6.2* | |
| Combined | 57.3±6.9* | 66.3±9.0* | 55.8±6.4* | 63.0±7.5* | |
| *P < 0.01 compared with blank control group. | |||||
孵育24 h后,与空白对照组比较,地西他滨组K562和KG-1a1Aor1a细胞中Atg7和Atg12基因表达水平明显升高(P < 0.05或P < 0.01)。与地西他滨组比较,联用组K562和KG-1a1Aor1a细胞中Atg7和Atg12基因表达水平明显降低(P < 0.05)。见表 5。
| (n=6, x±s, η/%) | |||||
| Group | K562 cells | KG-1a1Aor1a cells | |||
| Atg7 | Atg12 | Atg7 | Atg12 | ||
| Blank control | 1.009±0.045 | 0.989±0.020 | 1.030±0.064 | 1.094±0.050 | |
| Dectitabine | 1.482±0.011* | 1.577±0.032** | 1.521±0.031** | 1.439±0.028* | |
| Combined | 1.172±0.015△ | 1.302±0.026△ | 1.218±0.045△ | 1.106±0.037△ | |
| *P < 0.05, ** P < 0.01 compared with blank control group; △P < 0.05 compared with decitabine group. | |||||
孵育24 h后,与空白对照组比较,地西他滨组K562和KG-1a1Aor1a细胞中LC3-Ⅱ/LC3-Ⅰ相对表达水平明显升高(P < 0.01);与地西他滨组比较,联用组K562和KG-1a1Aor1a细胞中LC3-Ⅱ/LC3-Ⅰ相对表达水平明显降低(P < 0.05)。见表 6和图 2(插页一)。
| (n=3, x±s) | ||
| Group | Relative expression level of LC3-Ⅱ/ LC3-Ⅰ | |
| K562cells | KG-1a1Aor1a cells | |
| Blank control | 0.937±0.082 | 0.821±0.183 |
| Dectitabine | 61.640±12.470* | 37.790±8.140* |
| Combined | 45.480±6.810△ | 21.650±6.870△ |
| *P < 0.01 compared with blank control group; △P < 0.05 compared with decitabine group. | ||
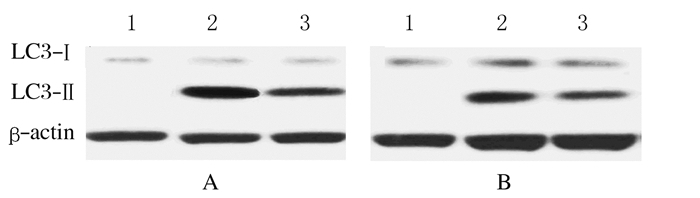
|
| Lane 1: Blank control group; Lane 2: Decitabine group; Lane 3: Combinedgroup. 图 2 各组K562细胞(A)和KG-1a1Aor1a细胞(B)中LC3-Ⅱ/LC3-Ⅰ表达电泳图 Figure 2 Electrophoretogram of expressions of LC3-Ⅱ/LC3-Ⅰ in K562 (A) and KG-1a1Aor1a (B) cells in various groups |
|
|
自噬广泛地存在于真核细胞以及高等动物、植物的生长和发育过程中,在每个过程中均存在一定的调节作用。自噬参与肿瘤的发病过程,但对于不同种类的肿瘤,自噬在其中扮演不同的角色[7]。研究[8-9]显示:抑制自噬可以增强白血病细胞株对多种不同治疗药物的敏感性,而自噬在白血病的发病过程中可以促使白血病细胞产生部分的抗药作用[10]。通过抑制自噬的发生,从而起到增强抗癌药物作用及疗效是一种可行的思路与方法[11]。氯喹是一种溶酶体的抑制剂,加入氯喹可以有效抑制细胞溶酶体与自噬体的融合,从而抑制机体的自噬过程[12]。本研究基于此,探讨使用氯喹作为自噬的抑制剂对地西他滨诱导白血病细胞凋亡的影响。
当机体自噬发生时,细胞胞浆中的LC3蛋白会被激活从而形成LC3-Ⅰ,而LC3-Ⅰ在Atg7和Atg12等因子的影响下进一步转化后就可以形成自噬体膜上的重要组成蛋白——LC3-Ⅱ[13]。本研究使用LC3-Ⅱ/LC3-Ⅰ的比值及自噬重要的启动因子Atg7和Atg12的表达作为自噬发生的指标,证实在地西他滨起效的过程中,白血病细胞株K562及KG-1a1Aor1a的自噬过程均已经启动。化疗类的药物可以诱导多种肿瘤细胞产生自噬,而自噬在干预肿瘤药物促进细胞凋亡的作用中扮演着重要角色[14]。自噬是一个高度选择的过程,能够使细胞具有较好的抗压能力,限制损伤并且促进恢复能力[15]。从促进白血病细胞凋亡及抑制细胞增殖的作用上来看,使用氯喹预孵育后再使用地西他滨治疗的效果明显优于地西他滨单用,该结果证实了自噬在地西他滨促进白血病细胞凋亡的过程中主要起到保护作用,能够促进白血病细胞抗凋亡,线粒体膜电位的结果也很好地验证了这一结论,而使用自噬抑制剂能够增强地西他滨促进白血病细胞凋亡的作用,增强药效。
本研究结果显示:自噬与白血病的发生有着重要的关系,通过抑制自噬能够增强抗瘤药物的疗效与作用,调控白血病细胞中的自噬为白血病治疗提供了新的研究方向。
| [1] | 李光耀. 核糖体蛋白RPS15A促进白血病U937细胞恶性增殖的分子机制研究[D]. 济南: 山东大学, 2016. |
| [2] | 管俊, 姜扬文, 孙爱红, 等. 地西他滨联合半量预激方案对老年急性髓性白血病及高危骨髓增生异常综合征的影响[J]. 中华临床医师杂志:电子版, 2014, 8(21): 3897–3900. |
| [3] | Serravalle S, Bertuccio SN, Astolfi A, et al. Synergistic cytotoxic effect of L-asparaginase combined with decitabine as a demethylating agent in pediatric T-ALL, with specific epigenetic signature[J]. BioMed Res Int, 2016, 2016: 1985750. |
| [4] | 韩新爱, 曾慧兰, 韩艳萍, 等. 地西他滨对NB4及K562细胞增殖和凋亡的影响[J]. 中国实验血液学杂志, 2013, 21(2): 356–360. |
| [5] | 徐东藩, 方志刚, 翟凤仙, 等. 地西他滨对伊马替尼耐药细胞株KBM5-T315I的增殖抑制及诱导凋亡作用研究[J]. 热带医学杂志, 2013, 13(3): 274–277. |
| [6] | 黄小龙, 张浩, 谢香雨, 等. 吉西他滨诱导膀胱癌T24细胞自噬的实验研究[J]. 第三军医大学学报, 2017, 39(1): 9–15. |
| [7] | 李梦琪, 刘卓刚. 自噬对慢性髓系白血病的双重作用[J]. 中国实验血液学杂志, 2015, 23(2): 583–586. |
| [8] | Piya S, Kornblau SM, Ruvolo VR, et al. Atg7 suppression enhances chemotherapeutic agent sensitivity and overcomes stroma-mediated chemoresistance in acute myeloid leukemia[J]. Blood, 2016, 128(9): 1260–1269. DOI:10.1182/blood-2016-01-692244 |
| [9] | Piya S, Andreeff M, Borthakur G. Targeting autophagy to overcome chemoresistance in acute myleogenous leukemia[J]. Autophagy, 2017, 13(1): 214–215. DOI:10.1080/15548627.2016.1245263 |
| [10] | 蒋卉男, 胡荣, 刘卓刚. 自噬与白血病治疗研究最新进展[J]. 中国实验血液学杂志, 2015, 23(1): 290–294. |
| [11] | Chen Y, Li X, Guo L, et al. Combining radiation with autophagy inhibition enhances suppression of tumor growth and angiogenesis in esophageal cancer[J]. Mol Med Rep, 2015, 12(2): 1645–1652. DOI:10.3892/mmr.2015.3623 |
| [12] | 王晓娜, 任云青, 吴惠文, 等. 氯喹抑制自噬增强宫颈癌细胞SiHa对CPT处理的敏感性[J]. 中国细胞生物学学报, 2016, 38(1): 40–45. DOI:10.11844/cjcb.2016.01.0287 |
| [13] | Huang FC. Vitamin D differentially regulates Salmonella-induced intestine epithelial autophagy and interleukin-1beta expression[J]. World J Gastroenterol, 2016, 22(47): 10353–10363. DOI:10.3748/wjg.v22.i47.10353 |
| [14] | 杨翠, 王猛, 武超, 等. 保护性自噬对顺铂诱导人乳腺癌MCF-7细胞凋亡的抑制作用探讨[J]. 安徽医药, 2015, 19(1): 152–155. |
| [15] | 古春萍. 自噬介导人食管癌细胞对顺铂耐药的作用及其机制研究[D]. 广州: 南方医科大学, 2014. http://www.doc88.com/p-4913406166521.html |
 2017, Vol. 43
2017, Vol. 43


