扩展功能
文章信息
- 杨洁, 马英慧, 崔秀成, 王红梅, 董微丽, 谭小波
- YANG Jie, MA Yinghui, CUI Xiucheng, WANG Hongmei, DONG Weili, TAN Xiaobo
- MMP-2在糖尿病模型大鼠视网膜组织中的表达
- Expression of MMP-2 in retina tissue of diabetic retinopathy model rats
- 吉林大学学报(医学版), 2017, 43(05): 923-927
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 923-927
- 10.13481/j.1671-587x.20170512
-
文章历史
- 收稿日期: 2016-12-13
糖尿病视网膜病变(diabetic retinopahy,DR)是造成糖尿病患者视力下降的重要原因,严重者可导致失明[1]。糖尿病患者由于体内血糖水平升高,引起全身各器官各组织的微小血管出现病理改变,微血管及周围细胞出现进程性坏死或导致患者血管内皮变薄,进而导致患者体内各种屏障功能受损。视网膜含有丰富的毛细血管,长期的高血糖浸润使血管周细胞受损, 导致视网膜内屏障遭到破坏,随后为了促成血管新生而分泌大量血管生成因子和细胞外基质(extra cellularmatrix, ECM),过量的血管生成因子和细胞外基质可能与增生期糖尿病视网膜病变(proliferative diabetic retinopahy, PDR)的发生发展有关[2]。基质金属蛋白酶(matrix metalloproteinase, MMPs)是一种内源性蛋白酶系,能够降解细胞外基质, 而MMP-2是MMPs的重要组成成分,对降解ECM具有重要的作用[3],但目前国内相关报道尚较少。本研究通过腹腔注射链脲佐菌素(streptozotocin,STZ)复制糖尿病模型大鼠,观察不同时期模型大鼠视网膜组织中MMP-2的表达,为研究其在DR中的作用提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器SPF级SD大鼠,雄性,120只, 6周龄,体质量160~ 180 g,购自承德医学院实验动物中心,动物许可证号:SYXK(冀)2012-0022。SD大鼠饲养于实验动物中心SPF实验室,室内温度20℃~26℃,相对湿度45%~70%,昼夜各12 h。造模分组前对大鼠眼部及全身状况进行检查,并检测血糖,确认大鼠无原发眼疾及其他病变且血糖值正常,纳入研究。大鼠自由摄食饮水,其余饲养条件均符合中华人民共和国国家标准GB14925-2010中的规定。STZ(美国Sigma公司),Super ECL Plus超敏发光液(北京普利莱基因技术有限公司),抗MMP-2抗体(Abcam公司,总RNA提取试剂盒和qPCR试剂盒(北京旷博生物技术有限公司),PCR引物由上海生工合成,免疫组织化学检测试剂盒GK500705为基因科技(上海)有限公司产品。Optium Xcee血糖仪及Optium试纸(美国雅培糖尿病护理有限公司),Bio-Rad C1000反转录仪;TH-200 Olympus显微镜(美国Waters公司)。
1.2 糖尿病大鼠模型复制和分组检查符合要求的大鼠适应性饲养1周后,禁食12 h,分为正常对照组,24只;4、6和8周糖尿病模型组,每组30只;模型组:STZ溶解于pH4.5的0.1 mmol·L-1柠檬酸钠溶液(低温新鲜配制),连续5 d腹腔注射STZ(40 mg·kg-1),复制糖尿病大鼠模型[4]。正常对照组大鼠注射等量的柠檬酸钠溶液。
1.3 大鼠体质量和血糖水平检测在实验前检测并记录各组大鼠的体质量及血糖值,正常组于4、6和8周与同一时间点的模型组大鼠同时检测体质量及血糖值。
1.4 ELISA法检测大鼠视网膜组织中MMP-2 mRNA表达水平分别于造模后4、6和8周模型组随机取8只大鼠,正常对照组取8只大鼠于第8周检测。大鼠麻醉后取右眼视网膜组织,在洁净操作台上于匀浆器中加入液氮研磨后,加入Trizol进行裂解,采用RNA提取试剂盒分离提取总RNA。总RNA浓度测定符合要求后, 采用cDNA合成试剂盒合成cDNA模板并进行RT-PCR反应。测定MMP-2 mRNA的表达水平。RT-PCR引物序列:MMP-2,上游引物5′-AACATGTACAGGGTCGGAGACT-3′,下游引物5′-CATTCCCGTTGGCTGTCT-3′。GAPDH,上游引物5′-GGTGAAGGTCGGTATAAACG-3′,下游引物5′-CTCGCTCCTGGAAGATGGTG-3′。数据分析采用目的基因/内参基因的方法进行表达水平的分析。以Folds=2-ΔΔCt表示实验组与对照组目的基因表达的倍数关系,ΔΔCt=[Ct(目的基因)-Ct(GAPDH)]实验组-[Ct(目的基因)-Ct(GAPDH)]对照组。
1.5 ELISA法检测大鼠视网膜组织中MMP-2蛋白表达水平分别于造模后4、6和8周模型组随机取8只大鼠,正常对照组取8只大鼠,于第8周检测。大鼠麻醉后取右眼视网膜组织于组织裂解缓冲液中匀浆, 分离提取总蛋白溶液。总蛋白浓度测定符合要求后,蛋白于SDS-PAGE胶上电泳分离转膜。5%脱脂牛奶封闭,一抗(1:1 000) 4℃孵育过夜,PBS洗膜3次,二抗(1:2000) 孵育1 h, PBS洗膜3次,ECL化学发光试剂盒显像。计算分析平均灰度值。以影像中出现淡黄色至褐黄色细颗粒状着色者为阳性细胞。每组随机计数500个细胞,计算阳性表达率。
1.6 免疫组织化学观察分别于造模后4、6和8周模型组随机取8只大鼠,正常对照组取8只大鼠于最后时间点检测。大鼠麻醉后取右眼视网膜组织切片,PBS漂洗3次,MMP-2一抗(1:200) 孵育过夜,PBS洗3次;二抗(1: 400) 孵育6 h,PBS洗3次。经脱水、透明等常规操作后石蜡包埋制片,染色,在显微镜下观察大鼠视网膜组织形态。免疫组织化学评分的评定标准:以胞浆或胞膜棕黄色颗粒状沉积为阳性。首先按阳性细胞比例计分:阳性细胞1%~25%、26%~50%、51%~75%、76%~100%分别计分为0、1、2、3和4分; 再按染色强度计分:无染色和染色弱、中、强分别计为0、1、2和3分, 即不着色0分, 黄色1分, 棕黄色2分, 黄褐色3分。最后两部分得分相乘, 总分最高为12分, 分数越高, 阳性表达越强[5]。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠体质量、血糖水平、视网膜组织MMP-2 mRNA和蛋白表达水平及免疫组织化学评分均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 造模前各组大鼠体质量和空腹血糖水平造模前,各组大鼠体质量和禁食12 h空腹血糖水平比较差异无统计学意义(P>0.05)。见表 1。
| (x±s) | |||
| Group | n | Body weight (m/g) |
Fasting blood glucose [(cB/mmol·L-1)] |
| Normal control | 24 | 166.18±3.25 | 4.96±0.21 |
| 4-week model | 30 | 168.42±4.32 | 4.93±0.18 |
| 6-week model | 30 | 167.78±3.19 | 4.84±0.14 |
| 8-week model | 30 | 168.34±3.26 | 5.08±0.17 |
模型组大鼠使用STZ造模后,出现不同数量的死亡,其中4周模型组死亡3只,27只造模成功,其体质量明显低于4周后检测的正常对照组大鼠体质量,空腹血糖水平明显升高(P < 0.05);6周模型组大鼠死亡5只,25只造模成功,其体质量明显低于6周后检测的正常对照组大鼠体质量,空腹血糖水平明显升高(P < 0.05);8周模型组大鼠死亡7只,23只造模成功,其体质量明显低于8周后检测的正常对照组大鼠体质量,空腹血糖水平也明显升高(P < 0.05)。见表 2。
| (x±s) | |||
| Group | n | Body weight (m/g) |
Fasting blood glucose [(cB/mmol·L-1)] |
| Normal control | 24 | 266.18±4.25 | 5.16±0.09 |
| 6 weeks | 24 | 283.42±4.32* | 18.53±1.24** |
| 8 weeks | 24 | 297.83±3.65 | 5.23±0.11 |
| 4-week model | 27 | 237.78±3.09 * | 19.64±2.16** |
| 6-week model | 25 | 231.24±4.42 | 5.39±0.08 |
| 8-week model | 23 | 238.34±5.16** | 21.08±2.21** |
| *P < 0.05, ** P < 0.05 compared with normal control group at the same time. | |||
4、6和8周模型组MMP-2 mRNA和蛋白表达水平均明显高于正常对照组(P < 0.05或P < 0.01)。见表 3和图 1。
| (n=8, x±s) | ||
| Group | MMP-2 mRNA | MMP-2 protein |
| Normal control | 0.361±0.022 | 0.272±0.102 |
| 4-week model | 0.542±0.032* | 0.460±0.114* |
| 6-week model | 0.767±0.027* | 0.641±0.098** |
| 8-week model | 0.853±0.034** | 0.763±0.106** |
| *P < 0.05, ** P < 0.01 compared with normal control group. | ||
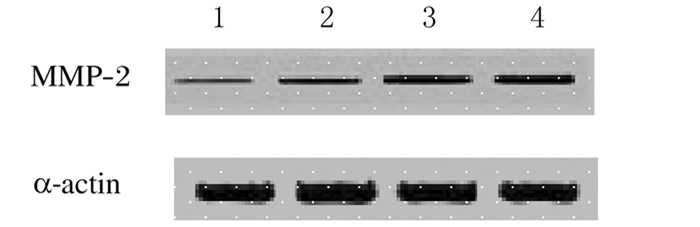
|
| Lane 1:Normal control group; Lane 2: 4-week model group; Lane 3: 6-week model group; Lane 4:8-week model group. 图 1 各组大鼠视网膜组织中MMP-2蛋白表达电泳图 Figure 1 Electrophoregram of expressions of MMP-2 protein in retina tissue of rats in various groups |
|
|
正常对照组大鼠视网膜结构层次清晰分明、细胞排列整齐,可见单层排列的神经节细胞,核圆形或椭圆形状,核较大。与正常对照组比较,模型组大鼠视网膜组织结构较为松散,神经节细胞数量明显减少,内核层及视杆细胞层细胞外界膜模糊,排列较乱,数量减少。MMP-2阳性细胞可见棕黄色颗粒沉淀,在神经节细胞层胞浆和血管内皮细胞尤为集中。见图 2(插页五)。随着检测时间的延长,糖尿病模型大鼠视网膜组织中出现淡黄色细颗粒状着色者,即为MMP-2阳性细胞表达。4、6及8周模型组大鼠视网膜组织中MMP-2阳性表达均高正常对照组。免疫组织化学评分结果显示:4、6和8周模型组大鼠视网膜MMP-2免疫组织化学评分分别为4.63±0.42、7.56±0.73和8.53±0.64,较正常对照组表达水平明显增高(P < 0.01)。
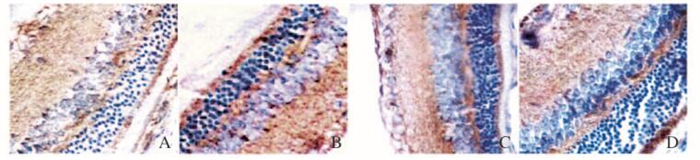
|
| A:Normal control group; В:4-week model group; C:6-week model group; D:8-week model group. 图 2 各组大鼠视网膜组织中MMP-2的表达(免疫组织化学,×200) Figure 2 Expressions of MMP-2 in retina tissue of rats in various groups (Immunohistochemistry, ×200) |
|
|
糖代谢紊乱是产生DR的根本原因,加之血液成分和血液流变性的改变、血管内皮生长因子以及遗传因素等也促成了DR的发生[6]。基质金属蛋白酶/基质金属蛋白酶抑制剂系统(MMPs/TIMPs)是近年研究增殖性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)发病机制的重点之一。血管新生的过程需要内皮细胞对细胞外基质进行降解、而后迁移扩增,接着合成新的基质组成成分[7]。这个过程的启动需要特异的血管生长分子参与,其终止亦需要特异的抑制分子才能完成[8]。血管新生过程是从已有的血管中新生出血管的过程,其基底膜的降解是必需的过程之一[9]。MMPs是重建细胞外基质的重要酶家族。MMPs的活性依赖于Zn2+金属离子。按其功能主要分为4大类:一是胶原酶类,如MMP-1和神经胶原MMP-8, 作用基质为纤维性胶原Ⅰ、Ⅱ和Ⅲ;二是明胶酶,MMP-2和MMP-9属于这一类,是血管内皮下基质Ⅳ型胶原降解的关键蛋白水解酶, 对血管内皮细胞的游走起重要作用[10-12];三是基质溶解素,包括MMP-3和MMP-7,作用底物较广,包括蛋白多糖、层黏蛋白和弹性蛋白等; 四是膜型基质蛋白酶(MT-MMP)[13],主要能降解细胞外基质膜有效成分、调节黏着,作用于细胞外组分其他蛋白成分而启动潜在的生物学功能,直接或间接参与胚胎发育、组织模型再塑及创伤修复等正常生理过程。本研究采用STZ小剂量多次注射成功复制糖尿病模型后,由于DR通常在糖尿病晚期出现,因此对造模后4、6和8周不同时间段检测结果显示:不同时间段大鼠体质量较正常对照组低而空腹血糖水平明显升高;同时MMP-2表达水平随着时间的增加而有所升高,免疫组织化学结果显示4周模型组大鼠视网膜组织已经产生病变,且MMP-2阳性表达量增多,视网膜病变程度随着模型时间进程而加剧,MMP-2阳性表达细胞也增多。本实验结果证实:MMP-2参与了早期糖尿病模型视网膜结构的重塑, 对新生血管的发生可能有重要作用。
目前国外的研究多集中于对DR晚期阶段已形成的新生血管膜进行分析,而在此时细胞外基质的活动性生长和重塑早已启动。新生血管的形成,包括毛细血管内皮层下基底膜降解, 内皮细胞迁移和增殖, 新生血管形成和新的基底膜形成等一系列过程。视网膜毛细血管内皮细胞的基底膜增厚及壁内周细胞的丧失是大多数DR患者早期组织学改变的一个标志,基底膜的增厚能影响血管通透性、细胞黏附、增殖分化及基因表达等功能, 其成分的改变必然引起血管功能异常[14]。在形成细胞外基质的两大部分(即基底膜和间质)中,以Ⅳ型胶原为主要成分的基底膜构成一道阻滞屏障,MMP-2可以作为血管内皮细胞的“开路先锋”降解基底膜。体外实验研究也证实了MMP-2参与微血管基底膜的降解代谢过程[15]。因此有研究者[7]指出:加深对Ⅳ型胶原即基底膜胶原的降解等血管形成的早期活动的理解,将更有可能给研究者提示以找到新的治疗方法。
本研究对感光细胞间质与视网膜色素上皮中MMP-2表达水平检测结果显示:随着检测时间延长,对照组大鼠网膜组织中MMP-2表达显示出轻度的升高,但差异无统计学意义。与正常对照组比较,黄斑变性患者MMP-2表达水平倍增,研究者[16]认为:MMP-2与年龄相关的黄斑变性特别是湿性黄斑变性脉络膜血管新生关系密切。研究[17]表明:MMP-2在脉络膜和Bruch膜中的表达可能随年龄增长而降低,致使Bruch膜增厚、沉着物累积、细胞重建功能下降。本研究结果亦提示:MMP-2与DR进程有密切关联,该结果对于糖尿病患者,尤其病程较长或老年患者有较重要的意义。
| [1] | Yu ZY, Lu B, Gong CY, et al. Streptozotocin induced diabetic retinopathy in C57 mice and the expression of some pro-angiogenic molecules[J]. Int Eye Sci, 2016, 16(1): 1–6. |
| [2] | 孔佳慧, 陈松. 基质金属蛋白酶与糖尿病视网膜病变关系研究进展[J]. 中国实用眼科杂志, 2015, 3(1): 2–5. |
| [3] | 谷欣伟, 边海霞, 翟晓雷. 血清MMP-2、MMP-9水平与糖尿病视网膜病变的相关性探究[J]. 医疗装备, 2015, 28(16): 9–10. DOI:10.3969/j.issn.1002-2376.2015.16.008 |
| [4] | 彭惠, 洪苏玲, 陶永贤, 等. 基质金属蛋白酶MMP-2mRNA在糖尿病苍鼠视网膜中的表达[J]. 第四军医大学学报, 2006, 27(17): 1570–1572. DOI:10.3321/j.issn:1000-2790.2006.17.009 |
| [5] | 刘清华, 谢寿城, 黄艳芳. 子宫内膜癌中雌激素受体的表达及免疫组化评分与临床病理参数的关系[J]. 中国临床研究, 2016, 29(7): 924–927. |
| [6] | 魏莹莹, 顾永昊. 糖尿病性视网膜病变发病机制研究进展[J]. 实用防盲技术, 2016, 11(3): 127–131. |
| [7] | Cousin JM, Cloninger MJ. The role of galectin-1 in cancer progression, and synthetic multivalent systems for the study of galectin-1[J]. Int J Mol Sci, 2016, 17(9): pii:E1566. DOI:10.3390/ijms17091566 |
| [8] | Giusti I, Delle Monache S, Di Francesco M, et al. From glioblastoma to endothelial cells through extracellular vesicles:messages for angiogenesis[J]. Tumour Biol, 2016, 37(9): 12743–12753. DOI:10.1007/s13277-016-5165-0 |
| [9] | Liceiri BP, Cheresh DA. The role of alphav integrins during angiogenesis:insights into potential mechanisms of action and clinical development[J]. J Clin Invest, 1999, 103(9): 1227–1230. DOI:10.1172/JCI6869 |
| [10] | Symeonidis C, Papakonstantinou E, Androudi S, et al. Comparison of interleukin-6 and matrix metalloproteinase expression in the subretinal fluid and the vitreous during proliferative vitreoretinopathy:correlations with extent, duration of RRD and PVR grade[J]. Cytokine, 2014, 67(2): 71–76. DOI:10.1016/j.cyto.2014.02.012 |
| [11] | Symeonidis C, Papakonstantinou E, Androudi S, et al. Interleukin-6 and the matrix metalloproteinase response in the vitreous during proliferative vitreoretinopathy[J]. Cytokine, 2011, 54(2): 212–217. DOI:10.1016/j.cyto.2011.02.001 |
| [12] | Pei J, Li B1, Liu Y, et al. Matrix metallopeptidase-2 gene rs2287074 polymorphism is associated with brick tea skeletal fluorosis in tibetans and kazaks, China[J]. Sci Rep, 2017, 7: 40086. DOI:10.1038/srep40086 |
| [13] | Zhai J, Wang Y. MDI 301, a synthetic retinoid, depressed levels of matrix metalloproteinases and oxidative stress in diabetic dermal fibroblasts[J]. Oncotarget, 2017. DOI:10.18632/oncotarget.16803 |
| [14] | Cheng H, Li SY, Zheng HR, et al. Multi-Förster resonance energy transfer-based fluorescent probe for spatiotemporal matrix metalloproteinase-2 and caspase-3 imaging[J]. Anal Chem, 2017, 89(8): 4349–4354. DOI:10.1021/acs.analchem.7b00277 |
| [15] | Plantner JJ, Jiang C, Smine A. Increase in interphotoreceptor Matrix gelatinase A(MMP-2) associated with age-related macular degeneration[J]. Exp Eye Res, 1998, 67(6): 637–645. DOI:10.1006/exer.1998.0552 |
| [16] | Stefanini FR, Maia M, Falabella P, et al. Profile of ocriplasmin and its potential in the treatment of vitreomacular adhesion[J]. Clin Ophthalmol, 2014, 8: 847–856. DOI:10.1247/OPTH.S32274.eCollection2014 |
| [17] | Yin H, Wan Q, Tian Y, et al. Matrix metalloproteinase 2(MMP-2) levels are increased in active acromegaly patients[J]. Endocring, 2017. DOI:10.1007/S12020-017-1283-8[Epubaheadofprint |
 2017, Vol. 43
2017, Vol. 43


