扩展功能
文章信息
- 伊雪, 邬鹏宇, 杨述亮, 韩燕, 杨学慧, 张树波, 徐涛, 高毅哲, 高木火, 李占清
- YI Xue, WU Pengyu, YANG Shuliang, HAN Yan, YANG Xuehui, ZHANG Shubo, XU Tao, GAO Yizhe, GAO Muhuo, LI Zhanqing
- PI3K/Akt信号通路介导莱菔硫烷预处理对大鼠供心冷缺血再灌注损伤的影响
- Influence of sulforaphane preconditioning in myocardial cold ischemia-reperfusion injury through PI3K/Akt signaling pathway in rats
- 吉林大学学报(医学版), 2017, 43(05): 918-922
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 918-922
- 10.13481/j.1671-587x.20170511
-
文章历史
- 收稿日期: 2017-01-05
2. 华北理工大学附属医院胸心外科, 河北 唐山 063000;
3. 厦门医学院附属医院 厦门市第二医院胸心外科, 福建 厦门 361021
2. Department of Thoracic-Cardiac Surgery, Affiliated Hospital, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Thoracic-Cardiac Surgery, Affiliated Hospital, Xiamen Medical College, Xiamen No.2 Hospital, Xiamen 361021, China
心脏移植是终末期心脏病患者疗效确切的治疗方法,通过心脏移植可以提高患者的生活质量、延长其寿命。但由于器官短缺,供心常常需要远距离低温运输使心肌冷缺血时间延长,及供心再灌注导致供心早期无功能、失功能和晚期排斥反应的出现[1-2],故临床上心脏移植的冷缺血再灌注损伤(ischemia reperfusion injury, IRI)是不可避免的,如何保护供心,减轻心脏移植的冷IRI是目前研究的热点之一。脂酰肌醇-3-激酶/蛋白激酶(PI3K/Akt)通路作为细胞内重要的信号转导通路在心肌暖IRI中的作用及莱菔硫烷(sulforaphane, SFN)抗氧化作用已得到证实[3-5]。本课题组前期研究[6-8]发现:SFN可通过抗凋亡、抗氧化作用减轻心脏移植中的供心冷IRI。但SFN与PI3K/Akt通路在心脏移植中冷IRI中的关系尚未有文献报道。本实验通过大鼠异体异位心脏移植模型探讨SFN是否通过PI3K/Akt通路对供心冷IRI起到保护作用,为临床心脏移植供心保护提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器近交系健康雄性SD大鼠64只,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXX京2011-007,体质量220~250 g,SPF清洁级。SFN购于美国LKT实验室,LY294002购自美国Cayman公司,组氨酸-色氨酸-酮戊二酸盐液(HTK液)购自德国克勒化学试剂公司,PV-6001二步法免疫组织化学检测试剂盒购自北京中杉金桥公司,兔Akt、P-Akt、Bax和Bcl-2多克隆抗体购自美国Abcam公司,二甲基亚砜(dimethyl sulfoxide,DMSO)溶剂购于美国Sigma公司。手术显微镜(德国Leica 650), 显微外科器械(德国Gest公司)。
1.2 冷IRI模型制备按照参考文献[8]中的方法制备动物模型。① 麻醉:10%水合氯醛3~4 mL·kg-1腹腔注射,麻醉SD大鼠;② 供心制备:用4℃生理盐水35 mL和HTK液15 mL先后对供心进行冲洗并取出置于20 mL 4℃ HTK液中保存9 h;③ 受体移植:将供心的升主动脉、肺动脉分别与该大鼠的腹主动脉、下腔静脉端侧吻合,检查无出血后关腹,移植后24 h处死动物,取出供心待组织学、免疫组织化学及Western blotting检测。
1.3 实验动物分组64只健康雄性SD大鼠随机分为4组,每组供体和受体各8只。缺血再灌注(冷IRI)组:受体在移植前24 h经尾静脉注射1%DMSO 0.3 mL;SFN组:受体在移植前24 h经尾静脉注射SFN 2.5 mL·kg-1;LY+冷IRI组:受体于注射DMSO前30 min及移植前30 min分别经鼠尾静脉注射LY294002 0.3 mg·kg-1,余同IRI组;LY+ SFN组:受体于注射SFN前30 min及移植前30 min分别经鼠尾静脉注射LY294002 0.3 mL·kg-1,余同SFN组。
1.4 心肌组织病理切片制备及形态观察10%甲醛固定供心组织24 h,常规脱水,透明,石蜡包埋,切片,HE染色后观察心肌组织结构。
1.5 免疫组织化学半定量分析大鼠心肌组织中Akt、p-Akt、Bcl-2和Bax蛋白表达水平按照试剂盒说明,采用PV-6001免疫组织化学二步法检测丝氨酸/苏氨酸蛋白激酶,即蛋白激酶B (Akt)、磷酸化Akt(p-Akt)、Bax(Bcl-2 Assaciated X protein)、B细胞淋巴瘤/白血病-2 (Bcl-2) 的蛋白表达。石蜡切片常规脱蜡至水,放入沸腾的柠檬酸盐缓冲液中抗原热修复5 min,3%过氧化氢阻断内源过氧化物酶后PBS洗3次(每次3 min),分别滴加兔多克隆抗体Akt(1:50)、P-Akt(1:50)、Bax(1:200) 和Bcl-2(1:200),置于4℃冰箱过夜,次日滴加PV-6001试剂,37℃温箱孵育40 min,PBS冲洗3次(每次3 min),行DAB显色5~6 min后蒸馏水充分洗涤,再行苏木素复染1 min后流水冲洗30 min,常规乙醇脱水,二甲苯透明,中性树胶封片;用已知阳性组织切片作为阳性对照,PBS代替一抗作为阴性对照,光镜下观察,以心肌细胞细胞质中出现棕黄色颗粒为阳性表达。于400倍镜下每张切片取5个视野,按照伊雪等[9]免疫组织化学评分法,结合阳性细胞百分比及阳性细胞染色程度进行评分,取均值表示该蛋白表达水平。
1.6 Western blotting法检测大鼠心肌组织中Akt、P-Akt、Bcl-2和Bax蛋白表达水平蛋白提取:取出冷冻供心组织,切取100 mg放入冰上已编号的EP管中,加入混匀的细胞裂解液1 mL,用匀浆器打碎,置于4℃离心机中离心10 min(11 000 r·min-1),用微量枪析出上清液备用。应用BCA法蛋白测定试剂盒检测蛋白浓度(A液:B液=50:1,混匀)用上样缓冲液配平,配制12%分离胶注入制胶玻璃板待凝固,再次注入5%浓缩胶并插梳子,凝固后拔出梳子并滴加上样蛋白(每孔50 μg),放入电泳槽进行电泳,用电转仪将蛋白转至PVDF膜,TBST液清洗3次(每次5 min),用5%脱脂奶粉封闭2 h,再次TBST液清洗3次(10 min-1),敷一抗并4℃冰箱过夜,次日TBST液清洗3次(每次15 min)后敷二抗2 h,TBST液清洗3次(每次15min)并显影,待β-actin(1:10 000) 检测平衡后,依次检测Akt、P-Akt、Bcl-2和Bax(均1:5000) 蛋白表达,应用ImageJ V1.47H软件进行条带灰度值测定。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。Akt、p-Akt、Bcl-2和Bax蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表达差异有统计学意义。
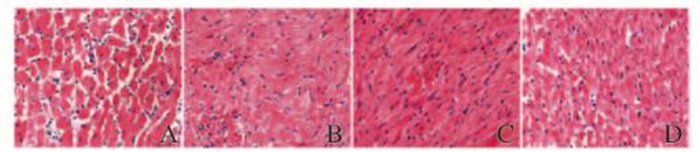
2 结果 2.1 心肌组织病理表现冷IRI组:心肌组织正常结构破坏,可见心肌细胞水肿、排列紊乱、心肌纤维断裂,心肌间质可见大量炎性细胞浸润,小血管扩张、充血,心肌损伤严重;SFN+IRI组:心肌细胞形态较正常,心肌结构较清楚,心肌纤维排列较整齐,心肌间质散在少量炎细胞浸润,心肌损伤较轻;LY +SFN组:应用LY294002阻滞剂后,心肌细胞、心肌纤维及间质中炎细胞的浸润情况介于LY+IRI组和SFN组之间。见图 1(插页五)。
|
| A:Cold IRI group; B:SFN group; C: LY+cold IRI group; D:LY+SFN group. 图 1 供心冷IRI后各组大鼠心肌组织病理学变化(HE,×400) Figure 1 Pathological changes of myocardium tissue of rats in various groups after cold IRI (HE, ×400) |
|
|
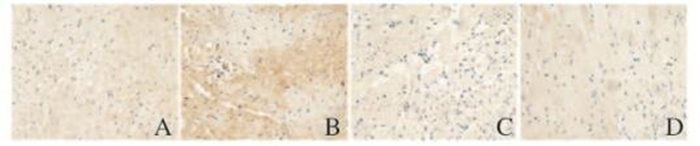
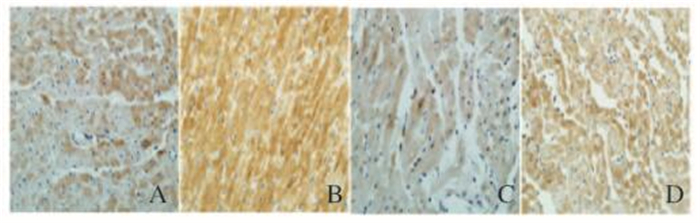
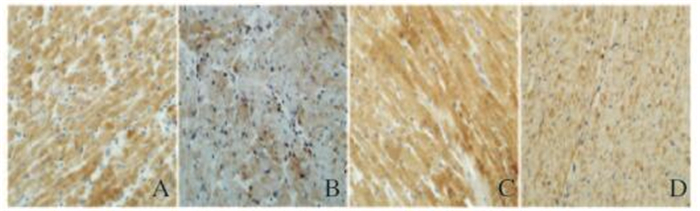
与冷IRI组比较,SFN组p-Akt蛋白表达水平明显升高(7.27±0.40 vs 5.30±0.37,P < 0.05),Bcl-2蛋白表达水平升高(5.82±0.34 vs 3.30±0.34,P < 0.05),而Bax蛋白表达水平降低(4.21±0.25 vs 5.32±0.23,P < 0.05);应用阻滞剂LY294002后,与LY+冷IRI组比较,SFN+LY组p-Akt蛋白表达水平无明显变化(5.25±0.36 vs 5.00±0.38,P>0.05),但Bcl-2蛋白表达水平仍增高(4.57±0.30 vs 3.28±0.15,P < 0.05),Bax仍降低(4.85±0.27 vs 5.28±0.26,P < 0.05),Bcl-2/Bax比值升高(0.94±0.02 vs 0.62±0.05,P < 0.05)。见表 1和图 2~4(插页五)。
| (n=8, x±s) | |||||
| Group | Akt | p-Akt | Bcl-2 | Bax | Bcl-2/Bax |
| Cold IRI | 4.25±0.16 | 5.30±0.37△ | 3.30±0.34△# | 5.32±0.23△# | 0.62±0.06△# |
| SFN | 4.32±0.23 | 7.27±0.40*# | 5.82±0.34*# | 4.21±0.25*# | 1.38±0.13*# |
| LY+cold IRI | 4.27±0.26 | 5.00±0.38△ | 3.28±0.15△# | 5.28±0.26△# | 0.62±0.05△# |
| LY+SFN | 4.27±0.16 | 5.25±0.36△ | 4.57±0.30*△ | 4.85±0.27*△ | 0.94±0.02*△ |
| *P < 0.05 vs cold IRI group; △P < 0.05 vs SFN group; #P < 0.05 vs LY+SFN group. | |||||
|
| A:Cold ІRI group; B:SFN group; C:LY+cold IRI group; D:LY+SFN group. 图 2 供心冷IRI后各组大鼠心肌组织中P-Akt蛋白表达(免疫组织化学法,×400) Figure 2 Expressions of P-Akt protein in myocardium tissue of rats in various groups after cold IRI(Inmiimohistochemistry, ×400) |
|
|
|
| A:Cold IRI group; B:SFN group; C: LY+cold IRI group; D:LY+SFN group. 图 3 供心冷IRI后各组大鼠心肌组织中Bd-2蛋白表达(免疫组织化学法,×400) Figure 3 Expressions of Bcl-2 protein in myocardium tissue of rats in various groups after cold IRI (Immunohistochemistry, ×400) |
|
|
|
| A:Cold IRI group; B:SFN group; C: LY+cold IRI group; D:LY+ SFN group. 图 4 供心冷IRI后各组大鼠心肌组织中Bax蛋白表达(免疫组织化学法,×400) Figure 4 Expressions of Bax protein in myocardium tissue of rats in various groups after cold IRI (Immunohistochemistry, ×400) |
|
|
与IRI组比较,SFN组p-Akt蛋白表达水平明显升高(1.53±0.03 vs 1.00±0.06, P < 0.05),Bcl-2蛋白表达水平升高(1.52±0.03 vs 0.81±0.03,P < 0.05),而Bax蛋白表达水平降低(0.46±0.05 vs 1.31±0.03,P < 0.05);应用阻滞剂LY294002后,与LY+IRI组比较,SFN+LY组p-Akt蛋白表达水平无明显差异(0.98±0.11 vs 0.98±0.08,P>0.05),但Bcl-2蛋白表达水平仍增高(1.19±0.07 vs 0.77±0.02,P < 0.05),Bax蛋白表达水平仍降低(0.94±0.09 vs 1.31±0.08,P < 0.05),Bcl-2/Bax比值升高(1.27±0.19 vs 0.59±0.03,P < 0.05)。见图 5和表 2。
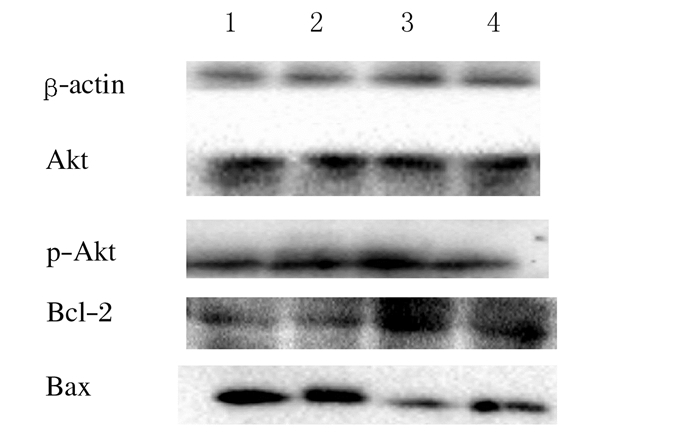
|
| Lane1:Cold IRI group; Lane2:LY+cold IRI group; Lane3:SFN group; Lane4:LY+SFN group. 图 5 供心冷IRI后各组大鼠心肌组织中Akt、p-Akt、Bcl-2和Bax蛋白表达电泳图 Figure 5 Electrophoregram of expressions of Akt, p-Akt, Bcl-2 and Bax proteins in myocardium tissue of rats in various groups after cold IRI |
|
|
| (n=8, x±s) | |||||
| Group | Akt | P-Akt | Bcl-2 | Bax | Bcl-2/Bax |
| Cold IRI | 1.21±0.05 | 1.00±0.06△ | 0.81±0.03△# | 1.31±0.03△# | 0.62±0.02△# |
| SFN | 1.25±0.09 | 1.53±0.03*# | 1.52±0.03*# | 0.46±0.05*# | 3.29±0.29*# |
| LY+cold IRI | 1.21±0.04 | 0.98±0.08△ | 0.77±0.02△# | 1.31±0.08*# | 0.59±0.03△# |
| LY+SFN | 1.23±0.09 | 0.98±0.11△ | 1.19±0.07*△ | 0.94±0.09*△ | 1.27±0.19*△ |
| *P < 0.05 vs cold IRI group; △P < 0.05 vs SFN group; #P < 0.05 vs LY+SFN group. | |||||
PI3K/Akt通路在对抗组织及细胞的IRI中发挥主要作用[10]。研究[11-12]表明:结扎大鼠左冠状动脉前降支制作心肌IRI模型及使用H9C2心肌细胞建立低氧/复氧模型,应用不同抗氧化剂干预结果显示:其心肌的保护作用是通过PI3K/Akt通路起作用。Leoncini等[3]用大鼠心肌细胞培养模型研究心肌IRI发现:SFN通过Akt通路影响二期酶的表达和活性。
本实验结果显示:Akt蛋白在各组中的表达虽有轻微变化,但差异无统计学意义;与IRI组比较,SFN组p-Akt蛋白表达水平明显升高(P < 0.05);应用阻滞剂LY294002后,与LY+IRI组比较,SFN+LY组p-Akt蛋白表达水平无明显变化(P>0.05),本文作者认为SFN可能通过磷酸化Akt对心肌冷IRI起作用,而该过程能够被LY294002所阻断,SFN通过激活PI3K/Akt信号通路对心肌冷IRI起保护作用。
3.2 Bcl-2家族与心肌IRIB细胞淋巴瘤/白血病-2基因(Bcl-2) 家族是由2组功能相互拮抗的蛋白组成,其中以Bcl-2及Bax蛋白与启动细胞凋亡的Caspase家族蛋白的关系最为密切。
Bcl-2是最早被确认的具有抗细胞凋亡作用的基因蛋白,主要分布于线粒体内膜等处,许多凋亡因素诱导的细胞凋亡均能被Bcl-2所抑制。Bcl-2的抗凋亡作用主要是通过抑制“线粒体途径”实现。Bax主要存在于细胞浆中,生理状态下是以非活性状态存在。当心肌IRI时,Bax的蛋白构型发生变化,使其活化并转移到线粒体膜与Bcl-2蛋白形成异源二聚体,从而抑制Bcl-2蛋白活性,促进了mPTP开放及线粒体膜电势(△ψm)的下降,维持了“线粒体途径”的促细胞凋亡作用。目前研究[13-15]认为:Bcl-2/Bax比值更能说明Bcl-2家族在心肌细胞凋亡中的作用,若比值升高说明抗凋亡作用占主导;反之,促凋亡作用占主导。
本实验结果显示:SFN组中Bcl-2蛋白表达水平升高,Bax蛋白表达降低,Bcl-2/Bax比值升高,与IRI组比较差异有统计学意义,说明SFN能够通过提高Bcl-2蛋白表达水平、抑制Bax的蛋白表达水平对心肌冷IRI起保护作用;LY294002干预后:LY+SFN组中Bcl-2蛋白表达水平降低、Bax蛋白表达水平升高,但Bcl-2/Bax比值仍升高,两者的水平均介于SFN组和LY+IRI组之间,并且与SFN组及LY+IRI组比较差异有统计学意义,说明LY294002能够抑制SFN对Bcl-2及Bax蛋白的调控作用,但不能完全阻断。
3.3 PI3K/Akt/Bcl2家族与心肌IRIXu等[16]将兔的冠状动脉前降支进行30 min结扎后放开,进行120 min再灌注制作心肌IRI模型,结果显示:毛柳甙能够通过PI3K/Akt信号通路影响Bcl2/Bax,这一通路能够被LY294002阻断。本研究结果显示:SFN能够通过激活PI3K/Akt信号通路进而提高Bcl-2蛋白表达、抑制Bax蛋白表达,从而对心肌冷IRI起保护作用,但SFN对Bcl-2和Bax的调控作用不是完全通过PI3K/Akt信号通路实现。因此,本文作者认为:PI3K/Akt信号通路介导SFN调控心脏移植心肌冷IRI的保护作用,但不是唯一信号通路。SFN的抗凋亡、抗氧化作用的机制尚需进一步研究。
| [1] | Mangini S, Alves BR, Silvestre OM, et al. Heart transplantation:review[J]. Einstein (Sao Paulo), 2015, 13(2): 310–318. DOI:10.1590/S1679-45082015RW3154 |
| [2] | Gewirtz H, Dilsizian V. Myocardial viability:survival mechanisms and molecular imaging targets in acute and chronic ischemia[J]. Circ Res, 2017, 120(7): 1197–1212. DOI:10.1161/CIRCRESAHA.116.307898 |
| [3] | Leoncini E, Malaguti M, Angeloni C, et al. Cruciferous vegetable phytochemical sulforaphane affects phase Ⅱ enzyme expression and activity in rat cardiomyocytes through modulation of Akt signaling pathway[J]. J Food Sci, 2011, 76(7): H175–H181. DOI:10.1111/jfds.2011.76.issue-7 |
| [4] | Fang J, Hu F, Ke D, et al. N, N-dimethylsphingosine attenuates myocardial ischemia-reperfusion injury by recruiting regulatory T cells through PI3K/Akt pathway in mice[J]. Basic Res Cardiol, 2016, 111(3): 32. DOI:10.1007/s00395-016-0548-3 |
| [5] | Yang B, Yan P, Gong H, et al. TWEAK protects cardiomyocyte against apoptosis in a PI3K/AKT pathway dependent manner[J]. Am J Transl Res, 2016, 8(9): 3848–3860. |
| [6] | 李占清, 伊雪, 邬鹏宇, 等. 莱菔硫烷对大鼠移植冷缺血再灌注的保护作用[J]. 中华胸心血管外科杂志, 2014, 30(4): 234–237. |
| [7] | 王帅, 伊雪, 邬鹏宇, 等. 莱菔硫烷抗凋亡对移植大鼠心脏的保护作用[J]. 医学研究生学报, 2014, 27(2): 157–159. |
| [8] | 韩燕, 李占清, 邬鹏宇, 等. 莱菔硫烷对大鼠移植心脏细胞凋亡的影响[J]. 中国老年学杂志, 2017, 37(6): 1335–1336. |
| [9] | 伊雪, 崔翔宇, 邬鹏宇, 等. N-乙酰半胱氨酸调控大鼠心肌冷缺血-再灌注损伤的变化[J]. 国际心血管病杂志, 2015, 42(2): 109–111. |
| [10] | 张静, 马翠丽, 王志国. 黄芪甲苷对大鼠心肌局部缺血再灌注损伤的改善作用及其对PI3K/Akt/mTOR信号通路的影响[J]. 吉林大学学报:医学版, 2014, 40(5): 991–996. |
| [11] | Rong R, Xijun X. Erythropoietin pretreatment suppresses inflammation by activating the PI3K/Akt signaling pathway in myocardial ischemia-reperfusion injury[J]. Exp Ther Med, 2015, 10(2): 413–418. DOI:10.3892/etm.2015.2534 |
| [12] | Li L, Zhou Y, Li Y, et al. Aqueous extract of Cortex Dictamni protects H9c2 cardiomyocytes from hypoxia/reoxygenation-induced oxidative stress and apoptosis by PI3K/Akt signaling pathway[J]. Biomed Pharmacother, 2017, 89: 233–244. DOI:10.1016/j.biopha.2017.02.013 |
| [13] | Wang Y, Hu Z, Sun B, et al. Ginsenoside Rg3 attenuates myocardial ischemia/reperfusion injury via Akt/endothelial nitric oxide synthase signaling and the B cell lymphoma/B cell lymphoma associated X protein pathway[J]. Mol Med Rep, 2015, 11(6): 4518–4524. DOI:10.3892/mmr.2015.3336 |
| [14] | Feng J, Yang Y, Zhou Y, et al. Bakuchiol attenuates myocardial ischemia reperfusion injury by maintaining mitochondrial function:the role of silent information regulator[J]. Apoptosis, 2016, 21(5): 532–545. DOI:10.1007/s10495-016-1225-6 |
| [15] | Yang Y, Duan W, Jin Z, et al. JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J]. J Pineal Res, 2013, 55(3): 275–286. DOI:10.1111/jpi.2013.55.issue-3 |
| [16] | Xu MC, Shi HM, Gao XF, et al. Salidroside attenuates myocardial ischemia-reperfusion injury via PI3K/Akt signaling pathway[J]. J Asian Nat Prod Res, 2013, 15(3): 244–252. DOI:10.1080/10286020.2012.762358 |
 2017, Vol. 43
2017, Vol. 43


