扩展功能
文章信息
- 王娇娇, 范智蕊, 李砺锋, 丁显飞, 周学良, 赵杰, 王留兴
- WANG Jiaojiao, FAN Zhirui, LI Lifeng, DING Xianfei, ZHOU Xueliang, ZHAO Jie, WANG Liuxing
- HPK1过表达对乳腺癌MCF-7和MDA-MB-231细胞增殖和凋亡的影响及其机制
- Influence of HPK1 overexpression in proliferation and apoptosis of breast cancer MCF-7 and MDA-MB-231 cells and its mechanism
- 吉林大学学报(医学版), 2017, 43(05): 910-917
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 910-917
- 10.13481/j.1671-587x.20170510
-
文章历史
- 收稿日期: 2017-05-20
2. 郑州大学第一附属医院肿瘤科, 河南 郑州 450052;
3. 郑州大学第一附属医院生物细胞治疗中心, 河南 郑州 450052;
4. 郑州大学第一附属医院综合ICU, 河南 郑州 450052;
5. 郑州大学第一附属医院药学部, 河南 郑州 450052
2. Department of Oncology, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
3. Department of Biological Cell Therapy Center, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
4. Department of General ICU, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
5. Department of Pharmacy, First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China
乳腺癌已经成为全球女性癌症死亡的第二大原因,其死亡人数占女性癌症总死亡人数的14%[1]。美国癌症协会预计:2017年美国乳腺癌新发病例约255180例,死亡41070例[1]。目前,乳腺癌在手术治疗、放疗、化疗和内分泌治疗等方面已经取得了明显的疗效,但其5年生存率依然较低。因此寻找新的改善乳腺癌患者预后的基因靶点有重要的意义[2]。造血祖细胞激酶1(hematopoietic progenitor kinase 1, HPK1) 是造血系统特异性丝氨酸/苏氨酸蛋白激酶,哺乳动物Ste-20相关蛋白激酶MAP4K家族成员之一[3]。HPK1在免疫反应和炎症信号通路以及造血细胞的应激反应、增殖和凋亡中发挥着重要作用[4],且其可能参与肿瘤的免疫治疗[5]。近年来的研究[6-9]发现:HPK1与胰腺癌、非小细胞肺癌、肺癌和膀胱癌等多种恶性肿瘤的发生发展有关。本课题前期研究[10]发现HPK1与非特异性浸润性乳腺癌的发生发展有关,为明确其机制,本研究通过构建慢病毒载体获得HPK1过表达的慢病毒颗粒,并感染乳腺癌MCF-7和MDA-MB-231细胞系,以探讨HPK1过表达对人乳腺癌细胞增殖、凋亡、细胞周期及迁移的影响,并分析其与增殖相关蛋白(Ki-67)、细胞凋亡相关蛋白(caspase 3)、抑癌相关蛋白(PTEN)和细胞迁移相关蛋白(MMP-9、MMP-2) 的表达的关系,初步探讨其可能的机制,并为HPK1应用于乳腺癌的治疗提供理论基础。
1 材料与方法 1.1 细胞系、主要试剂和仪器乳腺癌细胞系:MCF-7(雌激素受体阳性代表细胞系)和MD-MBA-231(三阴性乳腺癌代表细胞系),293T细胞(人肾胚细胞),慢病毒载体质粒pCDH-CMV-MCS-EF1-Puro、包装质粒pCMV-dR8.2 dvpr和pCMV-VSVG均为郑州大学肿瘤生物学研究室保存,DNA Marker、限制性内切酶XbaⅠ、NotⅠ及荧光定量PCR试剂盒均购自日本TaKaRa公司,无缝克隆试剂盒购自美国Vazyme公司,DNA纯化回收试剂盒、质粒小量提取试剂盒和PCR清洁回收试剂盒购自美国Axygen公司,Trizol购自美国Invitrigen公司,反转录试剂盒购自美国Fermentas公司,Matrigel和PI染色细胞周期检测试剂盒及Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒购自美国BD公司,兔抗人HPK1一抗购自美国Abgent公司。Transwell小室购自美国Coring公司,CO2培养箱为美国Thermo公司产品,流式细胞仪LSR Ⅱ为美国BD公司产品,光学显微镜XSP-8CA和倒置显微镜IX73为日本Olympus公司产品。
1.2 细胞培养、稳定细胞系的筛选和实验分组细胞培养:乳腺癌细胞常规培养于含有10%胎牛血清的DMEM培养基中,培养条件为37℃、5% CO2,第3天传代培养。培养MCF-7和MDA-MB-231于6孔板中,感染病毒Lentil-con及Lentil-HPK1,6 h后更换完全培养基,48 h后传至24孔板,加入含有6 mg· L-1嘌呤霉素的1640完全培养基持续培养2周,每3 d更换1次含嘌呤霉素的培养基,直至无细胞死亡为止,从而获得MCF-7-HPK1和MDA-MB-231-HPK1稳定细胞系。将细胞分为:空白组,未加处理因素;对照组(用空载体感染);HPK1过表达组(HPK1过表达的稳定细胞系)。
1.3 稳定细胞系的鉴定荧光定量PCR法检测HPK1 mRNA水平:利用TRIzol试剂盒提取RNA。引物由上海生工生物工程有限公司设计,荧光定量PCR引物见表 1。荧光定量PCR按照试剂盒说明书进行,利用ABI7500fast进行检测。PCR反应条件:95℃、30 s,95℃、5 s,60℃、30 s,共40个循环。HPK1 mRNA的相对表达水平利用Gene Tools软件进行灰度值分析,以GADPH作为内参。
| Primer | Primer sequence | Product size(bp) |
| HPK1 QF | 5′-AGATGCTCAGTCATCAAC-3′ | 199 |
| HPK1 QR | 5′-TCTGCATCTGGGATCCCC-3′ | |
| GADPH QF | 5′-AGAAGGCTGGGGCTCATTTG-3′ | 238 |
| GADPH QR | 5′-AGGGGCCATCCACAGTCTTC-3′ |
稳定细胞系和对照细胞系接种在96孔板中,细胞数为每毫升1×105个,每孔加入100 μL的细胞悬液,培养过夜后进行转染,每组设3个平行孔,37℃,分别培养24、48和72 h,加入5 g·L-1 MTT 20 μL,继续培养4 h,弃上清,每孔加入DMSO 150 μL,混匀,酶标仪(λ=570 nm)测定每孔的吸光度[A(570) 值],细胞生长的增殖率的计算方法:细胞生长增殖率=[1-实验组A(570)/对照组A(570)]×100%。
1.5 流式细胞术检测细胞周期和凋亡率选取对数期各组细胞,胰酶消化,用磷酸盐缓冲液洗涤细胞2次,1 500 r·min-1离心5 min,收集细胞;按照流式细胞凋亡检测试剂盒说明书进行操作,500 μL的联结缓冲液悬浮细胞,加入5 μLAnnexin Ⅴ-FITC和5 μL PI Staining Solution,轻轻混匀,避光、室温反应10 min,使用流式细胞仪检测细胞周期。采用FlowJo软件进行细胞DNA含量分析和光散射分析。收集细胞,参照AnnexinV-FITC/PI说明书进行操作,应用流式细胞仪检测细胞凋亡率。采用FlowJo软件进行细胞凋亡分析。
1.6 TUNEL法检测细胞凋亡将对数生长期的各组细胞传至24孔板中,待细胞贴壁生长24 h后,吸除培养液,PBS洗涤2次,每次5 min,室温干燥玻片5 min;用4%多聚甲醛固定30 min,再次用PBS清洗3次,每次5 min。加入50~100 μL破膜工作液,室温孵育10 min,PBS洗3次,每次5 min。加入50~100 μL TUNEL反应混合液(试剂1:TdT;试剂2:荧光素标记dUTP,1:9,新鲜配制)加到细胞上,37℃湿盒避光孵育60 min,湿盒内加少量水保持湿度。PBS避光洗3次,每次5 min;加入50~100 μL PI室温避光孵育10 min。PBS避光洗3次,每次5 min;用抗荧光淬灭封片剂封片,避光保存。在倒置显微镜下观察拍照,观察凋亡细胞并计数。
1.7 Transwell法检测细胞侵袭能力Transwell小室的制备:Matrigel(50 mg·L-1)用培养基按1:2稀释后,包被Transwell小室的底部,4℃风干。水化基底膜:加入PBS 37℃放置30 min后弃掉备用。在上室的聚碳酸酯膜上加入稀释好的Matrigel 60~80 μL,置于37℃,30 min使Matrigel聚合形成凝胶。接种细胞及培养:将细胞按照每毫升1×106个用无血清培养基重悬,取200 μL加入上室中,下室中加入正常培养基,常规培养12 h进行固定和染色。取Transwell小室,采用PBS淋洗,再用棉签擦去微孔膜上层细胞,采用甲醇:冰醋酸(比例为3:1) 固定10 min后,再用10% Giemsa染色。镜检:在倒置显微镜下计数移至微孔膜下层的细胞数目。每个样本需计数5~10个视野。
1.8 Western blotting法检测caspase 3、PTEN、MMP-9、MMP-2、Ki67和HPK1蛋白表达水平收集各组细胞,常规提取蛋白,BCA蛋白定量试剂盒检测样品蛋白浓度,取适量样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至硝酸纤维膜,5%封闭液4℃封闭4 h,依次加入一抗(caspase 3、PTEN、MMP-9、MMP-2、Ki67和HPK1,浓度为1:1 000),洗膜后加入辣根过氧化酶标记的二抗(辣根过氧化物酶标记的山羊抗体),β-actin为内参。增强化学发光试剂(ECL)发光法检测蛋白表达。
1.9 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组细胞HPK1mRNA及蛋白表达水平、增殖率、各期细胞比率和凋亡率均以x±s表示,两组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,SNK-q法进行两两比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 荧光定量PCR法检测HPK1 mRNA表达MDA-MB-231细胞系中相对于GAPDH mRNA的表达,与对照组(0.829±0.192) 比较,空白组HPK1 mRNA的相对表达水平(1.011±0.045) 差异无统计学意义(P>0.05);与空白组和对照组比较,过表达组HPK1 mRNA的相对表达水平(4.728±0.558) 均明显升高(P < 0.05)。MCF-7细胞系中相对于GAPDH mRNA的表达,与对照组(0.998±0.231) 比较,空白组HPK1 mRNA的相对表达水平(1.052±0.063) 差异无统计学意义(P>0.05);与空白组和对照组比较,过表达组HPK1 mRNA的相对表达水平(5.778±0.648) 均明显升高(P < 0.05)。见图 1。
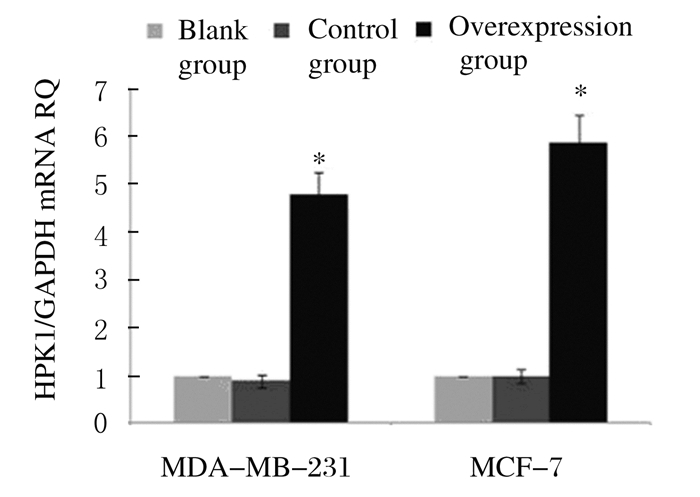
|
| *P < 0.05 compared with blank group; △P < 0.05compared with control group. 图 1 RT-PCR法检测MDA-MB-231和MCF-7细胞系中HPK1 mRNA相对表达水平 Figure 1 Relative expression levels of HPK1 mRNA in MDA-MB-231 and MCF-7 cell lines detected by RT-PCR method |
|
|
MDA-MB-231和MCF-7细胞系中,与对照组比较,空白组HPK1蛋白表达水平差异无统计学意义(P>0.05);与空白组和对照组比较,过表达组HPK1蛋白表达水平均明显升高(P < 0.05)。见图 2A。将蛋白印迹采用W-B应用软件分析后,得出相对密度直条图。见图 2B。
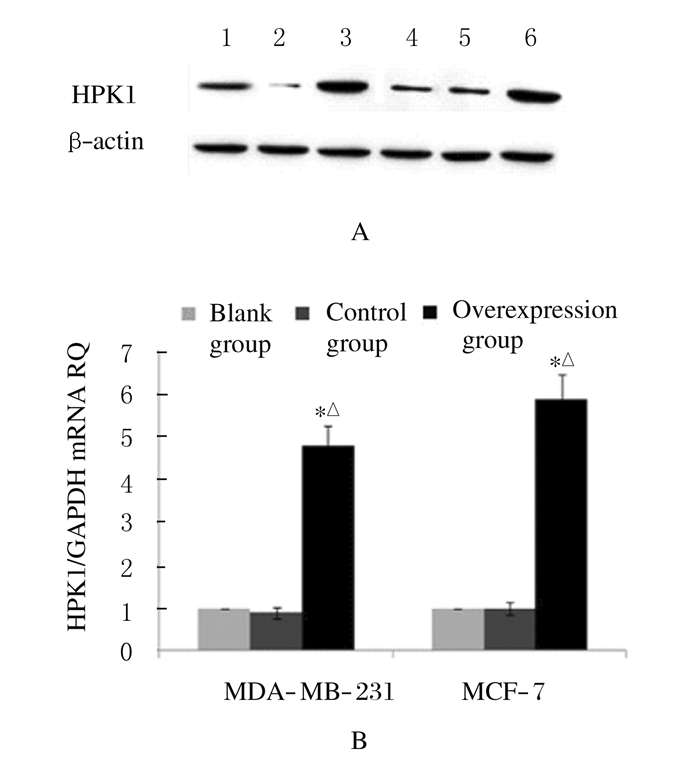
|
| Lane 1-3:MDA-MB-231 cell line; Lane 4-6:MCF-7 cell line; Lane 1, 4:Blank group; Lane 2, 5:Control group; Lane 3, 6:Overexpression group.*P < 0.05 compared with blank group; △P < 0.05compared with control group. 图 2 Western blotting法检测MDA-MB-231和MCF-7细胞系中HPK1蛋白表达电泳图(A)和直条图(B) Figure 2 Electrophoregram(A)and histogram(B) of HPK1 protein expressions in MDA-MB-231 and MCF-7 cell lines detected by Western blotting method |
|
|
MTT检测结果显示:在2个细胞系中,与空白组和对照组比较,HPK1过表达组的细胞增殖率明显降低(P < 0.05),其中在MCF细胞系中72 h时,与空白组和对照组比较,过表达组细胞增殖率降低最为明显(P < 0.01)。见表 2。
| (n=3, x±s, η/%) | |||||||
| Group | MDA-MB-231cell line | MCF-7 cell line | |||||
| (t/h) 24 | 48 | 72 | 24 | 48 | 72 | ||
| Blank | 50.069±0.953 | 162.679±15.475 | 231.085±12.240 | 54.571±1.240 | 207.201±10.631 | 281.594±8.902 | |
| Control | 49.622±0.899 | 173.677±21.060 | 228.781±13.970 | 56.988±14.091 | 195.759±12.276 | 262.932±9.238 | |
| Overexp-ression | 46.914±0.912*△ | 122.978±11.440*△ | 184.043±15.973**△△ | 33.608±5.081*△ | 140.007±22.289**△△ | 220.319±10.998**△△ | |
| *P < 0.05, ** P < 0.01 compared with blank group; △P < 0.05, △△P < 0.01 compared with control group. | |||||||
流式细胞术检测结果显示:在MDA-MB-231细胞系中,与空白组(16.47%±2.43%)和对照组(14.94%±3.05%)比较,HPK1过表达组细胞凋亡率(19.36%±2.67%)无明显变化(P>0.05);在MCF-7细胞系中,与空白组(10.91%±1.34%)和对照组(9.45%±2.72%)细胞凋亡率比较,HPK1过表达组的细胞凋亡率(15.57%±2.87%)无明显变化(P>0.05)。见图 3和表 3。流式细胞术检测细胞周期结果显示:MCF-7细胞系中HPK1过表达组的G1期细胞比率为78.43%±6.34%,明显高于空白组(50.91%±3.85%)和对照组(49.09%±2.87%),差异有统计学意义(P < 0.01),提示HPK1基因可能使MCF-7细胞阻断在G1期;但在MDA-MB-231细胞系中,HPK1过表达组、空白组和对照组的G1期细胞比率分别为40.64%±5.34%、46.29%±2.51%和45.06%±3.45%,组间比较差异无统计学意义(P>0.05)。见图 4和表 3。
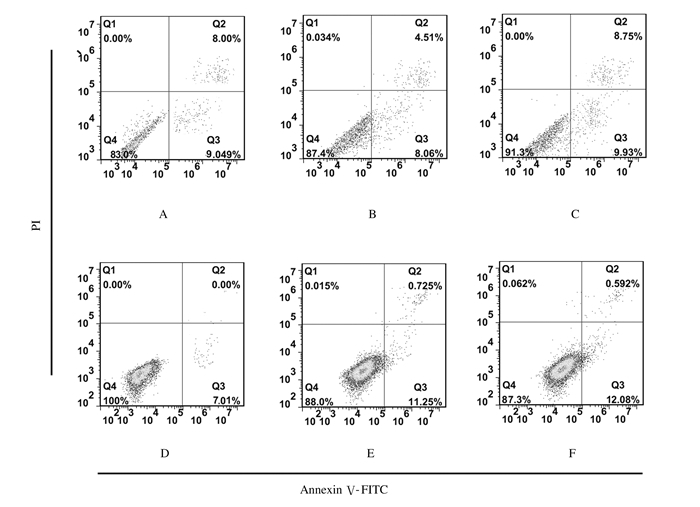
|
| A-C: MDA-MB-231 cell line;D-F: MCF-7 cell line; A, D: Blank group; B, E: Control group; C, F: Overexpression group. 图 3 流式细胞术检测各组MDA-MB-231和MCF-7细胞系凋亡率 Figure 3 Apoptotic rates of MDA-MB-231 and MCF-7 cell lines in various groups detected by flow cytometry |
|
|
| (n=3, x±s, η/%) | |||||
| Group | MDA-MB-231 | MCF-7 | |||
| Apoptotic rate | Cell cycle(G1) | Apoptotic rate | Cell cycle(G1) | ||
| Blank | 16.47±2.43 | 46.29±2.51 | 9.45±2.72 | 50.91±3.85 | |
| Control | 14.94±3.05 | 45.06±3.45 | 10.91±1.34 | 49.09±2.87 | |
| Overexpression | 19.36±2.67 | 40.64±5.34 | 11.57±2.87 | 78.43±6.34*△ | |
| *P < 0.01 compared with blank group; △P < 0.01 compared with control group. | |||||
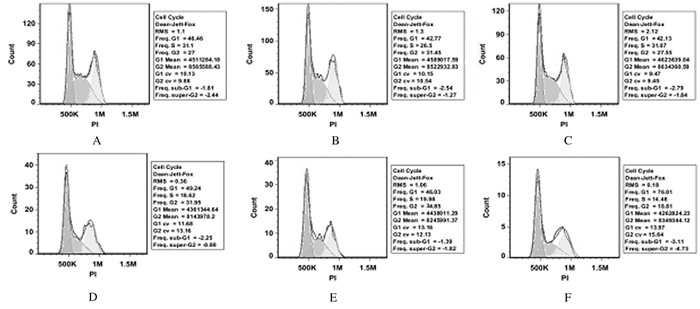
|
| A-C: MDA-MB-231 cell line;D-F: MCF-7 cell line; A, D: Blank group; B, E: Control group; C, F: Overexpression group. 图 4 流式细胞术检测MDA-MB-231和MCF-7细胞周期 Figure 4 Cell cycle of MDA-MB-231 and MCF-7 cell lines in various groups detected by flow cytometry |
|
|
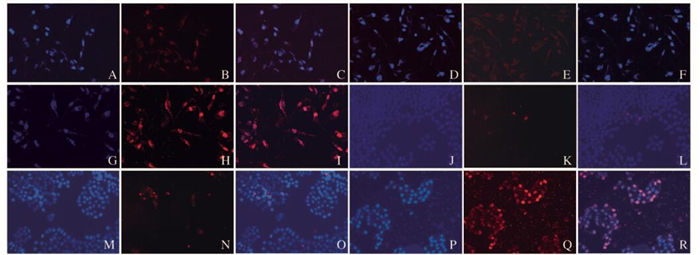
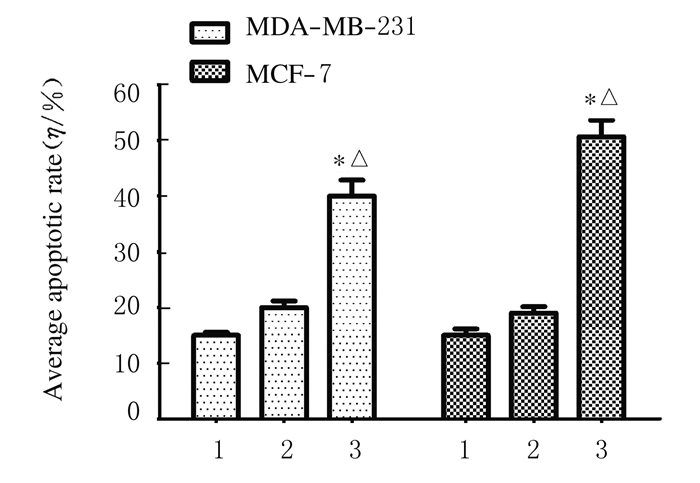
TUNEL法检测结果显示:与空白组和对照组比较,过表达组荧光标记的凋亡细胞衍生物明显增加(P < 0.05)。见图 5(插页四)和图 6。
|
| 图 5 TUNEL实验检测各组MDA-MB-231和MCF-7细胞系凋亡率 Figure 5 Apoptotic rates of MDA-MB-231 and MCF-7 cell lines in various groups detected by TUNEL assay |
|
|
|
| 1:Blank group; 2:Control group; 3:Overexpression group. 图 6 TUNEL实验检测各组MDA-MB-231和MCF-7细胞系凋亡率 Figure 6 Apoptotic rates of MDA-MB-231 and MCF-7 cell lines in various groups detected by TUNEL assay |
|
|
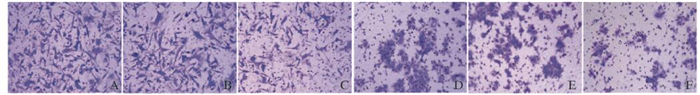
Transwell小室结果显示:在MDA-MB-231细胞系中,与空白组(349±41) 和对照组(364±23) 比较,HPK1过表达组的穿越Matrigel的细胞数(290±29) 明显减少,其中过表达组明显低于空白组和对照组(P=0.008,P=0.007),空白组与对照组比较差异无统计学意义(P=0.235);在MCF-7细胞系中,与空白组(210±45) 和对照组(198±29) 比较,HPK1过表达组的穿越Matrigel的细胞数(110±29) 明显减少,其中过表达组明显低于空白组和对照组(P < 0.001),空白组与对照组比较差异无统计学意义(P=0.524)。见图 7(插页四)。
|
| A—C: MDA-MB-231 cell line; D —F: MCF-7 cell line; A, D: Blank group; В, E: Control group; С, F: Overexpression group. 图 7 Transwell法检测各组MDA-MB-231和MCF-7细胞系侵袭能力 Figure 7 Invasive abilities of MDA-MB-231 and MCF-7 cell lines in various groups detected by Trans well assay |
|
|
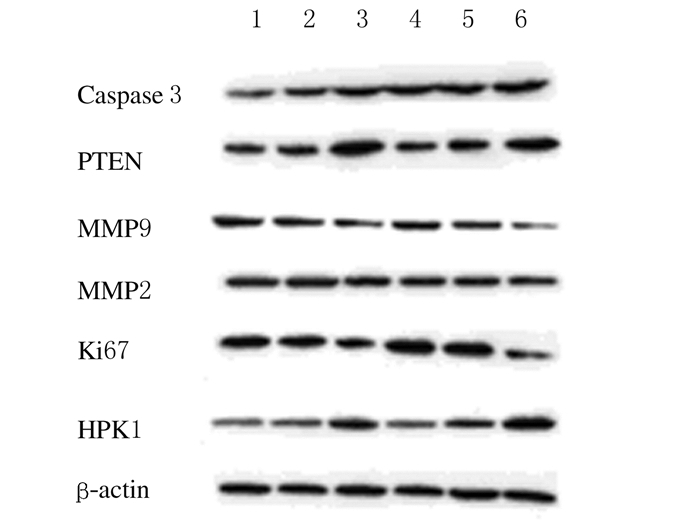
Western boltting法检测结果显示:在MDA-MB-231细胞系及MCF-7细胞系中,与空白组和对照组比较,HPK1过表达组中caspase 3、PTEN的表达均明显上调,MMP-9、MMP-2和Ki-67的表达水平明显下调(P < 0.05,见图 7),但同一个细胞系空白组和对照组细胞中caspase 3、PTEN、MMP-9、MMP-2、Ki-67和HPK1蛋白表达水平比较差异无统计学意义(P>0.05)。见表 4和图 8。
| (n=3, x±s) | |||||||||||||
| Group | MDA-MB-231 | MCF-7 | |||||||||||
| HPK1 | caspase 3 | PTEN | MMP-9 | MMP-2 | Ki-67 | HPK1 | caspase 3 | PTEN | MMP-9 | MMP-2 | Ki-67 | ||
| Blank | 0.296±0.041 | 0.398±0.037 | 0.483±0.052 | 0.914±0.042 | 1.539±0.068 | 1.682±0.091 | 0.538±0.063 | 0.763±0.052 | 0.578±0.045 | 0.713±0.081 | 1.419±0.072 | 1.756±0.081 | |
| Control | 0.324±0.078 | 0.425±0.086 | 0.528±0.037 | 0.875±0.028 | 1.627±0.047 | 1.598±0.037 | 0.624±0.025 | 0.804±0.027 | 0.721±0.068 | 0.798±0.023 | 1.328±0.081 | 1.636±0.056 | |
| Overexp-ression | 0.659±0.035**△△ | 0.894±0.042**△△ | 1.527±0.029**△△ | 0.496±0.051**△△ | 1.436±0.029*△△ | 1.324±0.051*△ | 1.126±0.047**△△ | 1.258±0.019**△△ | 1.482±0.037**△△ | 0.356±0.057**△△ | 1.105±0.043*△ | 0.883±0.073*△ | |
| *P < 0.05, ** P < 0.01 compared with blank group; △P < 0.05, △△P < 0.01 compared with control group. | |||||||||||||
|
| Lane 1-3: MDA-MB-231 cell line; Lane 4-6: MCF-7 cell line; Lane 1, 4: Blank group; Lane 2, 5:Control group; Lane 3, 6:Overexpression group. 图 8 Western blotting法检测各组乳腺癌细胞凋亡、细胞增殖和细胞迁移相关蛋白表达电泳图 Figure 8 Electrophoregram of expressions of apoptosis, cell proliferation and cell migration-related proteins in breast cancer cells in various groups detected by Western blotting method |
|
|
本研究利用构建慢病毒pCDH-HPK1-puro重组载体,包装病毒、转染乳腺癌MCF-7和MDA-MB-231,成功获得了HPK1过表达细胞系;PCR基因扩增全长凝胶电泳,以及RT-PCR法、Western blotting法检测过表达细胞系中HPK1mRNA和蛋白的高表达均证明了载体构建的成功。该研究首次证明了HPK1过表达可抑制人乳腺癌细胞的增殖并诱导凋亡。MTT法检测结果显示:2种细胞系HPK1过表达组中,其24、48和72 h的细胞增殖能力均明显受到抑制。流式细胞术检测结果显示:2种细胞系各组间的细胞凋亡率比较差异无统计学意义;MCF-7细胞系中过表达组的G1期细胞比率明显高于对照组和空白组,乳腺癌细胞系中HPK1过表达可使细胞周期阻断在G1期。TUNEL检测结果显示:HPK1过表达可诱导细胞凋亡。Transwell检测结果表明:HPK1过表达可抑制乳腺癌细胞的迁移。以上结果皆显示:HPK1过表达可明显抑制乳腺癌细胞的增殖、迁移,并诱导其凋亡。流式细胞术检测与TUNEL法检测凋亡检测结果不一致,考虑其可能的原因是TUNEL的灵敏度高,能识别凋亡早期的细胞[11]。总之,HPK1过表达可抑制乳腺癌细胞增殖、迁移,并诱导其凋亡,并使乳腺癌细胞周期阻断在G1期;HPK1作为潜在的基因靶点,未来在乳腺癌的预后治疗中有一定的应用前景。
HPK1是MAP4K家族的重要成员之一,具有重要的生物学作用。其在多种恶性肿瘤中表达较低,且可能参与了肿瘤细胞的增殖、侵袭和转移等。同样,Li等[8]研究表明:HPK1可以抑制肺癌细胞的增殖、集落形成、迁移和浸润等。Wang等[6]指出:胰腺癌细胞中的HPK1经蛋白酶介导降解后缺失,提示HPK1降解可能参与了胰腺癌的发生发展进程中。Alzabin等[7]发现:HPK1是抑制前列腺素E2介导的抗肿瘤免疫反应的重要组成部分。此外,HPK1可以用于预测肿瘤进展或者复发的指标。van der Heijden等[12]的研究表明HPK1可以作为早期膀胱癌进展的预后因素;Lin等[13]也发现HPK1可预测基于奥沙利铂辅助化疗的结直肠癌患者的复发及死亡的风险。由此可见,HPK1蛋白可能具有抗癌作用,上调其表达或增强其活性可能成为治疗恶性肿瘤的重要手段[5]。
随着技术进步,慢病毒包装系统已经发展到第4代,具有更强的选择性、稳定性和安全性[14]。因此,通过慢病毒包装系统过表达HPK1是一种安全稳定且成熟有效的手段。通过细胞增殖、细胞凋亡和细胞迁移相关蛋白表达分析,既往研究[15]表明caspase 3参与了乳腺癌细胞的凋亡,MMP与乳腺癌的迁移密切相关[16],Ki-67的水平可用来评估乳腺癌的增殖[17]。本研究中,Western blotting法检测结果表明:过表达组细胞中caspase 3、PTEN蛋白的表达水平上调,MMP-9、MMP-2和Ki-67蛋白的表达水平下降,表明HPK1对乳腺癌细胞作用的相关机制可能与这些相关蛋白的表达有关。
综上所述,乳腺癌细胞系MCF-7和MDA-MB-231中HPK1的表达上调可明显抑制乳腺癌细胞的增殖和转移,并诱导细胞凋亡,还可使MCF-7细胞系阻断在G1期,这可能与细胞增殖、凋亡和迁移相关蛋白的表达密切相关,对MCF-7和MDA-MB-231细胞系的影响不尽相同,考虑乳腺癌细胞系的不同分子表型可能会影响HPK1的抑癌作用。本研究为后续探索HPK1过表达抑制乳腺癌的机制奠定了基础,也为乳腺癌的治疗提供了新方向。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | 丁显飞, 周学良, 豆萌萌, 等. 哺乳动物雷帕霉素靶蛋白的表达及其与乳腺癌预后关系的Meta分析[J]. 吉林大学学报:医学版, 2016, 42(4): 783–788. |
| [3] | Ling P, Yao Z, Meyer CF, et al. Interaction of hematopoietic progenitor kinase 1 with adapter proteins Crk and CrkL leads to synergistic activation of c-Jun N-terminal kinase[J]. Mol Cell Biol, 1999, 19(2): 1359–1368. DOI:10.1128/MCB.19.2.1359 |
| [4] | Chuang HC, Wang X, Tan TH. MAP4K family kinases in immunity and inflammation[J]. Adv Immunol, 2016, 129: 277–314. DOI:10.1016/bs.ai.2015.09.006 |
| [5] | Sawasdikosol S, Zha R, Yang B, et al. HPK1 as a novel target for cancer immunotherapy[J]. Immunol Res, 2012, 54(1-3): 262–265. DOI:10.1007/s12026-012-8319-1 |
| [6] | Wang H, Song X, Logsdon C, et al. Proteasome-mediated degradation and functions of hematopoietic progenitor kinase 1 in pancreatic cancer[J]. Cancer Res, 2009, 69(3): 1063–1070. DOI:10.1158/0008-5472.CAN-08-1751 |
| [7] | Alzabin S, Pyarajan S, Yee H, et al. Hematopoietic progenitor kinase 1 is a critical component of prostaglandin E2-mediated suppression of the anti-tumor immune response[J]. Cancer Immunol Immunother, 2010, 59(3): 419–429. DOI:10.1007/s00262-009-0761-0 |
| [8] | Li Z, Park HR, Shi Z, et al. Pro-oncogenic function of HIP-55/Drebrin-like (DBNL) through Ser269/Thr291-phospho-sensor motifs[J]. Oncotarget, 2014, 5(10): 3197–3209. DOI:10.18632/oncotarget.v5i10 |
| [9] | Wang Y, Luo H, Li Y, et al. hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnostic marker in human bladder urothelial carcinomas[J]. Mol Med Rep, 2012, 5(1): 260–265. |
| [10] | 王娇娇, 宋丽杰, 杨森, 等. 造血祖细胞激酶1在雌激素受体阳性乳腺癌中的表达及其与预后的关系[J]. 中华实验外科杂志, 2016, 33(8): 2022–2025. |
| [11] | Tavangar F, Sepehri H, Saghaeian Jazi M, et al. Amphotericin B potentiates the anticancer activity of doxorubicin on the MCF-7 breast cancer cells[J]. J Chem Biol, 2017, 10(3): 143–150. DOI:10.1007/s12154-017-0172-1 |
| [12] | van der Heijden AG, Mengual L, Lozano JJ, et al. A five-gene expression signature to predict progression in T1G3 bladder cancer[J]. Eur J Cancer, 2016, 64: 127–136. DOI:10.1016/j.ejca.2016.06.003 |
| [13] | Lin M, Zhang Y, Li A, et al. High-throughput RNAi screening of human kinases identifies predictors of clinical outcome in colorectal cancer patients treated with oxaliplatin[J]. Oncotarget, 2015, 6(18): 16774–16785. DOI:10.18632/oncotarget.v6i18 |
| [14] | 孟凡荣, 陈琛, 万海粟, 等. 慢病毒载体及其研究进展[J]. 中国肺癌杂志, 2014(12): 870–876. DOI:10.3779/j.issn.1009-3419.2014.12.09 |
| [15] | Yan F, He Q, Hu X, et al. Direct regulation of caspase-3 by the transcription factor AP-2 is involved in aspirininduced apoptosis in MDAMB453 breast cancer cells[J]. Mol Med Rep, 2013, 7(3): 909–914. DOI:10.3892/mmr.2013.1257 |
| [16] | Yelken Bö, Balci T, Süslüer SY, et al. The effect of tomatine on metastasis related matrix metalloproteinase (MMP) activities in breast cancer cell model[J]. Gene, 2017, 627: 408–411. DOI:10.1016/j.gene.2017.06.054 |
| [17] | Harvey J, Thomas C, Wood B, et al. Practical issues concerning the implementation of Ki-67 proliferative index measurement in breast cancer reporting[J]. Pathology, 2015, 47(1): 13–20. DOI:10.1097/PAT.0000000000000192 |
 2017, Vol. 43
2017, Vol. 43


