扩展功能
文章信息
- 韩明林, 李明贺, 及昕, 韩茹钰, 张宁, 崔磊华, 孙兰芳, 韩成敏
- HAN Minglin, LI Minghe, JI Xin, HAN Ruyu, ZHANG Ning, CUI Leihua, SUN Lanfang, HAN Chengmin
- 兔颞下颌关节突缺损模型的建立和CFR-PEEK材料人造关节的修复效果评价
- Establishment of TMJ defect models and evaluation on repair effect of CFR-PEEK material artificial joint in rabbits
- 吉林大学学报(医学版), 2017, 43(05): 903-909
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 903-909
- 10.13481/j.1671-587x.20170509
-
文章历史
- 收稿日期: 2017-03-19
2. 吉林大学口腔医院消毒供应室, 吉林 长春 130021;
3. 吉林大学口腔医院正畸科, 吉林 长春 130021
2. Department of Sterilization and Supply Center, Stomatology Hospital, Jilin University, Changchun 130021, China;
3. Department of Orthodontics, Stomatology Hospital, Jilin University, Changchun 130021, China
聚醚醚酮(polyetheretherketone,PEEK)是一种半晶型芳香族热塑性工程塑料,具有优良的机械性能、热稳定性和环境阻力[1]。PEEK抗压力强,不会因压力变化而发生改变,此外其在弹性、硬度、抗拉强度以及抗腐蚀、磨损和疲劳等方面的性能也很优越,而且材料在人体环境中能够与人体内的皮质骨并存[2-3]。但纯PEEK自身强度不足, 不能为骨缺损修复过程提供稳定的体内环境,在医学临床应用中受到很大限制。为了提高其力学强度,研究者制备合成了碳纤维(carbon fibre,CF)增强型PEEK复合材料, 拥有非常卓越的机械力学和生物学性能,尤其是其弹性模量与皮质骨的弹性模量接近[4],使其在口腔颌面整形外科及关节外科中得到广泛应用。碳纤维增强型聚醚醚酮(CFR-PEEK)作为一种升级改良的增强型植入材料,逐渐成为取代金属类植入物的主要候选材料[5],其在牙种植外科、骨折固定和整形外科中的应用受到极大的关注。Banks等[6]利用“拼图设计”技术将PEEK作为一种植入体重建修复上颌骨及眼眶的缺损,在纠正颌面创伤后畸形中取得较好的效果。PEEK和CFR-PEEK应用于整形修复尤其是口腔颌面缺损的重建中被证明是一种安全可靠的方法[7]。但作为一种关节植入材料,CFR-PEEK在颞下颌关节(temporomandibular joints,TMJ)重建中的应用未见相关报道。本实验首次利用CFR-PEEK材料制作人工TMJ进行关节的重建,旨在为口腔颌面外科TMJ缺损的治疗提供重要参考。
1 材料与方法 1.1 实验动物和主要材料健康成年日本大耳白兔13只,雌雄不限,体质量2.5~3.0 kg,4~6月龄,生长状况均衡,由吉林大学动物实验中心提供,动物合格证号:SCXK(吉) 2012-0002。CFR-PEEK由吉林大学化学院合成并提供。T型5孔钛板(1.5 mm×5.0 mm)和钛钉购自江苏康普达医疗器械有限公司。
1.2 实验动物分组和处理方式13只日本大耳白兔,按照随机数字法分为:CFR-PEEK人造关节植入组(切除右侧TMJ关节突,建立关节缺损模型,同期植入CFR-PEEK人造关节),共6只;阳性对照组(切除右侧TMJ关节突,建立关节缺损模型,不植入CFR-PEEK人造关节),共4只;阴性对照组(不做任何处理),共3只。
1.3 手术入路横行切口:自眼外侧眦下0.5~1.0 cm处作横行切口,平行于眼眶下缘,长2.0~3.0 cm。纵行切口:自眼外侧眦下0.5~1.0 cm处作纵行切口,垂直于眼眶下缘,长2.0~3.0 cm。T型切口:自眼外侧眦下0.5~1.0 cm处作横行切口,平行于眼眶下缘,长约2.0 cm,垂直于横行切口在其中点作垂直切口,长2.0~3.0 cm。
兔TMJ的解剖结构与人体存在一定差异,而且尚无明确的关于功能部位的研究报道,所以建立稳固的TMJ运动模型和确定其运动关节突功能部位很重要,实验中可选择不同的手术切口(表 1)。
| Incision type | Body mark | Trauma | Field of vision | Applicable models | Experimental range |
| Transverse incision | 1(Fig. 1) | Little injury | Joint function and joint capsule | Injury model | Joints and joint capsule damage experiment |
| Longitudinal incision | 2(Fig. 1) | Easy to damage blood vessels and nerves | Joint function Joint capsule and part of mandibule | Joint function defect model | Joint rectangle or cone defect model experiment |
| T-type incision | 1+2(Fig. 1) | Greater trauma | Joint function Joint capsule and mandibule | Improved joint defect model | Flag-shaped or mandibular resection defect model experiment |
称量大耳白兔体质量并记录;兔夹固定大耳白兔,按体质量于耳缘静脉注射麻药(给予3%戊巴比妥钠1 mL·kg-1);剪去大耳白兔右侧颞下颌关节区自眼外侧眦至外耳道根部兔毛,范围5.0 cm×5.0 cm,充分暴露手术区周围皮肤,碘伏消毒、铺单;自眼外侧眦下0.5~1.0 cm(设为手术原点)处作纵行切口,垂直于眼眶下缘,长2.0~3.0 cm,分层剥离(注意保护耳前深部血管及神经),充分暴露大耳白兔TMJ关节突,可见关节突位于眼眶外侧下缘0.5~1.0 cm(手术原点体表对应外侧眦下0.5~1.0 cm)处,并位于眼眶下颧骨后内侧,其形状为不规则光滑突起,颈部短而不明显,直接连接于下颌骨;自关节突向后约1.0 cm,向下1.0~2.0 cm处方块切除下颌骨,造成TMJ关节突缺损模型。
1.5 TMJ关节突缺损修复模型的构建体外测量兔TMJ的各项数据,根据数据和构建的缺损模型制作CFR-PEEK人工关节。将制作的CFR-PEEK人工关节植入至实验组(切除右侧TMJ关节突,建立了关节突缺损模型)兔活体内,构建大耳白兔TMJ关节突缺损的修复模型。
1.6 CT检查评估植入效果实验后第3个月末抓取所有实验兔,按体质量于耳缘静脉注射麻药(给予3%戊巴比妥钠1 mL·kg-1),全麻后拍摄CT和锥形束CT(CBCT), 经三维重建和体外显影后观察CFR-PEEK人工关节植入后效果。
1.7 兔体质量观察考虑到进食及其排便等因素对体质量的影响,每日早晨8点(进食前)对兔体质量进行称量和记录,连续观测13周,将每周的体质量变化绘制成线性图。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组实验兔的体质量以x±s表示,组间比较采用两独立样本t检验。以α=0.05为检验水准。
2 结果 2.1 兔TMJ的解剖学表现和运动模型的建立兔TMJ解剖结构与人体存在一定差异,主要表现为以下几个方面:① 没有明确的关节窝,和颅脑位置相隔较远。② 运动关节突(髁突)在前,无喙突或者喙突在后,因此兔运动关节突位置靠前,约位于眼眶外侧下缘0.5~1.0 cm(设为手术原点,其体表对应外侧眦下0.5~1.0 cm)处(图 1,见插页三),并位于眼眶下颧骨后内侧。③ 关节突向前后和内外都突出,但颈部短而不明显,向后和向下连接于下颌骨,而且下颌骨菲薄;关节的颞后附着在后上方,其间混杂有颞筋膜和肌肉。

|
| 1:Transverse incision line; 2:Longitudinal incision line; Yellow spot:Surgery spot. 图 1 兔TMJ体表投影和切口标线 Figure 1 Surface projection of TMJ and incision lines of rabbits |
|
|
① 横行切口:可直接暴露关节突位置,不易损伤耳前横行的血管及神经,可小切口建立兔TMJ关节损伤模型;② 纵行切口:可直接暴露关节突位置,易损伤耳前横行的血管及神经(图 2,见插页三),向两侧剥离可建立兔TMJ关节突缺损模型,向下沿着下颌骨剥离可建立兔TMJ关节突缺损固定模型,特别是长方形或者锥形的缺损模型;③ T型切口:可直接暴露关节突位置,易损伤耳前横行的血管及神经(图 3,见插页三),但不需向两侧剥离即可建立兔TMJ关节突缺损模型,向下沿着下颌骨剥离可建立兔TMJ关节突缺损固定模型,特别是改良型缺损模型(旗型缺损模型)。
|
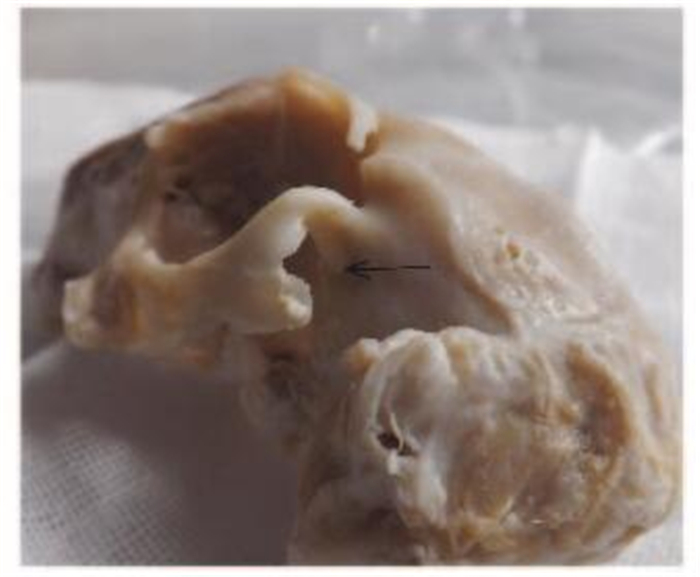
| The arrow indicated the position of articular fossa. 图 2 兔TMJ关节窝位置 Figure 2 Position of TMJ articular fossa of rabbits |
|
|
|
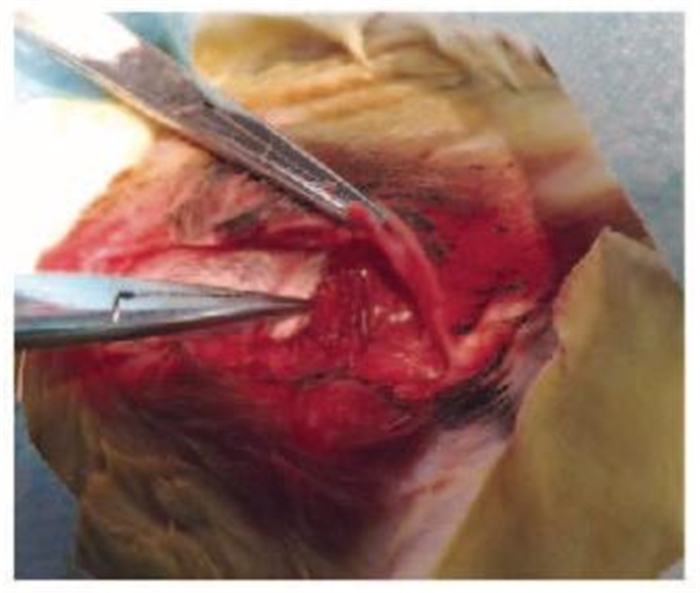
| 图 3 兔耳前横行通过的血管和其下的神经 Figure 3 Blood vessels and nerves in front of rabbit's ear |
|
|
纵行切口切开至骨面,可充分暴露下颌骨和眼眶下颧骨,切除部分颧骨充分暴露颞下颌关节突,向后向下向上充分剥离暴露上颌骨升支及关节(图 4和5,见插页三)。通过体外测量兔下颌骨模型得到如下数据:上颌骨升支宽1.0~1.5 cm,长3.0~3.5 cm,关节突顶至下颌骨体底部的高度为4.0~4.5 cm, 下颌骨升支距离为3.0~4.0 cm, 上部关节突前沿至颌骨后沿宽1.0~1.3 cm,升支顶部在关节突下1.4 cm处因移行较其下升支窄约0.2 cm(图 5,见插页三)。因此一般截取关节的长度为1.4~1.5 cm,宽度为0.6~1.0 cm,形状类似长方形或者锥形(图 6,见插页四)。
|
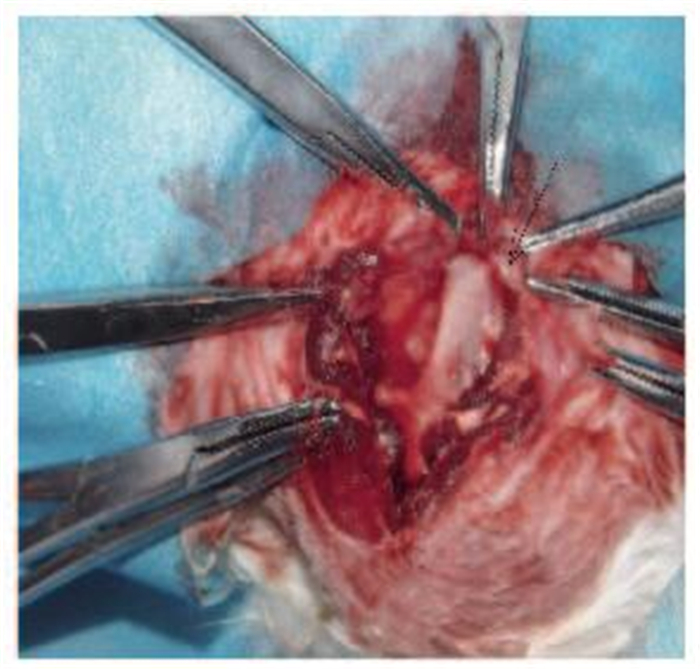
| The arrow indicated the articular process, articular disc and articular capsule. 图 4 兔TMJ关节解剖 Figure 4 Anatomy of rabbit's TMJ |
|
|

|
| A:Height of mandibular vertical ramus; B:Positon under joint; C:Height of articular process to the bottom of mandibular body; D:Width of mandibular's norma posterior; E:Width of articular process's top; F:Width of mandibular bertical ramus. 图 5 体外测量兔下颌骨模型 Figure 5 Measurement of rabbit mandibular model in vitro |
|
|
|
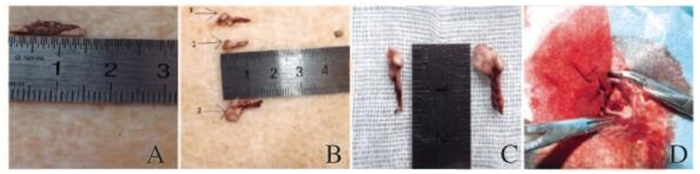
| A:Resection of zyhoma; B:Three types of resective joints(1:Conedefect model; 2:Rectangle defect model; 3:Flag-shaped defect model); C:Comparison of traditional joints and improved joins; D:Estabishment of joint defect model in rabbits. 图 6 兔TMJ关节突缺损模型 Figure 6 Defect models of TMJ's articular process in rabbits |
|
|
改良型缺损模型形状类似旗形,截取关节的长度为1.4~1.5 cm,关节上部、关节头后部颌骨一起切除,切除部分为向下延伸0.5~0.8 cm(图 6,见插页四),其结果将不造成关节干扰,并且最大程度保留后部升支骨利于固位。
2.4 CFR-PEEK人工关节植入兔TMJ关节突缺损模型将CFR-PEEK材料利用口腔技工打磨机个性化制作CFR-PEEK人工关节(图 7,见插页四)。为了加强固位效果,在利用CFR-PEEK人工关节材料作为固位板的同时引入钛板坚强固定和升支局部固定,能有效防止人造关节的移动(图 7,见插页四)。在体外模拟兔张闭口运动时关节突的运动轨迹,并与正常关节比较,评价所建立的TMJ修复模型是否可行(图 8,见插页四)。比较无差异后成功植入实验组活体内(图 7,见插页四)。
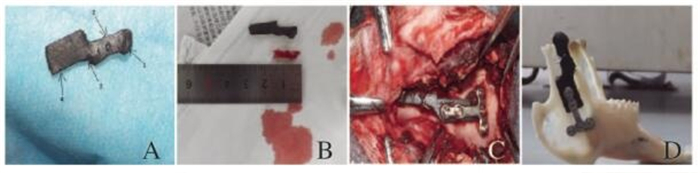
|
| A:CFR-PEEK artificial joint(1:Functional articular process; 2:Position fixed by mandibular vertical ramus; 3:Fixation; 4:Fixed position of plate); B:Comparison of artificial joint and resective joint; C:Fixed joints of rabbit in vivo; D:Rabbit's TMJ fixed model in vitro. 图 7 CFR-PEEK人工关节和植入固定 Figure 7 CFR-PEEK artificial joints and inplant fixation |
|
|
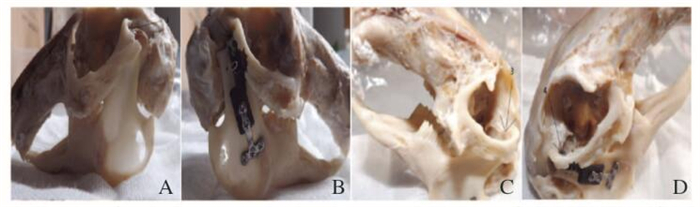
|
| A:Position of articular process in closed-mouth; В: Position of CFR-PEEK artificial articular process in closed-mouth; C: Position of articular process in opening-mouth; D: Position of CFR-PEEK artificial process in opening-mouth. 图 8 TMJ运动模型的建立 Figure 8 Establishment of TMJ movement model |
|
|
植入CFR-PEEK人工关节术后3个月CT影像学检查结果显示:植入关节固位良好无脱落,下颌骨无骨折,固位钛板及植入关节与周围组织愈合良好无明显不良反应(图 9和10,见插页四)。口腔颌面CBCT三维结果只可显示固位钛板及固位钉,无法显示CFR-PEEK人工关节,但在人工关节上预留的显影标志表明植入人工关节固位良好(图 9,见插页四);体外经显影处理后可见植入CFR-PEEK人工关节固位良好,与周围组织未形成错位愈合,并且与对侧正常关节无明显形态差异(图 10,见插页四)。
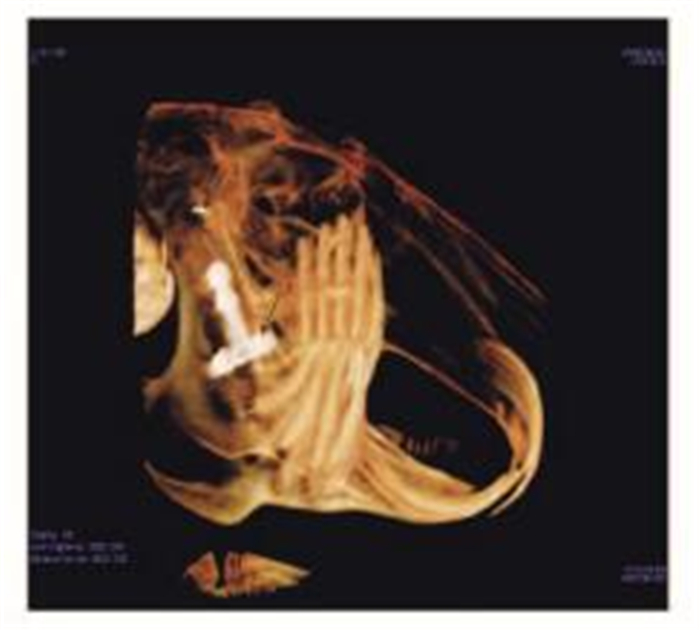
|
| 1 : Enhancement sign of CFR-PEEK artificial joint; 2: Fixed titanium plate. 图 9 CBCT三维重建影像 Figure 9 Three-dimensional reconstruction image of CBCT |
|
|
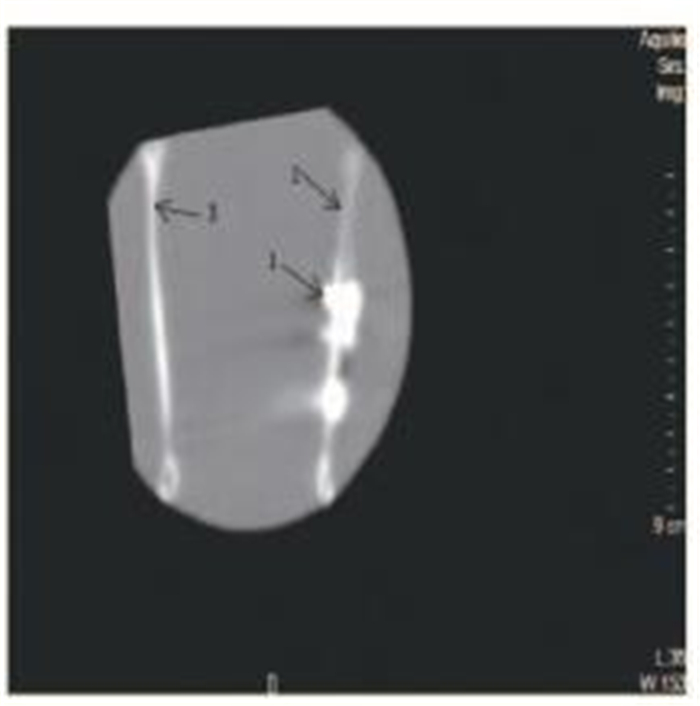
|
| 1:Fixed titanium plate; 2:CFR-PEEK artificial joint; 3: Contralateral normal joint. 图 10 体外经显影处理后的CT影像 Figure 10 CT images treated by contrast in vitro |
|
|
每日早晨进餐前,称量所有实验兔的体质量,连续记录13周,实验组和阴性对照组兔体质量均正常增长,而切除一侧TMJ关节突的阳性对照组兔体质量未见明显增加。与阳性对照组比较,实验组兔体质量明显增加(P < 0.05);实验组和阴性对照组兔体质量均明显增加,但2组间比较差异无统计学意义(P>0.05)。实验组兔第3~8周时兔体质量增长较快,第8周后体质量增长缓慢,这与正常的阴性对照组保持一致,而阳性对照组兔在13周的观测过程中体质量增长都较为缓慢,甚至停止增长或者负增长,无明显规律。各组兔体质量见表 2。
| (x±s, m/kg) | ||||||||||||||
| Group | n | Body weight | ||||||||||||
| (Week)1 | 2 | 3 | 4 | 5 | 6 | 7 | (Week)8 | 9 | 10 | 11 | 12 | 13 | ||
| Positive control | 4 | 2.70±0.04 | 2.74±0.03 | 2.75±0.03 | 2.76±0.05 | 2.85±0.04 | 2.91±0.04 | 2.86±0.03 | 3.01± 0.05 | 2.79± 0.05 | 2.92± 0.05 | 2.94± 0.03 | 2.90± 0.03 | 2.88± 0.03 |
| Negative control | 3 | 2.48± 0.08 | 2.54± 0.06 | 2.61± 0.04 | 2.87± 0.05 | 2.81± 0.02 | 3.03± 0.07 | 3.15± 0.03 | 3.29± 0.03 | 3.30± 0.02 | 3.38± 0.02 | 3.46± 0.04 | 3.47± 0.03 | 3.44± 0.02 |
| Experimental | 6 | 2.49± 0.07* | 2.60± 0.07* | 2.69± 0.05* | 2.78± 0.04* | 2.87± 0.05* | 3.16± 0.03* | 3.26± 0.03* | 3.32± 0.02* | 3.37± 0.02* | 3.39± 0.02* | 3.40± 0.02* | 3.40± 0.03* | 3.38± 0.02* |
| *P < 0.05 compared with positive control group. | ||||||||||||||
TMJ是下颌骨生长的生发中心[8],是人体最活跃的关节之一,在咀嚼、呼吸和说话过程中发挥着至关重要的作用[9]。颞下颌关节紊乱病(TMD)病因主要有关节强直、外伤和肿瘤等,导致关节形态缺陷和功能丧失,严重影响患者的生活质量。TMJ的重建一直以来是困扰外科医生的一个难题。与其他工程材料比较,关节类植入材料有特殊的性能要求。首先需要良好的生物相容性才能应用于人体,即材料在人体内不引起不良生物反应,如炎症、排异和早期失效等。其次,植入材料需要有足够高的机械性能,且具有较好的抗疲劳强度;第三,用于不同位置的关节还要考虑材料与骨皮质具有相匹配的弹性模量,否则弹性模量的差异过大会导致应力遮挡及骨吸收甚至骨萎缩。PEEK是一种聚合物材料,最近被引入到口腔领域,可用作牙科假体的骨架材料[10]。Zoidis[11]将预制的改性聚醚醚酮作为一种植入性框架材料为1例65岁的女性患者制造出完整的上颌弓植入物固定修复体并成功植入,随访2年,效果满意。CFR-PEEK被称为具有很大机械强度的超级工程塑料, 在全髋关节置换术中CFR-PEEK轴承可以预期成为一种终身承载界面[12]。Grupp等[13]利用膝盖磨损实验模拟CFR-PEEK膝关节的轴承性能结果表明:CFR-PEEK可作为膝关节置换术的替代轴承材料。本文作者认为CFR-PEEK是一种非常适合的关节植入材料,但在TMJ的关节置换和重建中未见相关研究。
本研究首先确定了兔TMJ的功能突,为进一步实验奠定了理论基础。本研究中建立了TMJ运动模型,明确了关节突与关节窝的位置关系和解剖结构。兔TMJ无明确的关节-窝结构,但其眼眶后下以及颧骨根部后内交接处凹陷,此处可看作其关节窝。兔TMJ与人体TMJ存在一定差异,比如位置毗邻:兔的TMJ离外耳道和大脑较远,但离眼睛很近,在手术时首先要保护好其眼睛和周围结构。兔TMJ运动形式与人体虽然存在差异,其运动关节突(髁突)在前,无喙突或者喙突在后,但是在解剖形态上与人体相似均是盘-颞关节,其运动和周围肌肉关系密切;兔TMJ在生理功能上,通过关节功能突的转动和滑动,参与咀嚼、吞咽和其他功能。这也是实验进行的基础。当建立了兔的TMJ运动模型后,便能明确兔的运动关节突,利于手术切口的选择。本研究结果显示:兔的TMJ运动轨迹与人体非常类似:① 闭口位TMJ功能突的部位位于关节窝后上;② 开口位TMJ功能突的部位会沿着关节盘的结构向前向下移动;③ 人造关节植入后的TMJ运动模型仍然保持稳定一致;④ 兔TMJ运动依靠关节盘和关节囊的存在。手术入路切口的选择在很大程度上影响着实验的结果。在实验中根据兔TMJ缺损模型建立的不同目的,创新性地设计了3种手术切口。兔运动关节突位置与人体有所不同,其位置靠前约位于眼眶外侧下缘0.5~1.0 cm(设为手术原点,其体表对应外侧眦下0.5~1.0 cm)处,并位于眼眶下颧骨后内侧。因此手术切口均对应其体表的投射,再根据实验目的的不同或者切除关节大小的不同,选择横行切口、纵行切口和T型切口。横行切口创伤最小,利于关节损伤模型实验的开展;纵行切口和T型切口易损伤耳前横行的血管及神经,但是为关节缺损模型首选切口,唯一的区别在于纵行切口适合于长方形或者锥形的缺损模型,而T型切口适用于需要切除关节突后颌骨防止实验干扰的改良型缺损模型。另外手术切口暴露后,并不能直接观察到兔TMJ,还需要去除部分位于眼眶后下连接处的颧骨,长度为1.0~1.5 cm,宽度约是颧骨宽度的1/2~2/3。特别是关节突离眼球很接近,因此在手术时应加强对其眼睛的保护。
关节突向前后和内外均突出,但颈部短而不明显,向后和向下连接于下颌骨,而且下颌骨菲薄,因此在利用CFR-PEEK人造关节修复兔TMJ缺损时,人造关节的固定是实验的关键。PEEK能够承受体质量而且没有因承受压力而出现其他不良反应,并使得其机械性能包括弹性、硬度、抗拉强度以及抗腐蚀、磨损和疲劳的能力等在一定的压力范围内与人类的骨头并存。Nieminen等[14]通过PEEK在体内和体外实验中测试了其机械性能和组织反应,并进行了为期3年的实验及随访,结果显示:植入板无论在动物体内还是在人体内都没有降解和退化,周围无碎屑残留,植入体周围组织无炎症,可认为PEEK板适合用于骨折或者截骨术后的固定。而CFR-PEEK作为一种升级改良的增强型植入材料,具有良好的性能。因此在实验中将充分利用CFR-PEEK的材料性能来参与固定,CFR-PEEK人造关节除了其作用的关节部分外还向下充分延长,起到固位板的作用。而兔的下颌骨菲薄,仅用CFR-PEEK固位板和固位钉的固定会存在一定的隐患,因此实验中利用T型钛板坚强固定。然而金属类材料作为人体植入材料存在诸多问题,并且很难克服。例如金属类材料会释放有害金属离子并且在体内辐射不能透过[14],金属材料和人类骨头的机械性能尤其是弹性模量的错匹配将造成骨吸收[15-16]。金属种植体植入后有许多严重的并发症,诸如骨质溶解、过敏性反应和植入体松动甚至最终的失败[17]。钛等金属植入体被证实存在各种问题,由于钛合金材料的高弹性模量,作为牙科植入材料会形成应力遮挡,并且进一步造成牙周骨吸收[18]。这是本实验存在的一个很难克服的不足,钛板和钛钉的植入将会在一定程度上对实验形成干扰。Steinberg等[4]针对CFR-PEEK制作的胫骨钉、动态压缩板、肱骨近端板和远端半径桡骨板4种装置通过4点弯曲、静态扭转和弯曲疲劳测试比较其生物机械性能结果表明:CFR-PEEK用于骨科植入物主要因为其具有与皮质骨相似的模量,并且具备承受长时间的疲劳和应变能力,可以成为一种优良的骨折固定板和钉的材料。针对近年来已推出CFR-PEEK板治疗近端肱骨骨折, Hak等[19]研究比较了CFR-PEEK与不锈钢近端肱骨板的锁定螺钉-板界面的稳定性实验结果显示:CFR-PEEK锁定螺钉-板的性能更优。本课题组前期研究结果[20]显示:利用CFR-PEEK材料植入兔体内下颌骨单层骨皮质缺损模型中,证明了CFR-PEEK复合材料有较好的力学性能,植入白兔下颌骨后免疫反应小,具有良好的生物相容性及生物活性。CFR-PEEK固定板和螺纹钉的研究具有应用意义,在TMJ置换中加强固位效果的同时减少干扰。在关节突后部升支颌骨应尽量保留以利于进一步加强固位,限制其向前后的移动,并且根据这部分升支骨切除的多少,分出长方形或者锥形的缺损模型和改良型缺损模型。前者充分考虑了兔TMJ尤其是功能突的结构和功能,其优点是充分保留升支骨质,尽量减少对颌骨的损伤,并且利于固位,加强植入关节的稳固,限制向后的移动,是修复TMJ缺损的首选模型;但常规截取关节的方法会造成实验干扰,兔颞骨颧突的末端弯向下方与颧骨之颧弓相连接, 其末端突向后, 变的宽而薄, 形成关节窝的外侧壁[21]。为避免植入假体对薄弱的外侧壁造成影响,可以根据需求改良关节缺损模型。同时改良型缺损模型也充分考虑后部升支骨壁对实验造成支点性干扰,所以切除后部骨壁是必要的,因此可作为颌骨缺损模型实验的首选模型。
CFR-PEEK复合材料具有天然的放射透射性甚至还具有核磁共振的兼容性[1]。利用常规的影像学手段很难直接观察到植入关节,在X线片、CT或MRI都存在不显影的情况。最佳的材料不会干涉影像学设备的诊断[22-23]。一般情况下为加强显影,往往会在植入材料中加入显影剂或者荧光剂等物质,材料的性能也会在不同程度上受到掺入物质的影响。实验中在植入关节的上部放置了显影环,这样就能够在X光片中评估植入关节的位置,且不影响植入材料的性能。为了更加直观地显示植入关节的情况,实验后期可在体外通过显影剂的对比使材料直接显影。CFR-PEEK人工关节可以通过显影环来评估其固位并且不会干涉影像检查的诊断,方法简单易行。体外通过显影剂的显影,则能直接观察材料与下颌骨质的结合以及其功能突的部位,通过与对侧关节突的对比来评估CFR-PEEK人造关节是否能够修复缺损并且能够发挥作用。
本研究观察所有实验兔13周体质量变化线性图结果显示:与正常兔(阴性对照组)比较,切除右侧TMJ关节突的兔(阳性对照组)其体质量增长受到明显影响;而植入CFR-PEEK人工关节的兔(实验组),其体质量增长曲线和正常兔基本保持一致。一侧TMJ关节突的缺失,短期内对兔体质量影响较小,但长期将严重影响其生长发育,说明双侧TMJ关节的结构完整对咀嚼功能的发挥至关重要,一侧TMJ关节突的缺失虽然不会使咀嚼功能的完全散失,但仍会在很大程度上造成进食障碍。植入CFR-PEEK人工关节修复关节突缺损能够恢复双侧TMJ关节结构的完整性,并且取代正常关节发挥作用。
综上所述,本实验成功建立了兔TMJ关节突的缺损模型和修复模型,植入CFR-PEEK人造关节修复关节突缺损能够有效恢复正常咀嚼功能。CFR-PEEK人造关节成功应用于TMJ缺损修复,有望成为一种重建TMJ关节突的理想材料。本研究结果为CFR-PEEK人造关节的下一步实验和进一步的临床应用提供了充分的实验依据。
| [1] | Kurtz SM, Devine JN. PEEK biomaterials in trauma, orthopedic, and spinal implants[J]. Biomaterials, 2007, 28(32): 4845–4869. DOI:10.1016/j.biomaterials.2007.07.013 |
| [2] | Ponnappan RK, Serhan H, Zarda B, et al. Biomechanical evaluation and comparison of polyetheretherketone rod system to traditional titanium rod fixation[J]. Spine J, 2009, 9(3): 263–267. DOI:10.1016/j.spinee.2008.08.002 |
| [3] | Nieminen T, Kallela I, Wuolijoki E, et al. Amorphous and crystalline polyetheretherketone:Mechanical properties and tissue reactions during a 3-year follow-up[J]. J Biomed Mater Res A, 2008, 84(2): 377–383. |
| [4] | Steinberg EL, Rath E, Shlaifer A, et al. Carbon fiber reinforced PEEK Optima-a composite material biomechanical properties and wear/debris characteristics of CF-PEEK composites for orthopedic trauma implants[J]. J Mech Behav Biomed Mater, 2013, 17: 221–228. DOI:10.1016/j.jmbbm.2012.09.013 |
| [5] | Deng Y, Liu X, Xu A, et al. Effect of surface roughness on osteogenesis in vitro and osseointegration in vivo of carbon fber-reinforced polyetheretherketone-nanohydroxyapatite composite[J]. Int J Nanomed, 2015, 10: 1425. |
| [6] | Banks R, Keith D. Optomising the design of two piece peek implants in orbito-zygomatic reconstruction-the jigsaw technique[J]. J Oral Maxil Surg, 2014, 72(9): e202. |
| [7] | Abdullakutty A, Madhavarajan S, Collyer J, et al. Uses of PEEK in maxillofacial reconstruction:a 6 year review of cases[J]. Brit J Oral Max Surg, 2012, 50: S39–S40. |
| [8] | Shen G, Darendeliler MA. The adaptive remodeling of condylar cartilage-a transition from chondrogenesis to osteogenesis[J]. J Dent Res, 2005, 84(8): 691–699. DOI:10.1177/154405910508400802 |
| [9] | Scrivani SJ, Keith DA, Kaban LB. Temporomandibular disorders[J]. New Engl J Med, 2008, 359(25): 2693–2705. DOI:10.1056/NEJMra0802472 |
| [10] | Hahnel S, Scherl C, Rosentritt M. Interim rehabilitation of occlusal vertical dimension using a double-crown-retained removable dental prosthesis with polyetheretherketone framework[J]. J Prosthet Dent, 2017. |
| [11] | Zoidis P. The all-on-4 modified polyetheretherketone treatment approach:A clinical report[J]. J Prosthet Dent, 2017. |
| [12] | Yamane S, Kyomoto M, Moro T, et al. Wear resistance of poly (2-methacryloyloxyethyl phosphorylcholine)-grafted carbon fiber reinforced poly (ether ether ketone) liners against metal and ceramic femoral heads[J]. J Biomed Mater Res B, 2017. DOI:10.1002/jbm.b.33918 |
| [13] | Grupp TM, Utzschneider S, Schwiesau J, et al. Biotribology of alternativ bearing materials for knee arthroplasty[C]//World Congress on Medical Physics and Biomedical Engineering, September 7-12, 2009, doi:dx.doi.org/org/10.1007/978-3-642-03882-2_93. |
| [14] | Nieminen T, Kallela I, Wuolijoki E, et al. Amorphous and crystalline polyetheretherketone:Mechanical properties and tissue reactions during a 3-year follow-up[J]. J Biomed Mater Res A, 2008, 84(2): 377–383. |
| [15] | Wang L, He S, Wu X, et al. Polyetheretherketone/nano-fluorohydroxyapatite composite with antimicrobial activity and osseointegration properties[J]. Biomaterials, 2014, 35(25): 6758–6775. DOI:10.1016/j.biomaterials.2014.04.085 |
| [16] | Huiskes R, Weinans H, van Rietbergen B. The relationship between stress shielding and bone resorption around total hip stems and the effects of flexible materials[J]. Clin Orthop Relat R, 1992(274): 124–134. |
| [17] | Niki Y, Matsumoto H, Otani T, et al. Metal ion concentrations in the joint fluid immediately after total knee arthroplasty[J]. Mod Rheumatol, 2001, 11(3): 192–196. DOI:10.3109/s101650170003 |
| [18] | Sarot JR, Contar CMM, da Cruz ACC, et al. Evaluation of the stress distribution in CFR-PEEK dental implants by the three-dimensional finite element method[J]. J Mater Sci Mater Med, 2010, 21(7): 2079–2085. DOI:10.1007/s10856-010-4084-7 |
| [19] | Hak DJ, Fader R, Baldini T, et al. Locking screw-plate interface stability in carbon-fibre reinforced polyetheretherketone proximal humerus plates[J]. Int Orthop, 2017, 41(9): 1735–1739. DOI:10.1007/s00264-017-3562-7 |
| [20] | 刘瑞, 李明贺, 及昕, 等. 碳纤维增强型聚醚醚酮植入下颌骨单层骨皮质缺损模型白兔体内后的生物相容性评价[J]. 吉林大学学报:医学版, 2014, 40(3): 569–573. |
| [21] | 王栋, 田卫东, 李逸松, 等. 兔颞下颌关节腔穿刺定位及滑液抽取方法的研究[J]. 华西口腔医学杂志, 2003, 21(1): 64–66. |
| [22] | Kraft M, Koch DK, Bushelow M. An investigation into PEEK-on-PEEK as a bearing surface candidate for cervical total disc replacement[J]. Spine J, 2012, 12(7): 603–611. DOI:10.1016/j.spinee.2012.07.009 |
| [23] | 李兴华. 人工关节置换术后深静脉血栓的形成及其影响因素[J]. 解放军医学杂志, 2016, 41(8): 701–702. DOI:10.11855/j.issn.0577-7402.2016.08.18 |
 2017, Vol. 43
2017, Vol. 43


