扩展功能
文章信息
- 黄宝亮, 丁传波, 王佳奇, 郑毅男, 刘文丛, 张晶, 徐晓华
- HUANG Baoliang, DING Chuanbo, WANG Jiaqi, ZHENG Yinan, LIU Wencong, ZHANG Jing, XU Xiaohua
- 红参中精氨酸双糖苷对小鼠的抗疲劳作用
- Anti-fatigue effect of arginylfructosylglucose from red ginseng in mice
- 吉林大学学报(医学版), 2017, 43(05): 897-902
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 897-902
- 10.13481/j.1671-587x.20170508
-
文章历史
- 收稿日期: 2017-01-10
2. 吉林大学中日联谊医院肾内科, 吉林 长春 130033
2. Department of Nephrology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
人参为五加科植物人参(Panax ginseng C.A.Mey.)的干燥根和根茎,其味甘、微苦,具有大补元气、补脾益肺和生津养血等功效[1],广泛分布于辽宁东部、吉林东半部和黑龙江东部。人参作为药食同源的植物,享有“百草之王”的美誉,其主要生物活性成分为人参皂苷及人参多糖[2]。精氨酸双糖苷(AFG)是从红参中发现的一种具有药理活性作用的氨基酸衍生物,其为鲜参在蒸制成红参的过程中,由于发生美拉德反应而产生出新的非皂苷类小分子物质[3],分子结构式如图 1所示。AFG在促进微循环、降压、皮肤美白和抗糖尿病方面均有显著的效果[4-7],但目前未见关于AFG抗疲劳作用的相关报道。本研究旨在探讨AFG对小鼠抗疲劳作用,为人参中非皂苷类小分子物质的研发与应用提供一定的依据。
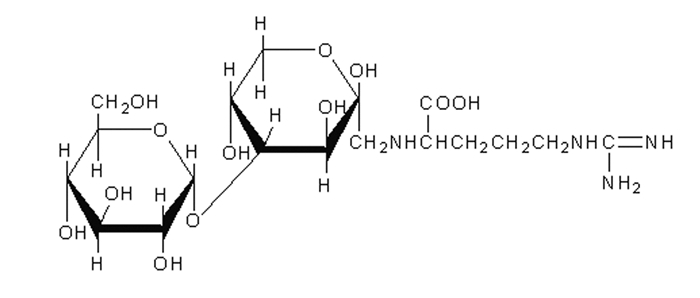
|
| 图 1 AFG化学结构式 Figure 1 Chemical structural formula of AFG |
|
|
80只ICR SPF级小鼠,体质量(20±2) g,购于吉林省长春市亿斯实验动物技术有限责任公司,动物许可证号:SCXK(吉)2016-0003。乳酸(LD)试剂盒、尿素氮(BUN)试剂盒和肝糖原(Gly)试剂盒(南京建成生物制品有限公司),电泳级琼脂糖(Biowest Agarose)、高纯总RNA快速提取试剂盒、BioTeke super RT Kit、2×SYBR real-time PCR premixture、BCA法蛋白定量试剂盒和RIPA裂解液(北京百泰克生物技术有限公司),兔抗小鼠PGC-1α抗体、碱性磷酸酶标记山羊抗兔IgG和β-actin抗体(Bio Vision公司)等,其他试剂为分析级。AL104型电子天平(梅特勒-托利多仪器上海有限公司),KQ-250DB型超声波提取仪(昆山超声仪器有限公司),FD-1D-50型真空冷冻干燥机(北京博医康实验仪器有限公司),ST 16R高速冷冻离心机(美国Thermo公司),DYY-Ⅲ8A电泳仪(北京六一仪器厂),Nanodrop2000核酸蛋白检测仪(美国Thermo公司),Mx3000p荧光定量PCR仪(美国Stratagene公司),1658001 Bio-rad垂直电泳仪(美国伯乐公司)。
1.2 AFG的提取将采购于吉林省抚松县的红参(五年生)进行粉碎,过50目筛网,精密称取10.000 g溶于100 mL 95%乙醇溶液中,超声提取40 min,过滤,弃去滤液,残渣加入1 L蒸馏水,超声提取40 min,用相对分子质量为1000的中空纤维素滤膜进行过滤,最后将滤液真空冷冻干燥,得富含AFG的粉末(RM),提取率为2%,HPLC-ELSD检测纯度为85%。
1.3 实验动物分组及试药配制实验动物随机分为4组:空白对照组,AFG低剂量组(100 mg·kg-1)、中剂量AFG组(200 mg·kg-1)和高剂量AFG组(400 mg·kg-1),每组20只,除空白对照组外其他3组灌胃给药28 d,观察小鼠体征变化。小鼠饲养温度(23±1)℃,12 h黑夜白天交替,给予充足的食物和水。
1.4 强迫性游泳实验[8]连续给药28 d后,每组随机取10只小鼠,在末次给药30 min后,在每只小鼠尾部系占自身体质量5%的铅皮,放于50 cm×40 cm×40 cm、水深30 cm、恒定水温(25±1)℃的游泳箱里进行游泳实验,把小鼠沉入水中10 s内不能上浮作为一个抗疲劳能力并记录时间。
1.5 小鼠脏器指数及生化指标测定连续给药28 d后,将每组剩余10只小鼠在末次给药30 min后,进行90 min无负重游泳。休息1 h后,眼球取血,在3 500 r·min-1、4℃,离心10 min得血清,低温冰箱保存,待用。将小鼠颈椎脱臼处死,取其腓肠肌、肝脏、脾脏、胸腺和肾脏,计算脏器指数(脏器指数=脏器/体质量×100%)。将低温保存的血清按LD、BUN和Gly试剂盒说明检测LD、BUN和Gly水平。
1.6 实时荧光定量PCR 1.6.1 总RNA提取和浓度测定取其大小一致的腓肠肌,采用Trizol法提取组织中总RNA,并采用琼脂糖凝胶电泳和紫外分光光度法检测提取总RNA的浓度和纯度[9]。
1.6.2 cDNA的制备体系中加入0.2~2.0 μg Total RNA,1 μL Oligo dT,1 μL dNTP Mixture,4 μL 5×first-strand Buffer,1 μL M-MuLVReverse Transcriptase,1 μL RNase Inhibitor和7 μL RNase free H2O。42℃、50 min,70℃、10 min,将得到的cDNA放于-20℃冻存备用。
1.6.3 引物设计及合成PGC-1α和β-actin基因序列参照GenBank,委托上海生工公司合成。引物序列见表 1。PGC-1α上游序列:5′-AGCGAAGAGCATTTGTCAAC-3′,下游序列:5′-TTCTGTGGGTTTGGTGTGA-3′;β-actin上游序列:5′-GCCCAGAGCAAGAGAGGTAT-3′,下游序列:5′-TTCTGTGGGTTTGGTGTGA-3′。mRNA表达水平以比较Ct法进行计算。
| (n=10, x±s, m/g) | ||||
| Group | Weight | |||
| (t/d) | 1 | 14 | 28 | |
| Blank control | 28.85±2.16 | 31.31±2.48 | 32.37±3.41 | |
| Low doseof AFG | 29.78±3.47 | 31.51±3.18 | 32.39±2.41 | |
| Middle dose of AFG | 28.97±1.36 | 31.69±2.03 | 33.85±3.14 | |
| High doseof AFG | 29.58±1.58 | 30.16±2.81 | 31.37±1.67 | |
体系中加入10 μL2×Premix,0.4 μL上游引物,0.4 μL上游引物,2 μL模板,0.4 μL ROX和6.8 μL DEPC水。94℃、10 s,94℃、5 s,60℃、30 s,40个循环。
1.7 Western blotting法测定小鼠腓肠肌PGC-1α蛋白表达制备蛋白样品,采用BCA法测定蛋白浓度,进行SDS-PAGE电泳,将凝胶上的蛋白转移至PVDF膜上并进行转膜,结束后用5%脱脂牛奶封闭2 h,一抗孵育,4℃过夜,二抗室温孵育1 h,最后加入显影液,待出现明显条带,扫描保存图片[10]。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学处理。各组小鼠体质量,脏器指数,强迫性游泳时间,血清中LD、BUN、Gly水平和PGC-1α mRNA表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠体质量在小鼠灌胃给药期间,分别于1、14和28 d记录小鼠体质量,给药组小鼠体质量与空白对照组比较差异无统计学意义(P>0.05)。见表 1。
2.2 各组小鼠脏器指数待小鼠无负重游泳实验结束后,脱臼处死,解剖小鼠,取肝、脾、胸腺、肾器官进行称质量,给药组小鼠的肝指数、脾指数、胸腺指数和肾指数与空白对照组比较差异无统计学意义(P>0.05)。见表 2。
| (n=10, x±s, η/%) | ||||
| Group | Liver index | Spleen index | Thymus index | Kidney index |
| Blank control | 6.19±0.21 | 0.38±0.04 | 0.19±0.04 | 1.62±0.26 |
| Low dose of AFG | 6.72±0.66 | 0.39±0.05 | 0.22±0.03 | 1.62±0.13 |
| Middle dose of AFG | 6.18±0.79 | 0.39±0.02 | 0.20±0.03 | 1.60±0.28 |
| High doseof AFG | 5.83±0.46 | 0.35±0.03 | 0.17±0.03 | 1.55±0.09 |
小鼠负重强迫性游泳实验结果显示:与空白对照组(9.98min±1.04 min)比较,低、中和高剂量AFG组小鼠力竭游泳时间(11.91 min±1.15 min、15.01 min ± 1.36 min和15.01 min ±1.36 min)分别高于空白对照组19.43%、50.40%和68.03%。
2.4 各组小鼠疲劳时生理生化指标给药组小鼠游泳后血清中LD水平明显低于空白对照组(P < 0.01),且随给药剂量的增加LD水平递减;给药组小鼠血清中BUN水平明显低于空白对照组(P < 0.01),Gly水平明显高于空白对照组(P < 0.01)。见表 3。
| (n=10, x±s) | |||
| Group | LD[cB/(mmol·L-1)] | BUN[cB/(mmol·L-1)] | Gly[wB/(mg·g-1)] |
| Blank control | 15.21±2.02 | 9.51±0.97 | 11.24±1.32 |
| Low dose of AFG | 12.93±1.43* | 7.61±0.85* | 12.27±1.36* |
| Middle dose of AFG | 10.75±1.14* | 6.55±0.58* | 14.35±1.52* |
| High dose of AFG | 9.02±1.06* | 4.80±0.56* | 16.01±1.46* |
| *P < 0.01 compared with blank control group. | |||
从腓肠肌组织中提取总RNA,采用琼脂糖凝胶电泳对提取质量进行检测,18 S和28 S电泳条带均可见,吸光度(A)(260)/A(280)=1.97,表明提取的RNA具有较好的纯度和完整性。见图 2。
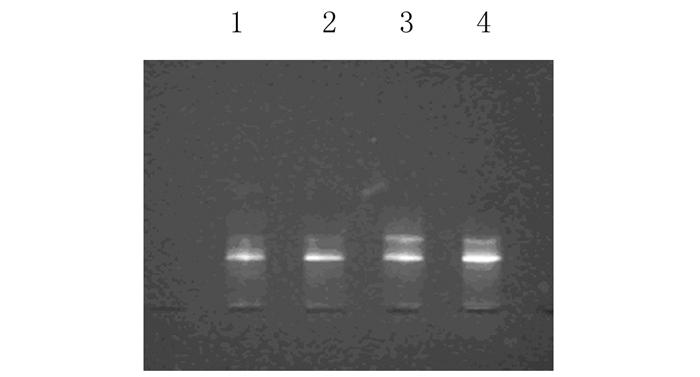
|
| Lane 1:Blank control group; Lane2:Low dose of AFG group; Lane 3:Middle dose of AFG group; Lane 4:High dose of AFG group. 图 2 小鼠腓肠肌提取总RNA电泳图 Figure 2 Electrophoregram of total RNA extracted from mouse gastrocnemius |
|
|
将逆转录合成的cDNA进行荧光定量分析,扩增曲线拐点清楚,整体平行性好,基线平且无上扬情况,CT值为15~35,表明扩增曲线良好。熔解曲线单一峰,表明产物单一,无二聚体。见图 3。
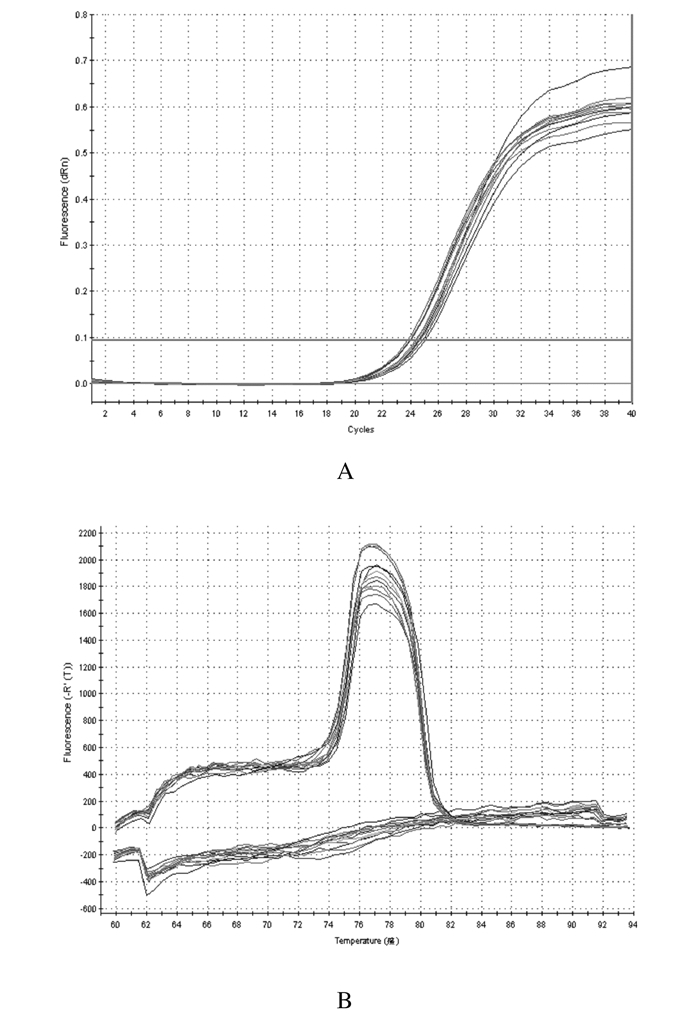
|
| 图 3 β-actin的实时PCR扩增曲线(A)和熔解曲线(B) Figure 3 Real-time PCR amplification curves(A)and melting curves(B)of β-actin |
|
|
将逆转录合成的cDNA进行荧光定量分析,扩增曲线拐点清楚,CT值为15~35,表明扩增曲线良好。熔解曲线单一峰,表明产物单一,无二聚体。见图 4。
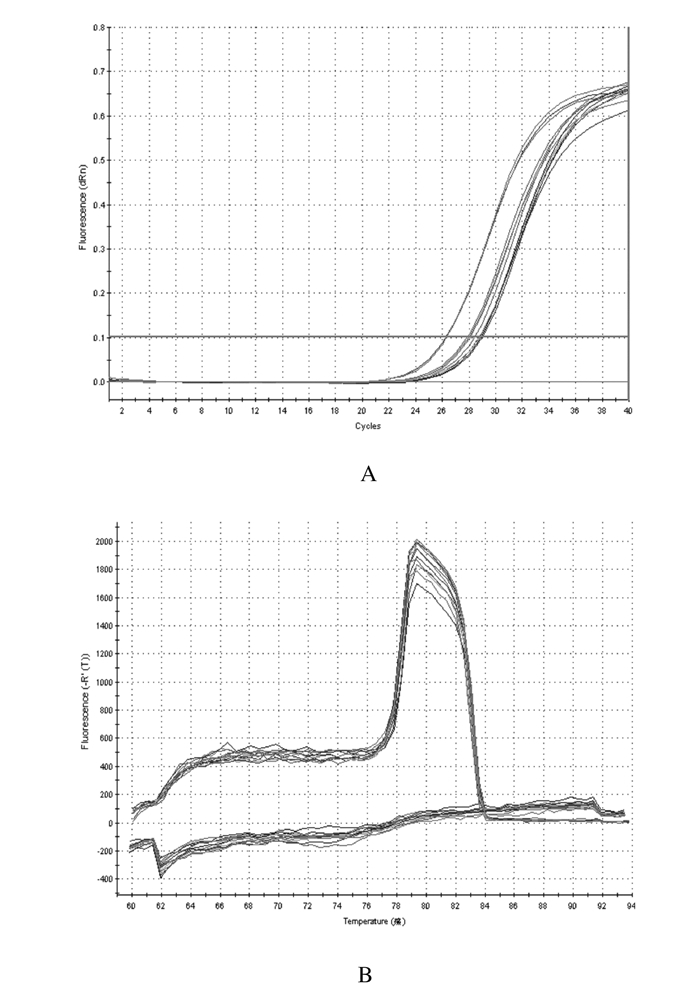
|
| 图 4 PGC-1α的实时PCR扩增曲线(A)和熔解曲线(B) Figure 4 Real-time of PGC-1α PCR amplification curves(A) and melting curves(B) |
|
|
对小鼠进行强迫游泳后,低、中和高剂量AFG组小鼠腓肠肌PGC-1α mRNA表达水平[(3.07±0.34)×10-5、(8.22±0.95)×10-5和(14.9±1.64)×10-5]明显高于空白对照组[(1.40±0.22)×10-5](P < 0.05)。
2.8 各组小鼠腓肠肌PGC-1α蛋白表达水平通过BCA法蛋白定量试剂盒,在波长562nm下,建立标准曲线,在浓度为0~0.045 g·L-1范围内呈良好的线性关系,回归方程为Y=11.976X+0.10466,R2=0.9990,根据标准曲线得出样品蛋白浓度为0.268~0.282 g·L-1。
低、中和高剂量AFG均可提高小鼠腓肠肌PGC-1αmRNA表达水平。对此通过免疫蛋白印迹进行蛋白水平验证,低、中和高剂量AFG组小鼠腓肠肌PGC-1α蛋白表达水平明高于空白对照组,与实时荧光定量PCR结果相吻合。见图 5。
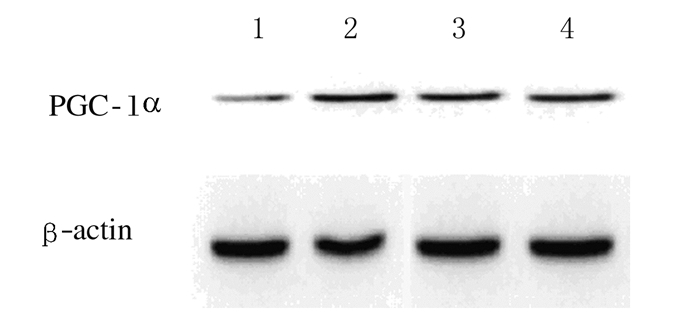
|
| Lane 1:Blank control group; Lane2:Low dose of AFG group; Lane 3:Middle dose of AFG group; Lane 4:High dose of AFG group. 图 5 Western blotting法检测PGC-1α蛋白表达电泳图 Figure 5 Electrophoregram of PGC-1α protein expression detected by Western blotting method |
|
|
疲劳是人体一种常见的生理反应,其会导致机体发生很多生理上的变化,在消耗体内一些物质的同时也会代谢出一些物质,因此选择检测Gly、LD和BUN代表疲劳时的基本指标,具有一定的意义。当机体能量不足时,体内贮存的Gly转化并提供能量[11-12],蛋白质代谢产生能量。本研究结果显示:给药组小鼠的负重游泳时间长于空白对照组,说明AFG可能是增加了小鼠体内肝糖原的贮备量,从而减少蛋白质分解来提供能量。如果运动过于剧烈或持久,则会有大量乳酸产生,堆积的LD若不能被及时地清除,会引起局部肌肉酸痛和影响细胞正常的新陈代谢[13],AFG有促进微循环的作用[5],使部分LD能够被及时清除,从而减轻肌肉酸痛,起到一定的抗疲劳作用。
提高呼吸肌能力和产生ATP的能力是提高人体肌肉耐疲劳的关键,而肌肉的呼吸能力和产生ATP的能力又依赖于细胞内线粒体浓度的增加。研究[14]表明:细胞内线粒体的生成和功能主要受PGC-1α基因的控制。对啮齿类动物的研究[15]显示:无论是短期运动还是耐力训练都可以促进肌肉中PGC-1α的表达。对人体的一系列研究[16]也表明:急性运动或耐力训练均可提高PGC-1α的表达。本研究结果显示:给药组小鼠PGC-1αmRNA表达水平明显高于空白对照组,可能是通过影响PGC-1αmRNA表达来提高肌细胞的氧化代谢能力。为了进一步验证,本研究采用免疫蛋白印迹法检测小鼠腓肠肌PGC-1α蛋白结果显示:给药组小鼠PGC-1α蛋白的表达水平高于空白对照组,表明AFG抗疲劳作用可能与能量代谢有关。
研究[17]表明:从植物中提取的多糖成分(如果实类枸杞多糖、根块类黄精多糖、茎和叶类竹叶多糖和真菌类香菇多糖)具有抗疲劳的效果,然而红参中非皂苷类化合物AFG在这方面的报道却不多见。本实验重在探讨AFG在影响能量代谢方面的机制,结果表明:AFG具有抗疲劳的功效,有开发功能性食品的潜力。但其具体作用机制还有待于进一步研究。
| [1] | 中华人民共和国药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社,2015: 8. |
| [2] | 黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164–167. |
| [3] | 郑毅男, 孟祥颖, 张晶, 等. 红参中新化合物精氨酸苷的生成机理及生成条件的研究[J]. 中国药物化学杂志, 1997, 7(3): 217–220. |
| [4] | 郑毅男, 张晶, 昆合典, 等. 精氨酸衍生物对微循环的作用[J]. 吉林农业大学学报, 1998, 20(4): 45–47. |
| [5] | Kim GN, Lee JS, Song JH, et al. In vitro and cellular antioxidant activity of arginyl-fructose and arginyl-fructosyl-glucose[J]. Food Sci Biotechnol, 2009, 18(6): 1505–1510. |
| [6] | Gao FF, Zhang WY, Liu LM, et al. Detection and distribution of arginine derivatives in Panax quinquefolius L. and investigations of their antioxidant properties[J]. LWT-Food Sci Technol, 2012, 49(1): 34–41. DOI:10.1016/j.lwt.2012.04.022 |
| [7] | Ha KS, Jo SH, Kang BH, et al. In vitro and in vivo antihyperglycemic effect of 2 amadori rearrangement compounds, arginy-fructose and arginyl-fructosyl-glucose[J]. Food Science, 2011, 76(8): H188–193. DOI:10.1111/jfds.2011.76.issue-8 |
| [8] | 徐先祥, 雷心雨, 黄怡婷, 等. 麦冬咖啡的抗疲劳作用[J]. 中成药, 2017, 39(1): 175–178. |
| [9] | 邢洪源, 赵婧, 刘纯岩, 等. LPL基因在大鼠精神分裂症动物模型脑组织中mRNA表达改变[J]. 吉林大学学报:医学版, 2016, 42(1): 11–14. |
| [10] | 方芳, 方青, 赵良中, 等. CD147对前列腺癌PC-3细胞自噬的影响[J]. 吉林大学学报:医学版, 2016, 42(1): 15–18. |
| [11] | 周海涛, 曹建民, 林强, 等. 淫羊藿对运动训练大鼠睾酮含量、物质代谢及抗运动疲劳能力的影响[J]. 中国药学杂志, 2013, 48(1): 25–29. |
| [12] | 苏艳丽, 韦隆华, 何钰英, 等. 黔产野生水芹提取物对小鼠的抗疲劳作用[J]. 贵州医科大学学报, 2017, 42(3): 1–4. |
| [13] | 史得君, 黄柏申, 崔清美, 等. 黑参对昆明种小鼠的抗疲劳作用研究[J]. 延边大学农学学报, 2016, 38(3): 204–208. |
| [14] | Zechner C, Lai L, Zechner JF, et al. Total Skeletal Muscle PGC-1 Deficiency Uncouples Mitochondrial Derangements from Fiber Type Determination and Insulin Sensitivity[J]. Cell Metab, 2010, 12(6): 633–642. DOI:10.1016/j.cmet.2010.11.008 |
| [15] | Jackson JF, David JB, Nigel K. Interference between concurrent resistance and endurance exercise:molecular bases and the role of individual training variables[J]. Sports Med, 2014, 44(6): 743–762. DOI:10.1007/s40279-014-0162-1 |
| [16] | Charles D, Dustin RS, John SC, et al. Skeletal muscle metabolic gene response to carbohydrate feeding during exercise in the heat[J]. J Int Soc Sports Nutr, 2013, 10(5): 40–44. |
| [17] | 郑飞. 蓝莓多糖对衰老小鼠运动耐力及抗疲劳效果研究[J]. 食品科学, 2014, 35(21): 249–252. DOI:10.7506/spkx1002-6630-201421049 |
 2017, Vol. 43
2017, Vol. 43


