扩展功能
文章信息
- 刘楠楠, 李玉林, 李荣贵, 孙立伟, 刘学娟
- LIU Nannan, LI Yulin, LI Ronggui, SUN Liwei, LIU Xuejuan
- 沉默Smad4基因对乳腺癌MCF-7细胞增殖和凋亡的影响
- Influence of silencing Smad4 gene in proliferation and apoptosis of breast carcinoma MCF-7 cells
- 吉林大学学报(医学版), 2017, 43(05): 887-892
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 887-892
- 10.13481/j.1671-587x.20170506
-
文章历史
- 收稿日期: 2017-01-25
2. 吉林大学基础医学院病理生物学教育部重点实验室, 吉林 长春 130021;
3. 北华大学化学与生物学院生命科学研究中心, 吉林 吉林 132013;
4. 吉林大学第一医院病理科, 吉林 长春 130021
2. Key Laboratory of Pathobiology, Ministry of Education, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
3. Life Science Research Center, School of Chemistry and Biology, Beihua University, Jilin 132013, China;
4. Department of Pathology, First Hospital, Jilin University, Changchun 130021, China
乳腺癌是女性最常见的恶性肿瘤,同时也是女性因癌症致死的最主要原因[1]。研究[2-3]表明:TGF-β信号通路在乳腺上皮细胞的恶性转化中起重要作用,而Smad4作为肿瘤抑制基因,是TGF-β家族信号从受体到核的细胞内传导分子。TGF-β首先与细胞表面受体(TβRⅡ和TβRⅠ)结合,受到受体活化的刺激,胞质内Smad2、Smad3蛋白与TβRⅠ激酶瞬时结合,并被磷酸化和活化。磷酸化的Smad2、Smad3与Smad4形成异源复合物,转位到胞核,与特异DNA序列结合调节基因的转录[4]。作为TGF-β家族各类信号转导过程中共同需要的介质,当Smad4基因异常表达时,势必会影响TGF-β/Smads通路的信号传导,进而影响细胞生物学行为。胰腺癌和结肠癌中常有Smad4的突变和表达缺失[5-6],而在乳腺癌中这种比例较低。先前的研究[7-8]显示:Smad4表达水平有助于判断浸润性乳腺导管癌患者的预后。此外,有研究者使用Smad4-RNAi质粒转染NMuMG小鼠乳腺上皮细胞,可以明显减轻TGF-β诱导的小鼠乳腺上皮细胞生长抑制和凋亡,而在乳腺癌细胞MDA-MB-231中Smad4表达减少又可以明显降低裸鼠中骨转移的发生率并延长未发生转移鼠的生存期[9],因此Smad4的表达缺失对于乳腺癌恶性进展的意义并不清楚。研究[10]显示:乳腺导管癌组织中不仅存在Smad4表达降低和失表达的情况,且其表达水平与肿瘤的组织学级别呈负相关关系。本研究选择Smad4高表达的乳腺癌MCF-7细胞,稳定转染Smad4基因沉默质粒,旨在探讨Smad4表达降低对MCF-7细胞增殖和凋亡的影响及其可能的分子机制。
1 材料与方法 1.1 细胞株、质粒、主要试剂和仪器人乳腺癌MDA-MB-231和MCF-7细胞为吉林大学病理生物学实验室储存。Smad4-shRNA沉默质粒由上海吉凯基因化学技术有限公司构建,并经基因测序证实质粒表达载体Smad4-shRNA构建序列正确。所用各基因引物由上海生物工程有限公司合成。Lipofectamine 2000(美国Invitrogen公司),G418(美国Genview公司),PT-PCR试剂盒和DL2000 DNA Marker(日本TaKaRa公司),CCK8细胞活性检测试剂盒和Annexin-V-PE/7-AAD细胞凋亡检测试剂盒(上海碧云天生物技术有限公司)。550型酶标仪(美国Bio-Rad公司),EDAS120电泳凝胶分析系统(美国KODA公司),Real-time PCR仪(美国ABI公司),BDCalibur型流式细胞仪(美国Calibur公司)。
1.2 细胞培养将MDA-MB-231与MCF-7细胞用含10%胎牛血清的H-DMEM培养基培养,置于37℃、5%CO2培养箱中,在37℃、95%湿度条件下培养。
1.3 逆转录-聚合酶链反应(RT-PCR)检测MDA-MB-231与MCF-7细胞Smad4 mRNA的表达水平① 逆转录反应获得cDNA。取处于指数生长期细胞,加入TRIzol裂解细胞。依次加入氯仿、异丙醇、70%乙醇。获得的RNA经DEPC水溶解、稀释,蛋白核酸分析仪检测RNA浓度及纯度。根据TaKaRa RT-PCR实验步骤逆转录,获得cDNA。反应条件:30℃、10 min;50℃、30 min,95℃、5 min,5℃、5 min,1个循环。② 以cDNA为模板进行PCR扩增。反应条件:94℃、2 min,1个循环;94℃、30 s,56℃、30 s,72℃、30 s,共30个循环;72℃、10 s,1个循环。Smad4和β-actin引物由上海生物工程有限公司合成,引物序列见表 1。PCR产物经2.5%琼脂糖凝胶电泳,扫描分析结果。目标基因mRNA相对表达水平=目标基因条带灰度值/β-actin基因条带灰度值。
| Gene | Primer sequence | Size(bp) |
| β-actin | F: 5′-CATGTACGTTGCTATCCAGGC-3′ | 21 |
| R: 5′-CTCCTTAATGTCACGCACGAT-3′ | 21 | |
| Samd 4 | F:5′-ACGAACGAGTTGTATCACCTGG-3′ | 22 |
| R:5′-ATGGCTGTCCCTCAAAGTCAT-3′ | 21 | |
| CDKN1A | F:5′-CCTGTCACTGTCTTGTACCCT-3′ | 21 |
| R:5′-GCGTTTGGAGTGGTAGAAATCT-3′ | 22 | |
| CDK1 | F:5′-GGGTCAGCTCGCTACTCAAC-3′ | 20 |
| R:5′-AAGTTTTTGACGTGGGATGC-3′ | 20 | |
| CDK2 | F:5′-CCTTGTTTGTCCCTTCTA-3′ | 18 |
| R:5′-CAAATCCACCCACTATGA-3′ | 18 | |
| Suvivin | F:5′-GGACCACCGCATCTCTACAT-3′ | 21 |
| R:5′-TCTGGCTCGTTCTCAGTGG-3′ | 19 | |
| bcl-2 | F:5′-CGGTGGGGTCATGTGTGTG-3′ | 19 |
| R:5′-CGGTTCAGGTACTCAGTCATCC-3′ | 22 | |
| caspase 3 | F:5′-CTCGGTCTGGTACAGATGTCG-3′ | 21 |
| R:5′-CACGCATCAATTCCACAATTTCT-3′ | 23 | |
| caspase 9 | F:5′-GCGACCTGACTGCCAAGAAA-3′ | 20 |
| R:5′-TCACAATCTTCTCGACCGACA-3′ | 21 |
应用Lipofectamine 2000将Smad4-shRNA质粒和Scramble-shRNA质粒分别转染MCF-7细胞,置于37℃、5% CO2培养箱中培养。次日,荧光显微镜下观察,约50%的细胞发出绿色荧光,表明转染成功。以G418浓度为600 mg·L-1的H-DMEM培养基进行筛选。待细胞状态稳定后,挑取6孔板中发出绿色荧光且彼此不相连的细胞克隆转入96孔板中,逐渐扩大培养,获得Smad4低表达的稳定MCF-7细胞,以及对任何人源mRNA不干扰的MCF-7细胞。实验分组:以未转染MCF-7细胞为正常对照组,Smad4低表达的稳定MCF-7细胞为Smad4基因沉默组,对任何人源mRNA不干扰的阴性对照MCF-7细胞为阴性对照组。
1.5 实时荧光定量PCR(Real-time PCR)检测CDKN1A、CDK1、CDK2、Suvivin、bcl-2、caspase 3和caspase 9 mRNA表达水平采用SYBR Green Ⅰ法检测MCF-7组、Smad4-shRNA组和阴性对照组细胞CDKN1A、CDK1、CDK2、Suvivin、bcl-2、caspase 3和caspase 9 mRNA表达水平。① 收集各组细胞提取RNA,逆转录成cDNA,操作步骤见1.3;② Real-Time PCR反应总体系20 μL,取RT反应产物4 μL加入PCR反应液16 μL中。反应条件:50℃、2 min,1阶段;95℃、10 min,2阶段;95℃、15 s,60℃、1 min,3阶段;95℃、15 s,60℃、30 s,95℃、15 s,4阶段;共50个循环。CDKN1A、CDK1、CDK2、Suvivin、bcl-2、caspase 3和caspase 9基因引物序列见表 1。③ Real-time PCR结果分析:Real-time PCR结果得到的是不同的Ct值,将Ct值转化为基因的扩增倍数,应用公式2-ΔΔCt计算各基因mRNA相对表达水平。2-ΔΔCt =2-[(Ct目标基因-Ct内参基因)实验组-(Ct目标基因-Ct内参基因)正常对照组]。
1.6 CCK-8法检测细胞增殖能力取处于指数生长期的各组细胞,制成单细胞悬液,计数细胞后调整细胞密度,按每孔1000个细胞接种于96孔板中,每组设6个副孔,共接种6块孔板。次日,待细胞贴壁后,在样品中加入90 μL培养基和10 μLCCK-8溶液,同时设置只含有培养基和CCK-8溶液的空白对照孔,孵育2 h后用酶标仪于450 nm波长处测定各孔吸光度(A)值并记录。每隔24 h测量一块孔板,连测6 d。以各组细胞A值减去对应空白组A值,根据标准曲线,计算各组细胞数量。
1.7 流式细胞术检测细胞凋亡率将消化下来的各组细胞2 000 r·min-1离心5 min,弃培养基。PBS洗涤细胞,2 000 r·min-1离心5 min,弃上清。保留一个样品不加7-AAD。在50 μL Binding Buffer中加5 μL 7-AAD染液混匀,悬浮细胞。各组细胞加入450 μL Binding Buffer,轻轻震荡混匀。各组细胞加入1 μL Annexin V-PE,室温避光反应15 min,保留一个样品不加Annexin V-PE细胞。立即进行流式细胞术检测。结果以细胞凋亡率表示。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。MDA-MB-231细胞和MCF-7细胞Smad4 mRNA表达水平,各组细胞增殖能力、凋亡率、增殖相关基因CDKN1A、CDK1、CDK2 mRNA和凋亡相关基因Suvivin、bcl-2、caspase3、caspase9 mRNA表达水平均以x ±s表示,计量资料结果符合正态分布,则组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 2种乳腺癌细胞中Smad4 mRNA表达水平恶性度较低的乳腺癌MCF-7细胞Smad4 mRNA表达水平(1.00 ±0.17) 明显高于恶性度较高的乳腺癌MDA-MB-231细胞(0.49±0.19,P<0.01)。见图 1。
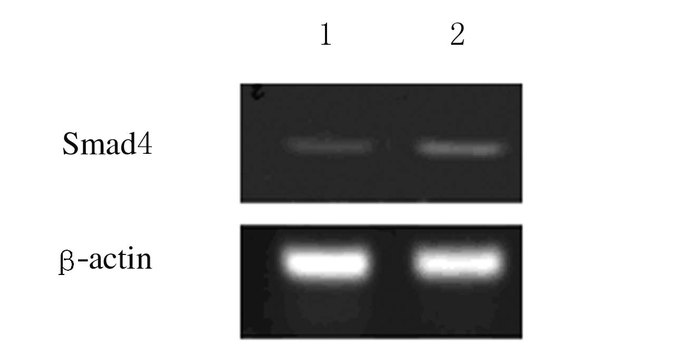
|
| Lane 1: MDA-MB-231cells; Lane 2: MCF-7cells. 图 1 乳腺癌细胞中Smad4 mRNA表达电泳图 Figure 1 Electrophoregram of expressions of Smad4 mRNA in breast carcinoma cells |
|
|
选择Smad4高表达的MCF-7细胞作为待转染细胞。经RT-PCR检测鉴定,Smad4基因沉默组Smad4 mRNA表达水平(0.63±0.27) 明显低于正常对照组(1.00± 0.12) 和阴性对照组(0.90±0.24,P<0.05),证实获得Smad4低表达的稳定MCF-7细胞株。见图 2。
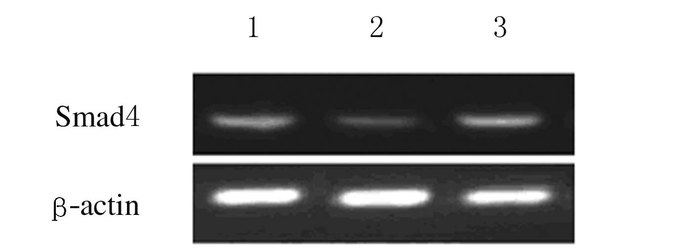
|
| Lane 1: Normal control group; Lane 2:Smad4 gene silencing group; Lane 3: Negative control group. 图 2 各组细胞中Smad4 mRNA表达电泳图 Figure 2 Electrophoregram of expressions of Smad4 mRNA in cells in various groups |
|
|
正常对照组和阴性对照组增殖细胞数量相当且较少,而Smad4基因沉默组增殖细胞数量较多,但各组增殖细胞数量比较差异无统计学意义(P>0.05)。根据标准曲线A值所对应的细胞数量,绘制增殖曲线。见图 3。
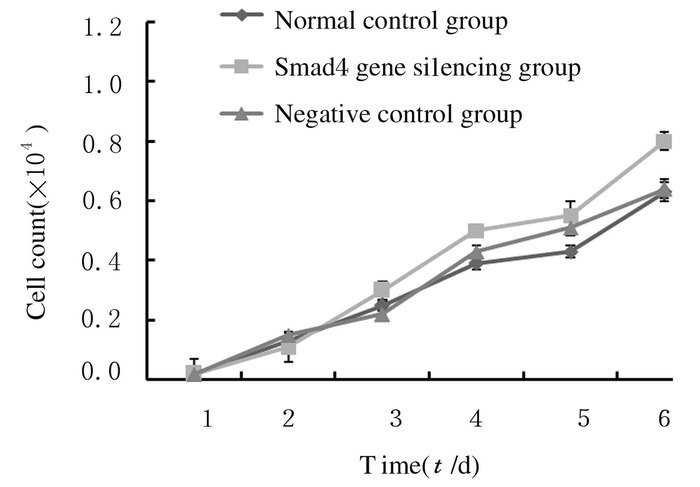
|
| 图 3 各组细胞增殖数量 Figure 3 Cell proliferation number in various groups |
|
|
与正常对照组和阴性对照组比较,Smad4基因沉默组细胞增殖相关基因CDKN1A、CDK1和CDK2 mRNA表达水平差异无统计学意义(P>0.05)。见表 2。
| (n=3, x ±s) | |||
| Group | CDKN1A mRNA | CDK1 mRNA | CDK2 mRNA |
| Normal control | 1.00±0.07 | 1.00±0.12 | 1.00±0.09 |
| Smad4 gene silencing | 1.13±0.23 | 1.07±0.35 | 0.94±0.27 |
| Negative control | 0.95±0.31 | 1.10±0.33 | 0.90±0.23 |
Smad4基因沉默组细胞凋亡率(2.06%±0.80%)明显低于正常对照组(8.46%±0.23%)和阴性对照组(8.24%±0.27%),差异有统计学意义(P<0.01)。见图 4。
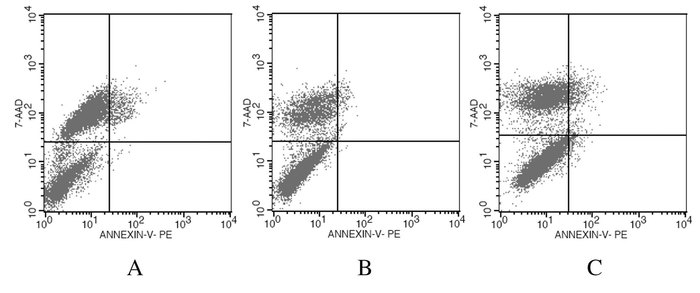
|
| A:Normal control group; B:Smad4 gene silencing group; C: Negative control group. 图 4 流式细胞术检测各组细胞凋亡率 Figure 4 Apoptotic rates of cells in various groups detected by flow cytometry |
|
|
与正常对照组和阴性对照组比较,Smad4基因沉默组抗凋亡基因bcl-2和Suvivin mRNA表达水平明显升高(P<0.01),而促凋亡基因caspase3和caspase9 mRNA表达水平明显降低(P<0.05)。见表 3。
| (n=3, x ±s) | ||||
| Group | Suvivin mRNA | bcl-2 mRNA | caspase 3 mRNA | caspase 9 mRNA |
| Normal control | 1.00±0.15 | 1.00±0.19 | 1.00±0.13 | 1.00±0.12 |
| Smad4 gene silencing | 1.84±0.32**△△ | 1.71±0.38**△△ | 0.73±0.11*△ | 0.51±0.23*△ |
| Negative control | 1.08±0.13 | 1.12±0.15 | 1. 13±0.08 | 1.10±0.17 |
| * P<0.05, * * P<0.01 compared with normal control group;△ P<0.05,△△ P<0.01compared with negative control group. | ||||
本研究结果显示:与未转染组和阴性对照组比较,Smad4基因沉默组MCF-7细胞增殖能力无明显改变。因此推测:降低MCF-7细胞中Smad4的表达可能对细胞周期的进程无影响。与CCK8检测结果一致,3个与细胞周期相关基因,即细胞周期素依赖性蛋白激酶抑制剂1(CDKN1A)、细胞周期蛋白依赖性激酶1、2(CDK1和CDK2),其mRNA表达水平在各组细胞中比较差异无统计学意义,说明在MCF-7细胞中Smad4表达水平对细胞的增殖能力无明显影响,CDKN1A、CDK1和CDK2表达可能不受Smad4调控,虽然尚不清楚具体的调控机制,但有研究[11]显示:胰腺导管癌恶化进展过程中CDKN1A的过表达要早于Smad4表达缺失,即CDKN1A的过表达不依赖于Smad4的表达,这或无法直接解释本研究中Smad4与CDKN1A的表达关系,但可为进一步研究MCF-7细胞中细胞增殖的调控信号环路提供参考。
肿瘤的生长不只由进入细胞周期的细胞数量来决定,而是取决于细胞增殖与细胞死亡的比例。因此进一步检测Smad4基因沉默对MCF-7细胞凋亡的影响。凋亡的发生主要由以下3条通路来实现[12]:一是线粒体参与的内源性凋亡途径,由CytC释放入胞浆来介导;二是由Fas、TNFαR等死亡受体发起的外源性凋亡途径来实现;三是经由凋亡诱导因子(AIF)来完成。前2条通路最终都通过caspase途径实现[13]。本研究中流式细胞术结果显示:与未转染组及阴性对照组细胞比较,Smad4基因沉默组凋亡细胞数明显减少且抗凋亡基因bcl-2和Suvivin表达均有不同程度的增加,而促凋亡基因caspase 3和caspase 9表达均有不同程度的降低。Xu等[14]检测245例浸润性乳腺癌组织中Survivin mRNA的表达水平发现:Survivin mRNA高表达可以作为判断乳腺癌预后不良的独立生物学标记,尽管无法证实Survivin mRNA表达的变化是由Smad4引起的,但至少说明随着乳腺癌恶化进展,Survivin呈现高表达趋势,这与本实验结果一致。有研究[15]将Smad4高表达质粒转染MCF-7细胞后,促凋亡蛋白Bim和Bax表达以及细胞色素C(Cyt c)的释放明显增加。此外,利用MAPK抑制剂诱导具有完整TGF-β/Smad4信号的肝癌HepG2细胞和Smad4失表达的结肠癌SW620细胞。而在HepG2细胞中MAPK抑制剂能通过活化TGF-β/Smad4通路抑制bcl-2的表达诱导细胞凋亡,最终活化线粒体凋亡途径蛋白caspase 3和caspase 9[16-17],上述结果表明通过Smad4信号能诱导肿瘤细胞凋亡,与本实验的结果相似。此外,鉴于survivin、bcl-2与caspase 3、caspase 9对细胞增殖正负调控作用的不同,当抑癌基因Smad4沉默时,这些促进或抑制凋亡基因的表达特征也是合理的。
综上所述,下调Smad4表达不会影响MCF-7细胞的增殖能力,但可以上调bcl-2和Suvivin的表达同时下调caspase 3和caspase 9的表达而防止MCF-7细胞凋亡,即Smad4具有抑制MCF-7细胞凋亡的作用,在乳腺癌MCF-7细胞中可能发挥抑癌基因的作用。但Smad4诱导MCF-7细胞凋亡的具体机制还需要进一步的体内和体外实验加以证明,为阐明Smad4在MCF-7细胞中的信号调节机制提供实验依据。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [2] | Ma Y, Liu H, Zhang H, et al. The TGF-β signaling pathway induced EMT in breast cancer[J]. Yao Xue Xue Bao, 2015, 50(4): 385–392. |
| [3] | Blobe GC, Schiemann WP, Lodish HF. Role of transforming growth factor beta in human disease[J]. N Engl J Med, 2000, 342(18): 1350–1358. DOI:10.1056/NEJM200005043421807 |
| [4] | Massagué J. TGFβ signalling in context[J]. Nat Rev Mol Cell Biol, 2012, 13(10): 616–630. DOI:10.1038/nrm3434 |
| [5] | Rozenblum E, Schutte M, Goggins M, et al. Tumor suppressive pathways in pancreatic carcinoma[J]. Cancer Res, 1997, 57(9): 1731–1734. |
| [6] | Zhang B, Halder SK, Kashikar ND, et al. Antimetastatic role of Smad4 signaling in colorectal cancer[J]. Gastroenterology, 2010, 138(3): 969–980. DOI:10.1053/j.gastro.2009.11.004 |
| [7] | Liu N, Yu C, Shi Y, et al. SMAD4 expression in breast ductal carcinoma correlates with prognosis[J]. Oncol Lett, 2015, 10(3): 1709–1715. |
| [8] | 刘楠楠, 李玉林, 孙立伟, 等. Smad2和Smad4蛋白在乳腺癌组织中的表达及其意义[J]. 吉林大学学报:医学版, 2016, 42(4): 763–767. |
| [9] | Deckers M, van Dinther M, Buijs J, et al. The tumor suppressor SMAD4 is required for transforming growth factor β-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells[J]. Cancer Res, 2006, 66(4): 2202–2209. DOI:10.1158/0008-5472.CAN-05-3560 |
| [10] | Liu NN, Xi Y, Callaghan MU, et al. SMAD4 is a potential prognostic marker in human breast carcinomas[J]. Tumour Biol, 2014, 35(1): 641–650. DOI:10.1007/s13277-013-1088-1 |
| [11] | Biankin AV, Kench JG, Morey AL, et al. Overexpression of p21(WAF1/CIP1) is an early event in the development of pancreatic intraepithelial neoplasia[J]. Cancer Res, 2001, 61(24): 8830–8837. |
| [12] | Kiraz Y, Adan A, Kartal Yandim M, et al. Major apoptotic mechanisms and genes involved in apoptosis[J]. Tumour Biol, 2016, 37(7): 8471–8486. DOI:10.1007/s13277-016-5035-9 |
| [13] | Yin Q, Park HH, Chung JY, et al. Caspase-9 holoenzyme is a specific and optimal procaspase-3 processing machine[J]. Mol Cell, 2006, 22(2): 259–268. DOI:10.1016/j.molcel.2006.03.030 |
| [14] | Xu C, Yamamoto-Ibusuki M, Yamamoto Y, et al. High survivin mRNA expression is a predictor of poor prognosis in breast cancer:a comparative study at the mRNA and protein level[J]. Breast Cancer, 2014, 21(4): 482–490. DOI:10.1007/s12282-012-0403-9 |
| [15] | Li Q, Wu L, Oelschlager DK, et al. Smad4 inhibits tumor growth by inducing apoptosis in estrogen receptor-alpha-positive breast cancer cells[J]. J Biol Chem, 2005, 280(29): 27022–27028. DOI:10.1074/jbc.M505071200 |
| [16] | Tong D, Qu H, Meng X, et al. S-allylmercaptocysteine promotes MAPK inhibitor-induced apoptosis by activating the TGF-β signaling pathway in cancer cells[J]. Oncol Rep, 2014, 32(3): 1124–1132. DOI:10.3892/or.2014.3295 |
| [17] | 任徽, 郭华, 陈明伟, 等. Hedgehog信号通路通过上皮细胞间质转分化调控乳腺癌细胞侵袭[J]. 西安交通大学学报:医学版, 2017, 38(1): 48–52. |
 2017, Vol. 43
2017, Vol. 43


