扩展功能
文章信息
- 王丽萍, 王建辉, 李树民, 杨秀红
- WANG Liping, WANG Jianhui, LI Shumin, YANG Xiuhong
- N-乙酰半胱氨酸通路对AGT-REN双转基因高血压小鼠心肌成纤维细胞中电导钙激活钾离子通道蛋白表达的影响及其意义
- Effect of N-acetyl cysteine pathway on expression of intermediate conductance Ca2+-activated K+ channels in cardiac fibroblasts of AGT-REN double transgenic hypertension mice
- 吉林大学学报(医学版), 2017, 43(05): 881-886
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 881-886
- 10.13481/j.1671-587x.20170505
-
文章历史
- 收稿日期: 2016-11-03
心肌纤维化(myocardial fibrosis, MF)是多种心脏疾病中重要的病理过程,发生的关键是心肌胶原合成与降解失衡。心肌成纤维细胞(cardiac fibroblasts, CFs)的增殖和/或细胞外基质成分(尤其是Ⅰ、Ⅲ型胶原纤维)沉积的异常增加,使心肌结构与功能发生改变是心肌纤维化的病理学基础,但CFs增殖及迁移的机制还有待深入研究。血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)可激活心肌成纤维细胞合成胶原、纤维连结素等细胞外基质(extracellular matrixc,ECM)成分,并可诱导心肌成纤维细胞分化为肌成纤维细胞。研究[1-3]表明:Ang Ⅱ刺激氧化应激反应进而诱导活性氧(reactive oxygen species,ROS)增多,而过多的ROS可引起细胞功能障碍、脂质过氧化及DNA损伤而导致不可逆的细胞损伤和死亡,并引发心血管疾病;ROS可刺激心肌成纤维细胞增殖,同时激活基质金属蛋白酶(matrix metalloproteinases,MMPs),导致细胞外基质重塑。研究[4]显示:辐射通过改变SOD活性,产生大量的ROS,导致线粒体功能改变进而影响CFs的增殖活动,进而造成心肌纤维化。中电导钙激活钾离子通道(intermediatec onductance Ca2+-activated K+ channels, KCa3.1) 介导的细胞内钙的升高是许多细胞增殖所必需的。研究[5-6]表明:Ang Ⅱ和糖基化终产物(AGEs)与其受体结合可诱导KCa3.1活性及表达上调,促进大鼠CFs增殖及胶原合成。特异性阻断KCa3.1通道则可抑制高血压大鼠心肌组织的炎症反应[7]。这些证据均表明KCa3.1通道可能是Ang Ⅱ诱导MF发生的一个新靶点。但KCa3.1通道参与Ang Ⅱ诱导MF过程中与氧化应激的关系尚未见报道。血管紧张素-肾素(AGT-REN)双转基因高血压小鼠(double transgenic hypertension mice, dTH)是在野生C57B6小鼠基础上采用分子生物学方法人为转入人肾素和人血管紧张素基因的高血压小鼠,是一种特征稳定的高血压动物模型。本研究以dTH高血压小鼠为模型,通过对高血压小鼠心肌成纤维细胞培养并进行药物干预,探讨MF过程中KCa3.1通道蛋白表达与氧化应激反应之间的关系,进一步明确KCa3.1通道蛋白在心肌纤维化中的作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器2~12月龄雄性dTH小鼠,体质量22~30 g,动物质量合格证号:SCXK(京)2015-0008,在华北理工大学清洁级动物房饲养。ROS清除剂N-乙酰半胱氨酸(N-acetyl cysteine, NAC)购自美国Sigma公司(货号:A7250),MTT及Western blotting相关试剂购自美国Amresco公司, 兔抗collagen Ⅰ、collagen Ⅲ多克隆抗体购自武汉博士德公司(货号:PB0981、BA0326),兔抗p-AKT、T-AKt及KCa3.1多克隆抗体购自美国Abcom公司(货号:ab8805、ab8449、ab215990)。电泳槽(dycz-24dn)购于北京六一生物科技有限公司,凝胶成像分体系统chemidoc xrs+购于新加坡Bio-RAD公司,酶标仪(imark)购于新加坡Bio-RAD公司;倒置显微镜(CKY31) 购于日本Olympus公司。
1.2 CFs原代培养及分组常规培养WT及dTH小鼠CFs[5]。取一代细胞用于实验。将细胞分为3组:对照组(Control),野生C57B6小鼠CFs;dTH组,dTH小鼠CFs;NAC组,dTH小鼠CFs加入1×10-6、1×10-5、1×10-4和1×10-3mol·L-1NAC孵育24 h。
1.3 MTT法检测CFs增殖将处于对数增长期CFs接种于96孔培养板,每孔2×104个细胞。常规培养24 h后,用含0.5% FBS的DMEM继续培养24 h后,对照组和dTH组细胞加入含1% FBS的DMEM,NAC组细胞在1% FBS的DMEM中加入NAC。24 h后,每孔加入20 μL MTT(5 g·L-1),孵育4 h后吸掉孔内培养液,每孔加入100 μL DMSO,震荡,490 nm波长处测其吸光度(A)值。
1.4 细胞内ROS检测将处于对数增长期CFs接种于96孔培养板,每孔2×104个细胞。常规培养24 h后,用含0.5% FBS的DMEM继续培养24 h后,对照组和dTH组细胞加入含1% FBS的DMEM,NAC组细胞在1% FBS的DMEM中加入NAC。24 h后吸弃培养液,加入终浓度为10 μmol·L-1 DCFH-DA荧光探针溶液,37℃细胞孵育30 min,无血清细胞培养液洗涤细胞以去除未进入细胞内的DCFH-DA。荧光显微镜观察细胞荧光强度。采用IPP6.0对结果进行分析,以产生荧光的细胞数来表示细胞ROS表达水平。
1.5 Western blotting法检测各组细胞培养上清中collagen Ⅰ、collagen Ⅲ及细胞中KCa3.1、p-AKt/T-AKt蛋白表达水平RIPA裂解液提取各组细胞蛋白,BCA法检测蛋白总浓度。取等量蛋白于10% SDS-PAGE凝胶电泳分离,于90 V转膜1 h将蛋白转至PVDF膜。5%脱脂奶粉封闭1 h后,滴加一抗anti-collagen I(1:500)、anti-collagen Ⅲ(1:500)、anti-p-AKt(1:500) 和anti-T-AKt(1:300)/anti-KCa3.1(1:300),4℃过夜。洗膜后滴加二抗,室温孵育1 h,化学发光试剂放射自显影,拍照,保存结果。对电泳条带进行灰度值扫描,对各目的蛋白进行半定量分析。以目的条带与内参照的A比值表示目的蛋白的相对表达水平。
1.6 统计学分析采用SPSS 16.0软件进行统计学分析。ROS表达以相对于对照组增加百分比表示,collagen Ⅰ、collagen Ⅲ和KCa3.1蛋白表达水平以x ±s表示,组间比较采用单因素方差分析。Sigmaplot 10.0软件制统计图。以P < 0.05为差异有统计学意义。
2 结果 2.1 不同月龄dTH小鼠CFs中ROS表达水平4、8和12月龄dTH小鼠CFs中ROS表达水平较2月龄dTH小鼠比较均升高,其中4、8和12月龄dTH小鼠CFs中KCa3.1通道蛋白表达水平明显高于同龄野生组小鼠(P < 0.01)。见图 1(插页三)。

|
| n=6,*P<0.01 vs 2 months: A:DCFH-DA detection; B: Histogram. 图 1 不同月龄AGT-REN高血压小鼠CFs中ROS表达 Figure 1 Expressions of ROS in CFs of AGT-REN mice with different ages |
|
|
4、8和12月龄dTH小鼠CFs中KCa3.1通道蛋白表达水平较2月龄dTH小鼠升高(P < 0.05或P < 0.01),其中8、12月龄dTH小鼠CFs中KCa3.1通道蛋白表达水平明显高于同龄野生组小鼠(P<0.01)。见图 2。

|
| A:Electrophoregram; B:Histogram.Lane 1-4:2, 4, 8 and12 months. n=6, *P<0.01 vs controlgroup; △P<0.01 vs 2 months. 图 2 不同月龄小鼠CFs中KCa3.1通道蛋白表达 Figure 2 Expressions of KCa3.1 channel protein in CFs of dTH mice with different ages |
|
|
MTT结果显示:1×10-6、1×10-5、1×10-4和1×10-3 mol·L-1 NAC干预后,CFs增殖率分别为165.9%、138.72%、110.92%和109.82%。与dTH组比较,1×10-4和1×10-3 mol·L-1 NAC作用最明显(P < 0.01),故本研究选用1×10-4 mol·L-1 NAC为作用浓度。
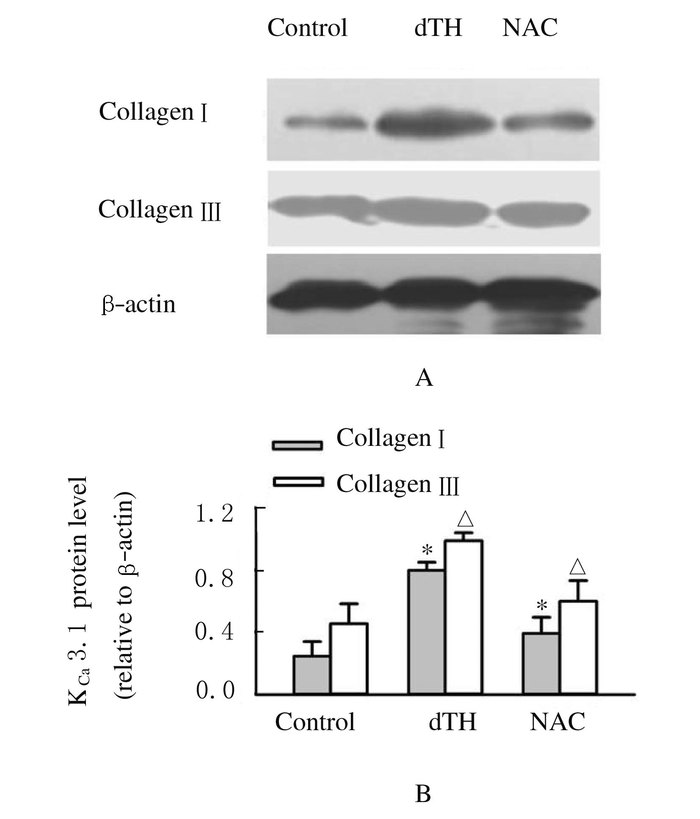
2.4 dTH高血压小鼠CFs中胶原合成与同型野生组小鼠比较,dTH小鼠CFs培养上清中collagenⅠ和collagen Ⅲ合成增加(P<0.01),而1×10-4 mol·L-1 NAC组小鼠CFs培养上清中collagenⅠ和collagen Ⅲ合成减少(P < 0.01)。见图 3。
|
| A: Electrophoregram; B:Histogram. n=6, *P<0.01 vs controlgroup; △P<0.01 vs dTH group. 图 3 CFs培养上清中胶原蛋白表达 Figure 3 Expressions of collagen proteins in supernatant of CFs |
|
|
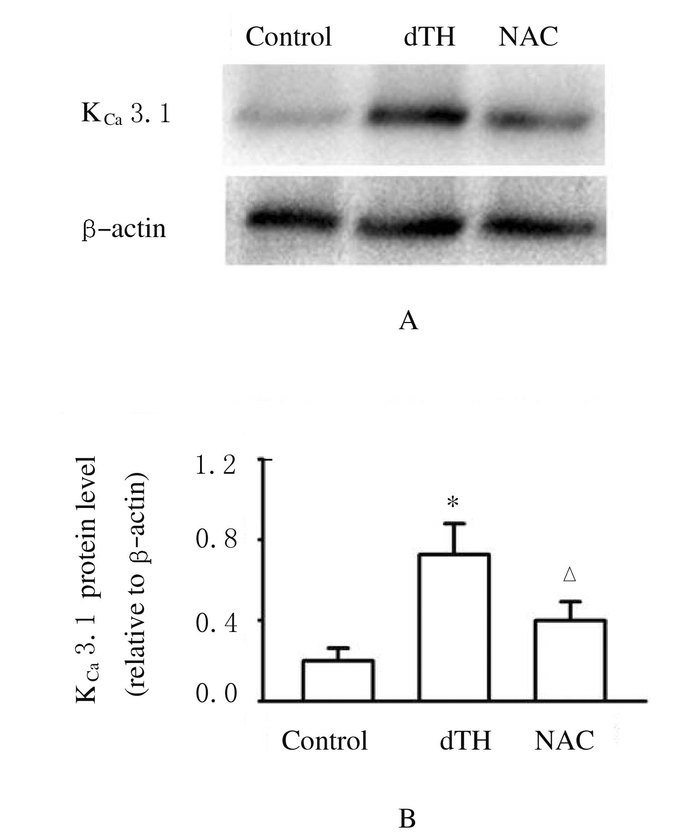
Western blotting法检测:与同龄对照组小鼠比较,6月龄dTH小鼠CFs中KCa3.1通道蛋白表达水平增加(P<0.01),应用1×10-4 mol·L-1 NAC干预后,细胞中KCa3.1通道蛋白表达水平下降(P<0.01)。见图 4。
|
| A: Electrophoregram; B:Histogram.n=6, *P<0.01 vs control group; △P<0.01 vs dTH group. 图 4 CFs中KCa3.1通道蛋白表达 Figure 4 Expressions of KCa3.1 channel protein in CFs |
|
|
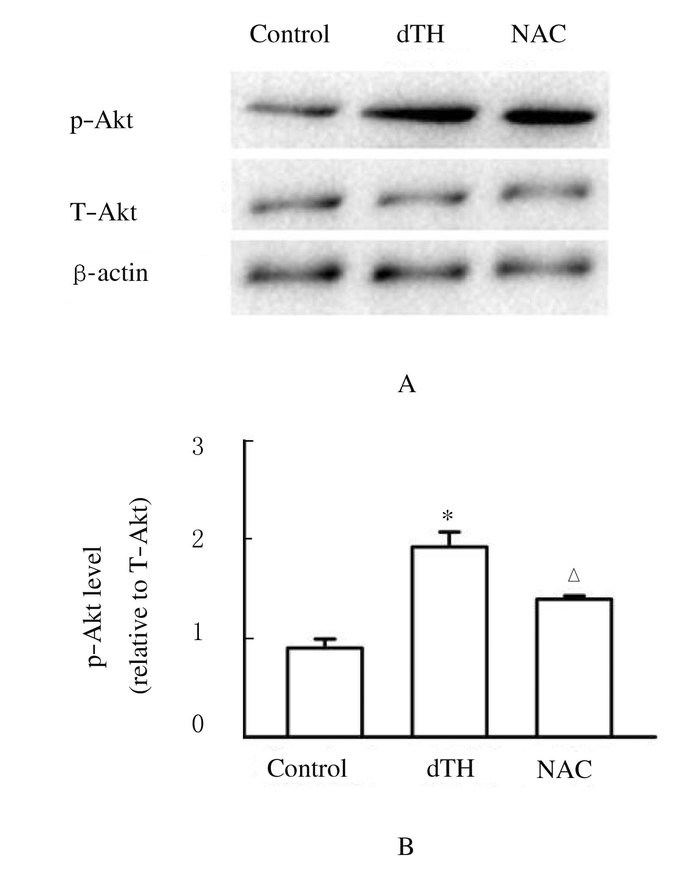
与同龄对照组比较,6月龄dTH小鼠CFs中p-Akt/T-Akt表达水平增加(P < 0.01),而与dTH组比较,1×10-4 mol·L-1NAC组小鼠CFs中p-Akt/T-Akt表达水平明显下降(P < 0.01)。见图 5。
|
| A:Electrophoregram; B:Histogram. n=6, *P<0.01 vs controlgroup; △P<0.01 vs dTH group. 图 5 CFs中p-Akt/ T-Akt蛋白表达 Figure 5 Expressions of p-Akt/ T-Akt in CFs |
|
|
长期压力超负荷(如高血压)会导致心肌结构和功能改变,出现心肌细胞肥大、细胞外基质含量增加、心肌纤维化等形态学变化,最终诱发心力衰竭。心肌纤维化是多种心血管疾病常见的病理过程,CFs在各种刺激因素作用下增殖、迁移并分化为肌成纤维细胞(myofibroblast, myoFb),继而产生细胞因子、生长因子、趋化因子、细胞外基质蛋白和蛋白酶,在纤维化过程中发挥关键作用。
Ang Ⅱ通过促进氧化应激反应诱导ROS在心肌内过量蓄积是纤维化发生的重要因素。ROS参与多种因素诱发的心肌肥厚性反应,并由此引发心血管疾病[8-9]。研究[10]显示:ROS生成的增加可诱发高盐饮食的高血压大鼠发生代偿性心肌肥大继而导致心衰的发生。丹参素即可通过负调控ROS/p38信号通路抑制异丙基肾上腺素诱导的新生大鼠心脏成纤维细胞的增殖。前期研究[11]证实:随着年龄增长,dTH小鼠血压上升的同时伴随着循环血液中Ang Ⅱ水平的逐渐增高,心肌组织中脂质过氧化物MDA表达上升,SOD活性则逐渐下降,表明dTH小鼠心肌组织氧化应激水平增强。本研究结果显示:dTH小鼠心肌成纤维细胞中ROS生成随年龄增长而增加,其中,8和12月龄dTH小鼠心肌成纤维细胞ROS表达明显增多。这一结果提示dTH小鼠心肌Ang Ⅱ水平的增高导致了心肌成纤维细胞内氧化应激水平的增强。
大量研究[12-15]已证实:KCa3.1通道蛋白在成纤维细胞增殖中起重要作用,特异性阻断KCa3.1通道蛋白可降低大鼠肾小球系膜细胞的增殖及向肌成纤维细胞的分化,减少肾成纤维细胞中胶原蛋白表达,从而减轻肾小球硬化,并可降低小鼠和大鼠由于单侧后输尿管梗阻诱发的肾纤维化。KCa3.1通道蛋白在梗死后的大鼠心肌血管细胞、单核细胞和心肌成纤维细胞上表达增强。本课题组前期实验结果[16]显示:dTH小鼠心肌中KCa3.1通道蛋白表达随年龄增长而增加,但其表达的相关细胞类型还不明确。本研究结果显示:dTH小鼠心肌成纤维细胞中KCa3.1通道蛋白表达随年龄增长而增加,与前期整体结果一致,表明在心肌纤维化过程中,KCa3.1通道蛋白表达增加可能主要发生在心肌成纤维细胞上。
为明确CFs中KCa3.1通道蛋白表达与氧化应激的关系,本研究采用ROS清除剂NAC对细胞进行了干预。NAC是细胞内还原性谷胱苷肽前体,可干扰自由基生成并清除已生成的自由基。本研究结果显示:与同型野生组比较,dTH小鼠CFs增殖明显,细胞collagen Ⅰ和collagen Ⅲ分泌增加;而应用NAC干预24 h后,细胞增殖明显降低,细胞培养上清中胶原含量也下降,表明ROS清除剂NAC能抑制CFs的增殖及胶原的合成。同时,NAC抑制了dTH小鼠CFs中KCa3.1通道蛋白表达的增加。上述结果进一步表明:氧化应激促进dTH高血压小鼠心肌成纤维细胞中KCa3.1通道蛋白表达。研究[5]表明:Ang Ⅱ通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等信号转导通路,诱导KCa3.1通道蛋白活性及表达上调,促进大鼠心肌成纤维细胞增殖及胶原合成。本研究结果显示:NAC抑制了dTH小鼠心肌成纤维细胞中PI3K信号通路磷酸化水平,提示ROS对心肌成纤维细胞中KCa3.1通道表达的作用与PI3K信号通路有关。
ROS对心肌离子通道的影响至今研究较少,结合前期研究及本实验结果本文作者认为:Ang Ⅱ诱发氧化应激反应促进ROS合成,增加了心肌KCa3.1通道蛋白的表达,这一过程主要发生在CFs上,并进而促进了心肌纤维化的发生与发展。而KCa3.1通道蛋白的作用通过其表达增加和活性增强来发挥作用。本研究仅证实了氧化应激对KCa3.1通道蛋白表达的影响,对其活性的影响则需要进一步研究来证实。
| [1] | Rosa CM, Gimenes R, Campos DH, et al. Apocynin influence on oxidative stress and cardiac remodeling of spontaneously hypertensive rats with diabetes mellitus[J]. Cardiovasc Diabetol, 2016, 15(1): 126. DOI:10.1186/s12933-016-0442-1 |
| [2] | Wu H, Li GN, Xie J, et al. Resveratrol ameliorates myocardial fibrosis by inhibiting ROS/ERK/TGF-β/periostin pathway in STZ-induced diabetic mice[J]. BMC Cardiovasc Disord, 2016, 16(1): 5. DOI:10.1186/s12872-015-0169-z |
| [3] | Wang LP, Yang XH, Wang XJ, et al. Erythropoietin decreases the occurrence of myocardial fibrosis by inhibiting the NADPH-ERK-NF-κB pathway[J]. Cardiology, 2016, 133(2): 97–108. |
| [4] | 顾静, 李海龙, 刘凯, 等. 放射性心肌纤维化及其发生机制[J]. 中国老年学杂志, 2013, 33(6): 1469–1471. |
| [5] | Wang LP, Wang Y, Zhao LM, et al. Angiotensin Ⅱ upregulates KCa3.1 channels and stimulates cell proliferation in rat cardiac fibroblasts[J]. Biochem Pharmacol, 2013, 85(10): 1486–1494. DOI:10.1016/j.bcp.2013.02.032 |
| [6] | Zhao LM, Zhang W, Wang LP, et al. Advanced glycation end products promote proliferation of cardiac fibroblasts by upregulation of KCa3.1 channels[J]. Pflug Arch, 2012, 464(6): 613–621. DOI:10.1007/s00424-012-1165-0 |
| [7] | Zhao LM, Wang LP, Wang HF, et al. The role of KCa3.1 channels in cardiac fibrosis induced by pressure overload in rats[J]. Pfluger Arch, 2015, 467(11): 2275–2285. DOI:10.1007/s00424-015-1694-4 |
| [8] | Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure[J]. Am J Physiol Heart Circ Physiol, 2011, 301(6): H2181–H2190. DOI:10.1152/ajpheart.00554.2011 |
| [9] | Frustaci A, Russo MA, Morgante E, et al. Oxidative myocardial damage in human cocaine-related cardiomyopathy[J]. Eur J Heart Fail, 2015, 17(3): 283–290. DOI:10.1002/ejhf.231 |
| [10] | Touyz RM, Briones AM. Reactive oxygen species and vascular biology:implications in human hypertension[J]. Hypertens Res, 2011, 34(1): 5–14. DOI:10.1038/hr.2010.201 |
| [11] | 周骁, 杨会笃, 苏叶馨, 等. 氧化应激促进AGT-REN双转基因高血压小鼠心肌中电导钙激活钾离子通道表达[J]. 中国病理生理杂志, 2016, 32(5): 869–873. |
| [12] | Fu RG, Zhang T, Wang L, et al. Inhibition of the K(+) Channel KCa3.1 reduces TGF-β1-induced premature senescence, myofibroblast phenotype transition and proliferation of mesangial cells[J]. PLoS One, 2014, 9(1): e87410. DOI:10.1371/journal.pone.0087410 |
| [13] | Huang C, Shen S, Ma Q, et al. KCa3.1 mediates activation of fibroblasts in diabetic renal interstitial fibrosis[J]. Nephrol Dial Transplant, 2014, 29(2): 313–324. DOI:10.1093/ndt/gft431 |
| [14] | Huang C, Shen S, Ma Q, et al. Blockade of KCa3.1 ameliorates renal fibrosis through the TGF-β1/Smad pathway in diabetic mice[J]. Diabetes, 2013, 62(8): 2923–2934. DOI:10.2337/db13-0135 |
| [15] | Albaqumi M, Srivastava S, Li Z, et al. KCa3.1 potassium channels are critical for cAMP dependent chloride secretion and cyst growth in autosomal-dominant polycystic kidney disease[J]. Kidney Int, 2008, 74(6): 740–749. DOI:10.1038/ki.2008.246 |
| [16] | Wang LP, Fan SJ, Li SM, et al. Oxidative stress promotes myocardial fibrosis by upregulating KCa3.1 channel expression in AGT-REN double transgenic hypertensive mice[J]. Pflugers Arch, 2017 Apr 28. DOI:10.1007/s00424-017-1984-0[Epubaheadofprint |
 2017, Vol. 43
2017, Vol. 43


