扩展功能
文章信息
- 成兰云, 李开济, 吴静, 张文健, 娄晋宁, 门秀丽
- CHENG Lanyun, LI Kaiji, WU Jing, ZHANG Wenjian, LOU Jinning, MEN Xiuli
- 大鼠胰岛α细胞及其分泌物对β细胞功能的影响
- Influence of rat pancreatic islet α cells and its secretions in function of β cells
- 吉林大学学报(医学版), 2017, 43(05): 874-880
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 874-880
- 10.13481/j.1671-587x.20170504
-
文章历史
- 收稿日期: 2016-09-11
2. 河北省涿州市医院病理科, 河北 涿州 072750;
3. 中日友好医院临床医学研究所, 北京 100029
2. Department of Pathology, Zhuozhou City's Hospital Henan Province, Zhuozhou 072750, China;
3. Institute of Clinical Medical Sciences, China-Japan Friendship Hospital, Beijing 100029, China
糖尿病是严重威胁人类健康的主要疾病之一,其发病率逐年上升,且呈年轻化趋势。胰岛移植已经成为治疗糖尿病的一种有效方法[1],Fiorina等[2]研究发现:胰岛移植不仅能够纠正糖代谢紊乱,而且能够防止或逆转糖尿病的微血管病变。胰岛移植的短期效果较明显,但长期效果仍不尽如人意。有文献[3]报道:胰岛经酶消化后, 周边的α细胞存在不同程度的丢失, 过度消化时α细胞的丢失更为明显,使胰岛分泌的胰岛素/胰高血糖素比值升高。Kang等[4]研究发现:胰岛的完整性对胰岛的功能非常重要,也就是说胰岛其他细胞对β细胞功能的维持至关重要。据文献[5]报道:胰岛α细胞和β细胞的昼夜节律性和相互作用直接影响在胰岛生理功能中起重要作用的基因表达水平,但目前国内该方面研究相对较少。本研究通过分析胰岛α细胞及其分泌物对β细胞功能的影响,进一步阐述胰岛α细胞及其分泌物对β细胞功能的重要作用。
1 材料与方法 1.1 细胞、实验动物、主要试剂和仪器大鼠胰岛素瘤细胞(insulinoma, INS-1细胞)和胰岛α细胞(INR-1G9细胞)由中日友好医院娄晋宁教授提供。裸鼠由北京维通利华实验动物有限公司提供,动物合格证号:SCXK (京)2006-0009。胰高血糖素样肽1(GLP-1) 为上海华谊生物技术有限公司产品,胰岛素检测试剂盒(美国Millipore公司),胰岛素和胰高血糖素抗体(美国Santa Cruz公司)。稳豪倍优型血糖仪(美国强生医疗器械有限公司),酶标仪(Bio-rad 680,美国),奥林巴斯FV1000激光共聚焦显微镜(日本奥林巴斯公司)。
1.2 细胞培养INS-1细胞用完全1640培养基(10%胎牛血清、青霉素10×105 U·L-1、链霉素10×105 U·L-1、5.5 mmol·L-1葡萄糖、10 mmol·L-1 HEPES、50 μmol·L-1 β-巯基乙醇和1 mmol·L-1丙酮酸钠)培养,INR-1G9细胞用1640培养基(10%胎牛血清、青霉素10×104 U·L-1、链霉素10×104 U·L-1、5.5 mmol·L-1葡萄糖和2 mmol·L-1 L-谷氨酰胺)培养,分别置于5%CO2、37℃的孵箱中,每2 d换液。
1.3 胰岛α细胞条件培养基的制备将INR-1G9细胞培养于T75培养瓶中,置于37℃孵箱中培养96 h,收取上清待用。
1.4 MTT法检测胰岛α细胞条件培养基和GLP-1作用下INS-1细胞的增殖能力将INS-1细胞接种于96孔培养板(每孔0.9×104个细胞)中,培养过夜后,分别给予0、10%、20%和30%的胰岛α细胞条件培养基或0、0.03、0.30、3.00和30.00 mg·L-1的GLP-1在5.5和20.0 mmol·L-1葡萄糖浓度条件下培养0、1、3、5和7 d,每组设6个复孔。每孔加入MTT溶液(浓度为5 g·L-1) 30 μL,37℃继续孵育4 h,每孔加入150 μL DMSO,振荡混匀后在酶标仪波长492 nm处测吸光度(A)值。
1.5 ELISA法检测胰岛α细胞作用下INS-1细胞胰岛素释放水平INS-1细胞以2×105 mL-1的密度接种于24孔培养板中,培养48 h后,加入不同比例的α细胞,分别为INS-1细胞数的10%、20%和30%,每组设3个平行孔,共同孵育24 h,用含2.5 mmol·L-1葡萄糖的培养基平衡5 h,然后用Krebs-Ringer-Bicarbo-nate-HEPES buffer (KRBH) (mmol·L-1:140 NaCl,3.6 KCl, 0.5 NaH2PO4·2 H2O,0.5MgSO4·7H2O,1.5 CaCl2,2 NaHCO3,10 HEPES,0.1% BSA)液洗2次。分别用含2.5 mmol·L-1葡萄糖的KRBH或20.0 mmol·L-1葡萄糖的KRBH 0.5 mL刺激细胞2 h,收集上清液,用于胰岛素测定。
1.6 ELISA法检测胰岛α细胞条件培养基作用下INS-1细胞胰岛素释放水平INS-1细胞以2×105 mL-1的密度接种于24孔培养板中,培养72 h后,用含2.5 mmol·L-1葡萄糖的培养基平衡5 h,然后用KRBH液洗2次,分别加入含不同浓度α细胞条件培养基(0、10%、20%和30%)的2.5 mmol·L-1葡萄糖和20.0 mmol·L-1葡萄糖的KRBH 0.5 mL,并加入抑肽酶使其终浓度为1 mg·L-1,刺激细胞2 h,收集上清液,用于胰岛素测定。
1.7 ELISA法检测不同浓度GLP-1作用下INS-1细胞胰岛素释放水平INS-1细胞以2×105 mL-1的密度接种于24孔培养板中,培养72 h后,用含2.5 mmol·L-1葡萄糖的培养基平衡5 h,然后用KRBH液洗2次,分别加入含不同浓度GLP-1(0、0.03、0.30、3.00和30.00 mg·L-1的2.5 mmol·L-1葡萄糖和20.0 mmol·L-1葡萄糖的KRBH 0.5 mL),并加入抑肽酶使其终浓度为1 mg·L-1,刺激细胞2 h,收集上清液,用于胰岛素测定。
1.8 激光共聚焦显微镜分析高糖和GLP-1作用下INS-1细胞内Ca2+浓度将INS-1细胞(每孔1×105个细胞)接种于激光共聚焦专用的培养皿中,培养72 h后分别向每个培养皿里加入含20 mmol·L-1葡萄糖的KRBH1.5 mL、含3 mg·L-1 GLP-1的20 mmol·L-1葡萄糖的KRBH1.5 mL、含30 mg·L-1 GLP-1的20 mmol·L-1葡萄糖的KRBH1.5 mL,37℃孵育1 h后,向每个培养皿里加入5 mmol·L-1 Fluo-3 AM,使其终浓度为5 μmol·L-1,37℃继续孵育1 h,吸掉上清,用5.5 mmol·L-1 1640培养基洗3次,加入含5% FCS的5.5 mmol·L-1葡萄糖1640培养基,37℃继续孵育20 min,激光共聚焦显微镜下观察:激发波长488 nm,发射波长526 nm。
1.9 Western blotting法分析不同浓度的胰岛α细胞条件培养基和不同浓度GLP-1作用下胰岛素蛋白表达水平新接种细胞培养48 h后,弃去上清,分别加入含0、10%、20%和30%胰岛α细胞条件培养基或含0、0.03、0.30、3.00和30.00 mg·L-1GLP-1的5.5 mmol·L-1或20 mmol·L-1葡萄糖的培养基,48 h后收集细胞加入蛋白裂解液,提取蛋白,用蛋白定量试剂盒测定总蛋白浓度(BCA法,碧云天试剂公司)。取60 μg细胞总蛋白,于100℃水浴3 min,然后上样进行SDS-PAGE电泳。电泳结束后,湿转移法将蛋白条带转移至PVDF膜上,50 g·L-1脱脂奶粉封闭后,分别加入胰岛素一抗(1:200) 和β-actin一抗(1:1 000) 置于4℃冰箱振荡孵育过夜。TBST洗膜后,加入HRP标记的二抗(1:20 000) 室温反应1 h。TBST洗涤后,ECL化学发光试剂于暗室中显影,X光胶片曝光,拍照。
1.10 细胞移植后糖尿病裸鼠血糖水平的监测7~8周龄的雄性BALB/c-nu/nu裸鼠禁食12 h后,按照200 mg·kg-1的剂量,一次性腹腔注射STZ溶液,72 h后检测裸鼠血糖水平,连续3 d血糖水平≥16.7 mmol·L-1确认为成功制备糖尿病模型,当血糖水平≥20 mmol·L-1时,进行肾包膜下移植细胞。每只裸鼠移植INS-1细胞约2×107个,移植前24 h,取50%的INS-1细胞,并加入其数量30%的INR-1G9细胞,共同孵育24 h后收集细胞,将制备好的INS-1细胞、INS-1与INR-1G9细胞混合液移植于模型裸鼠左肾包膜下,在无特定病原体(specific pathogen free,SPF)条件下饲养观察40 d,监测血糖水平变化,然后处死动物,观察其肾脏大体形态的变化,并对移植部位进行胰岛素和胰高血糖素的免疫组织化学染色,光镜下拍照。
1.11 统计学分析采用SPSS 17.0统计软件进行统计学分析。细胞增殖能力、胰岛素分泌量、INS-1细胞内钙浓度和胰岛素蛋白表达水平以x ±s表示,组间比较采用单因素方差分析,组间均数两两比较采用SNK-q检验。以α=0.05为检验水准。
2 结果 2.1 各组胰岛α细胞条件培养基和GLP-1作用下INS-1细胞的增殖能力在5.5 mmol·L-1或20.0 mmol·L-1葡萄糖刺激下,与对照组比较,α细胞条件培养基(10%、20%和30%)和GLP-1 (0.03、0.30、3.00和30.00 mg·L-1)均促进INS-1细胞的增殖活性(P < 0.05),并且随着条件培养基比例或GLP-1浓度增加,INS-1细胞增殖能力增强。见图 1和2。
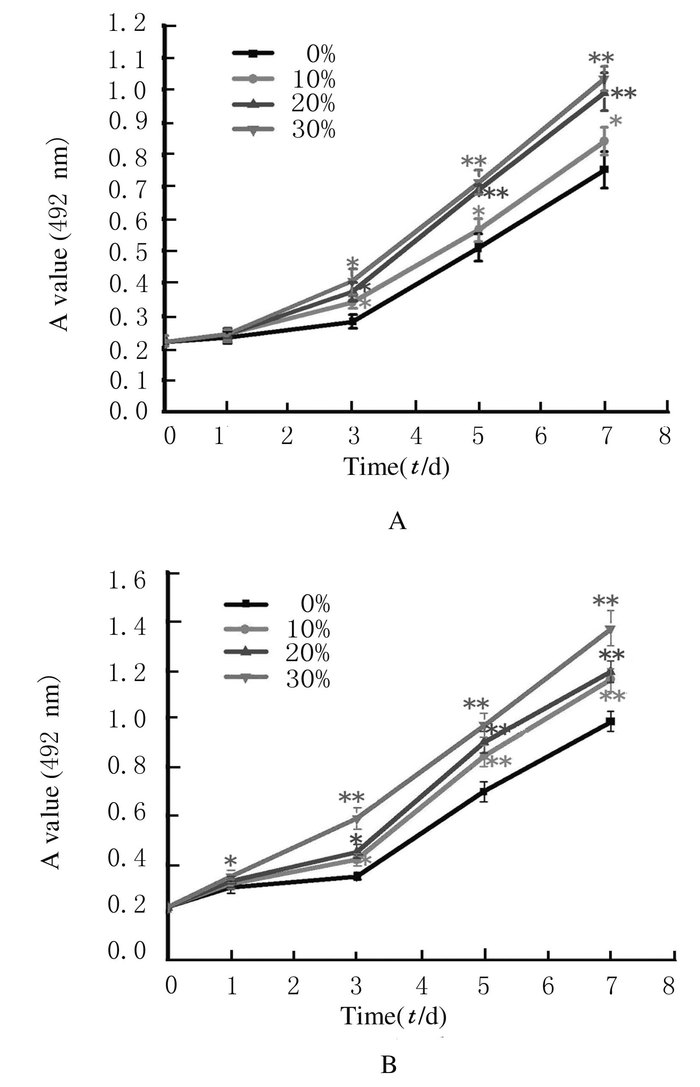
|
|
A:5.5 mmol·L-1 glucose; B:20.0 mmol·L-1 glucose.
*P<0.05, * *P<0.01 vs 0%(control group). 图 1 不同浓度α细胞条件培养基作用下INS-1细胞增殖活性 Figure 1 Proliferation activities of INS-1 cells after treated with different concentrations of α-cell conditioned medium |
|
|
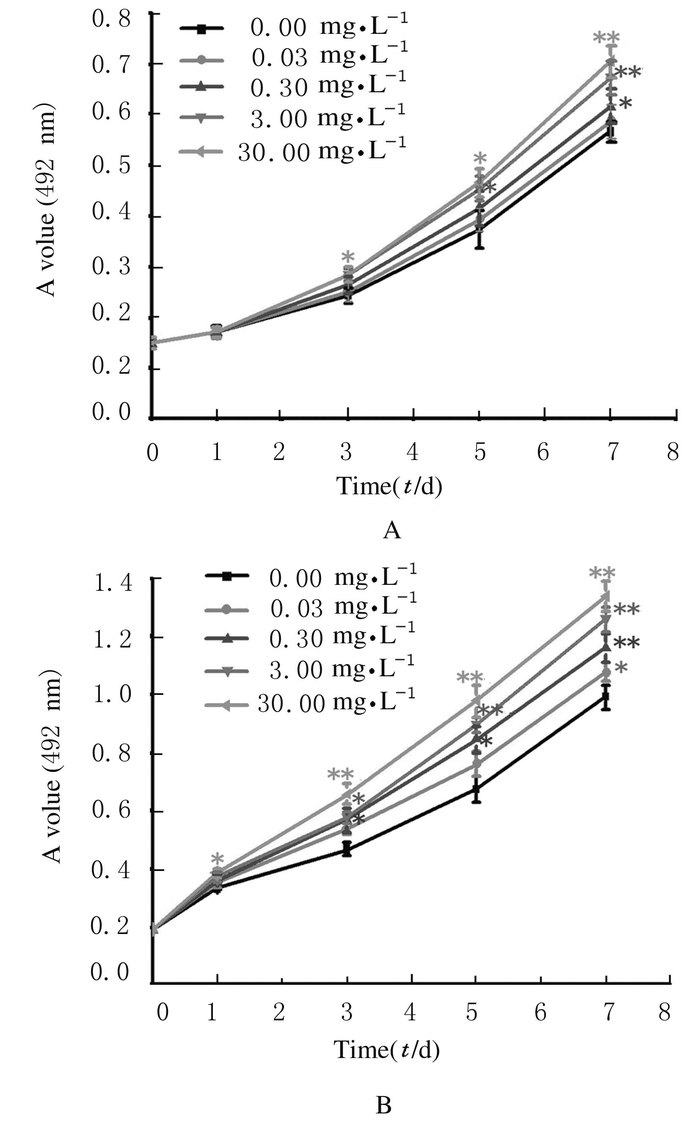
|
|
A:5.5 mmol·L-1 glucose; B:20.0 mmol·L-1 glucose. *P<0.05, * *P<0.01 vs 0%(control group). 图 2 不同浓度GLP-1作用下INS-1细胞增殖活性 Figure 2 Proliferation activities of INS-1 cells after treated with different concentrations of GLP-1 |
|
|
在20.0 mmol·L-1葡萄糖刺激下,与对照组比较,α细胞、α细胞条件培养基和GLP-1均促进INS-1细胞胰岛素分泌(P < 0.05),且α细胞对INS-1细胞胰岛素分泌的刺激作用与α细胞的比例呈正相关关系(r= 0.92, P<0.05);α细胞条件培养基和GLP-1对INS-1细胞胰岛素分泌的刺激作用呈量效关系,即INS-1细胞胰岛素分泌与α细胞条件培养基和GLP-1的浓度呈正相关关系(r=0.89, P<0.05)。见图 3~5。
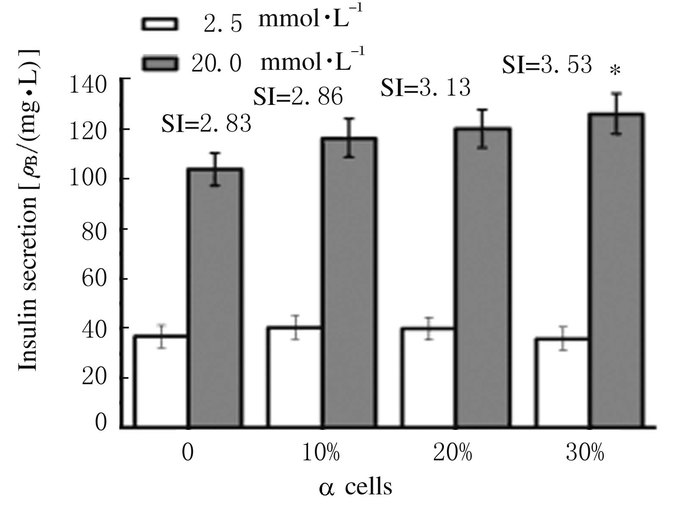
|
| *P<0.05 vs 0%(control group). 图 3 不同比例α细胞作用下INS-1细胞的胰岛素分泌水平 Figure 3 Levels of insulin secretion of INS-1 cells after treated with different proportions of α cells |
|
|

|
| *P<0.05 vs 0%(control group). 图 4 不同浓度α细胞条件培养基作用下INS-1细胞胰岛素分泌水平 Figure 4 Levels of insulin secretion of INS-1 cells after treated with different concentrations of α-cell conditioned medium |
|
|
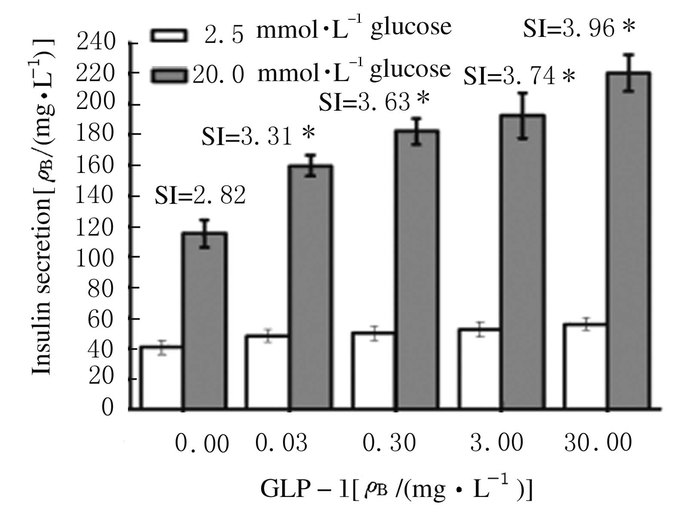
|
| *P<0.05 vs 0.0 mg·L-1(control group). 图 5 不同浓度GLP-1作用下INS-1细胞胰岛素分泌水平 Figure 5 Levels of insulin secretion of INS-1 cells after treated with different concentrations of GLP-1 |
|
|
与加入5.5 mmol·L-1葡萄糖比较,加入20 mmol·L-1葡萄糖与加入20 mmol·L-1葡萄糖+GLP-1时,细胞内Ca2+浓度明显升高(P < 0.05),而且加入GLP-1后,细胞内Ca2+浓度升高更明显(P < 0.05),加入30 mg·L-1 GLP-1比加入3 mg·L-1GLP-1细胞内Ca2+浓度略有增加(P < 0.05)。见图 6(插页二)。
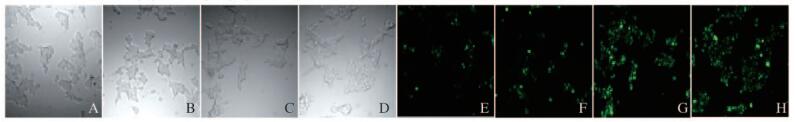
|
| 图 6 Fluo-3/AM染色后激光共聚焦显微镜下INS-1细胞Ca2+水平 Figure 6 Levels of Ca2+ in INS-1 cells after Fluo-3/AM staining under confocal laser scanning microscope |
|
|
与对照组比较,不同浓度胰岛α细胞条件培养基和GLP-1组INS-1细胞中胰岛素蛋白表达水平差异无统计学意义(P>0.05)。见图 7和8。
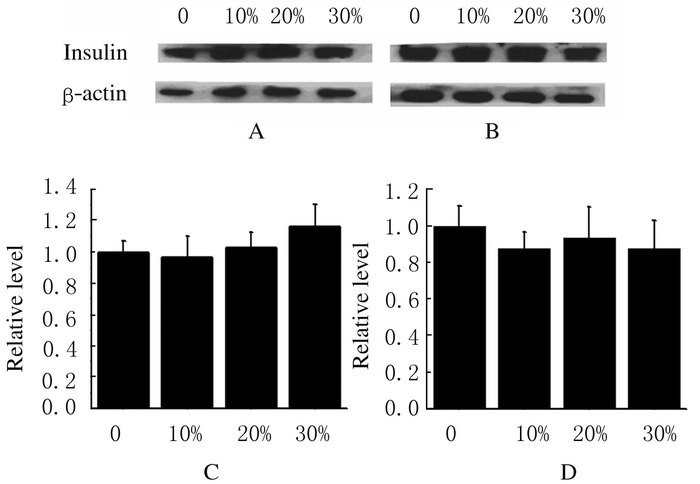
|
| A, C:5.5 mmol·L-1 glucose;B, D:20.0 mmol·L-1 glucose. 图 7 不同浓度α细胞条件培养基作用下INS-1细胞中胰岛素蛋白表达水平 Figure 7 Expression levels of insulin protein in INS-1 cells after treated with different concentrations of α cell conditioned medium |
|
|
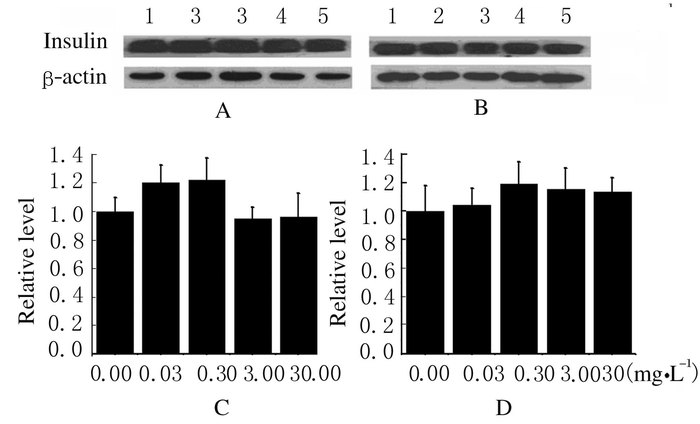
|
|
Lane 1-5:0.00, 0.03, 0.30, 3.00 and 30.00 mg·L-1 . A, C:5.5 mmol·L-1 glucose; B, D:20.0 mmol·L-1 glucose. 图 8 不同浓度GLP-1作用下INS-1细胞中胰岛素蛋白表达水平 Figure 8 Expression levels of insulin protein in INS-1 cells after treated with different concentrations of GLP-1 |
|
|
将INS-1或INS-1+INR-IG9移植到糖尿病裸鼠的左肾包膜下,与未移植的糖尿病裸鼠比较,移植INS-1细胞的糖尿病裸鼠的血糖水平明显下降(P < 0.05),甚至出现低血糖;而移植INS-1+INR-IG9细胞的糖尿病裸鼠血糖无明显变化(P>0.05),一直处于高血糖状态。见图 9。
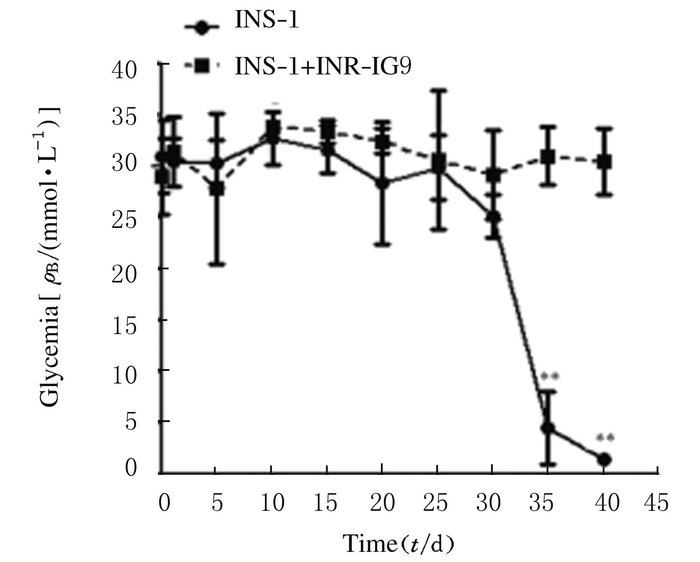
|
| *P<0.01 vs INS-1+IG9 group. 图 9 细胞移植后各组裸鼠血糖水平 Figure 9 Levels of blood glucose of diabetic nude mice after cell transplantation |
|
|
将裸鼠处死,取其肾脏观察其形态:与右肾比较,移植INS-1细胞的左肾明显增大,形态不规则,表面凹凸不平;移植INS-1+α细胞的左肾无明显变化。见图 10(插页二)。
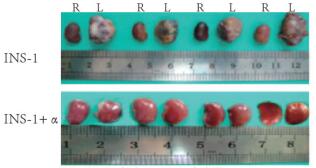
|
| R:Right kidney;L:Left kidney. 图 10 INS-1和 INS-1+INR-1G9细胞移植后糖尿病裸鼠左肾形态表现 Figure 10 Morphology of left renal of diabetic nude mice after INS-1 and INS-1+INR-1G9 transplantation |
|
|
裸鼠肾包膜下移植部位免疫组织化学染色结果显示:与移植前比较,移植部位的INS-1细胞同时表达胰岛素和胰高血糖素。见图 11(插页二)。
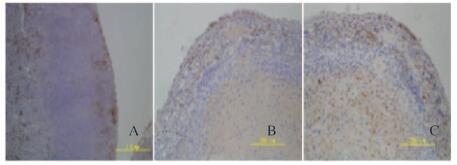
|
| A: Transplanted swelling tissues(×100); B: Staining of insulin in transplanted swelling tissues;(×200); C: Staining of glucagon in transplanted swelling tissues(×200). 图 11 移植细胞免疫组织化学染色结果 Figure 11 Immunohistochemistry staining results of transplanted INS-1 cells |
|
|
胰岛主要由4种内分泌细胞组成:α细胞,分泌胰高血糖素,占胰岛细胞总数的20%~25%;β细胞,分泌胰岛素,占胰岛细胞总数的60%~75%;δ细胞,分泌生长激素抑制素,占胰岛细胞总数的5%;PP细胞,分泌胰多肽,但数量极少。β细胞聚集在胰岛中心,周围被α细胞、δ细胞和PP细胞环绕。上述各种细胞分泌不同的激素,这些激素互相调节,共同维持血糖的稳定。血糖的体内平衡主要取决于α细胞和β细胞的直接作用,其中胰岛素起着降低血糖的作用,而胰高血糖与胰岛素相对抗,起着升高血糖的作用,也就是说当血糖水平升高时,β细胞释放胰岛素以降低血糖;当血糖浓度降低时,α细胞分泌胰高血糖素以升高血糖,从而使血糖保持相对稳态。虽然只有β细胞能合成、储存和释放胰岛素, 但其他内分泌细胞及其所产生的激素对β细胞的存活和胰岛素的分泌具有重要的调节作用[6]。
本研究结果显示:随着α细胞比例的增加,INS-1细胞胰岛素分泌增加,且30%的α细胞可明显增加β细胞胰岛素释放,说明胰岛素的分泌不仅取决于β细胞的功能状态, 也受到α细胞及其数量等方面的影响。
Pipeleers等[7]通过比较完整胰岛和纯化的胰岛β细胞对葡萄糖刺激的胰岛素释放功能发现:完整胰岛的胰岛素释放是纯化β细胞的30倍,而给纯化的β细胞加入胰高血糖素后胰岛素分泌功能可完全恢复。Fujita等[8]研究显示:胰高血糖素对β细胞的胰岛素基因转录和生物合成无明显作用。α细胞分泌的胰高糖素可能是胰岛β细胞的一种生长激素, 纯化的胰岛β细胞在体外培养仅能短期存活, 而与α细胞混合培养则明显延长β细胞的存活时间[9]。本研究结果显示:胰岛α细胞条件培养基不仅可促进INS-1细胞增殖,而且还可以促进INS-1细胞胰岛素分泌,说明α细胞分泌的胰高糖素对β细胞生长和胰岛素分泌起重要的调节作用,这一结果与前面所述文献报道一致。
GLP-1是由30个氨基酸组成的激素样多肽,主要由肠道L细胞产生,其来源于胰高血糖素原裂解后的修饰片段,可促进胰岛素分泌,维持血糖稳态[10]。本研究结果显示:在葡萄糖浓度较高时, GLP-1使胰岛素分泌明显增加, 同时INS-1细胞内Ca2+荧光强度明显升高, 而且在较高浓度葡萄糖基础上加入GLP-1,细胞内Ca2+浓度升高更明显,说明GLP-1可以明显促进葡萄糖依赖的胰岛素分泌。其原因可能是当细胞外液葡萄糖浓度升高时,葡萄糖进入β细胞,细胞内ATP含量增加,ATP与ATP敏感的K+通道结合,导致K+通道关闭,细胞膜去极化,于是Ca2+通道开放,Ca2+内流,刺激胰岛素从β细胞排出[11]。胰岛β细胞内Ca2+浓度升高不仅是胰岛素分泌的启动信号, 也反映胰岛素分泌的强度,GLP-1与胰岛β细胞上特异受体结合之后, 使β细胞内cAMP生成增加, cAMP作为细胞内信号使引起细胞内一系列反应, 导致胰岛素释放[9]。
本研究还显示:GLP-1可以促进INS-1细胞的增殖。Tourrel等[12]证实:大鼠注射STZ后,给予GLP-1,β细胞数量增加;另有多项研究[13-14]显示:GLP-1及其类似物不仅可刺激胰岛β细胞的增殖和胰岛素的合成,还可以参与维持葡萄糖的稳态。
通过胰岛细胞移植增加患者的胰岛素分泌细胞,可有效地控制糖代谢,减少和改善糖尿病的并发症,同时还有助于避免外源性胰岛素治疗带来的低血糖和胰岛素抵抗。但是由于胰岛提取分离过程中,胶原酶消化、氧供给等一系列因素使胰岛的完整性遭到破坏,尤其是胰岛α细胞的严重丢失,造成胰岛β细胞功能障碍。Keymeulen等[15]研究发现:部分胰岛移植后的患者, 每日的胰岛素用量没有明显降低, 但胰高血糖素的注射能引起明显的C-肽分泌(胰岛β细胞分泌的胰岛素和C肽呈等分子关系),表明移植胰岛的β细胞是有功能的, 但在胰岛素分泌调控方面存在障碍。这种现象与α细胞缺失的胰岛功能障碍非常相似。α细胞缺失导致胰岛对葡萄糖刺激的反应性降低,将其移植到糖尿病动物后不能使血糖恢复正常,而给予外源性的胰高血糖素可以明显改善这类胰岛的胰岛素分泌功能[4]。另有临床试验研究[16]表明:静脉输注GLP-1有助于恢复移植后糖尿病患者胰岛素和胰高血糖素水平。
本研究中将单纯的INS-1细胞和加入30%α细胞的INS-1细胞分别移植至糖尿病裸鼠,结果显示:单纯移植INS-1细胞可以明显降低糖尿病裸鼠的血糖,甚至出现低血糖;而将30%α细胞与INS-1细胞混合移植,糖尿病鼠的血糖未降,且一直处于高水平。裸鼠细胞移植部位免疫组织化学染色结果显示:移植部位的INS-1细胞不仅表达胰岛素,同时还表达胰高血糖素。本文作者推测:本研究中α细胞与β细胞混合移植效果较差的原因可能与INS-1细胞既表达胰岛素又表达胰高血糖素有关,但具体机制有待于进一步研究。
| [1] | Jin SM, Kim KW. Is islet transplantation a realistic approach to curing diabetes?[J]. Korean J Intern Med, 2017, 32(1): 62–66. DOI:10.3904/kjim.2016.224 |
| [2] | Fiorina P, Gremizzi C, Maffi P, et al. Islet transplantation is associated with an improvement of cardiovascular function in type1 diabetic kidney transplant patients[J]. Diabetes Care, 2005, 28(6): 1358–1365. DOI:10.2337/diacare.28.6.1358 |
| [3] | Wang H, Zhang W, Cai H. α-Cell loss from islet impairs its insulin secretion in vitro and in vivo[J]. Islets, 2011, 3(2): 58–65. DOI:10.4161/isl.3.2.15036 |
| [4] | Kang H, Han K, Jo J, et al. Systems of pancreatic beta-cells and glucose regulation[J]. Front Biosci, 2008, 13(1): 6421–6431. |
| [5] | Petrenko V, Saini C, Giovannoni L. Pancreatic α-and β-cellular clocks have distinct molecular properties and impact on islet hormone secretion and gene expression[J]. Genes Dev, 2017, 31(4): 383–398. DOI:10.1101/gad.290379.116 |
| [6] | Kanno T, Gopel SO, Rorsman P, et al. Cellular function in multicellular system for hormone-secretion:electrophysiological aspect of studies on alpha-, beta-and delta-cells of the pancreatic islet[J]. Neurosci Res, 2002, 42(2): 79–90. DOI:10.1016/S0168-0102(01)00318-2 |
| [7] | Pipeleers D, Int P, Maes E. Glucose-induced insulin release depends on functional cooperation between islet cells[J]. Proc Natl Acad Sci, 1982, 79(23): 7322–7325. DOI:10.1073/pnas.79.23.7322 |
| [8] | Fujita Y, Wideman RD, Asadi A, et al. Glucose-dependent insulinotropic polypeptide is expressed in pancreatic islet alpha-cells and promotes insulin secretion[J]. Gastroenterology, 2010, 138(5): 1966–1975. DOI:10.1053/j.gastro.2010.01.049 |
| [9] | Henquin JC. Triggering and amplifying pathways of regulation of insulin secretion by glucose[J]. Diabetes, 2000, 49(11): 1751–1760. DOI:10.2337/diabetes.49.11.1751 |
| [10] | Calanna S, Christensen M, Holst JJ, et al. Secretion of glucagon-like peptide-1 in patients with type 2 diabetes mellitus:systematic review and meta-analyses of clinical studies[J]. Diabetologia, 2013, 56(5): 965–972. DOI:10.1007/s00125-013-2841-0 |
| [11] | Gomez E, Pritchard C, Herbert TP. cAMP-dependent protein kinase and Ca2+ influx through L-type voltage-gated calcium channels mediate Raf-independent activation of extracellular regulated kinase in response to glucagon-like peptide-1 in pancreatic beta-cells[J]. J Biol Chem, 2002, 277(50): 48146–48151. DOI:10.1074/jbc.M209165200 |
| [12] | Tourrel C, Bailbe D, Lacorne M, et al. Persistent improvement of type 2 diabetes in the Goto-Kakizaki rat model by expansion of the beta-cell mass during the prediabetic period with glucagon-like peptide-1 or exendin-4[J]. Diabetes, 2002, 51(5): 1443–1452. DOI:10.2337/diabetes.51.5.1443 |
| [13] | Trevaskis JL, Sacramento CB, Jouihan H, et al. Neurturin and a Glp-1 analogue act synergistically to alleviate diabetes in Zucker Diabetic Fatty Rats[J]. Diabetes, 2017. DOI:10.2337/db16-0916 |
| [14] | Traub S, Meier DT, Schulze F, et al. Pancreatic α Cell-Derived Glucagon-Related Peptides Are Required for β Cell Adaptation and Glucose Homeostasis[J]. Cell Rep, 2017, 18(13): 3192–3203. DOI:10.1016/j.celrep.2017.03.005 |
| [15] | Keymeulen B, Korbutt G, De Paepe M, et al. Long-term metabolic control by rat islet grafts depends on the composition of the implant[J]. Diabetes, 1996, 45(12): 1814–1821. DOI:10.2337/diab.45.12.1814 |
| [16] | Halden TA, Egeland EJ, Åsberg A, et al. GLP-1 restores altered insulin and glucagon secretion in posttransplantation diabetes[J]. Diabetes Care, 2016, 39(4): 617–624. DOI:10.2337/dc15-2383 |
 2017, Vol. 43
2017, Vol. 43


