扩展功能
文章信息
- 翟晓雅, 冯乔, 韦日明, 陈叶, 胡婷婷, 冯乐平
- ZHAI Xiaoya, FENG Qiao, WEI Riming, CHEN Ye, HU Tingting, FENG Leping
- 高浓度葡萄糖条件下肾小球系膜细胞内源性烟酰胺磷酸核糖转移酶对波形蛋白表达的调控作用
- Regulation effect of endogenous nicotinamide phosphoribosyltransferase on Vimentin expression of glomerular cells in high concentration of glucose
- 吉林大学学报(医学版), 2017, 43(05): 867-873
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 867-873
- 10.13481/j.1671-587x.20170503
-
文章历史
- 收稿日期: 2017-04-02
2. 桂林医学院附属医院优生遗传科, 广西 桂林 541004;
3. 桂林医学院生物技术学院生物技术教研室, 广西 桂林 541004
2. Department of Prepotency, Affiliated Hospital, Guilin Medical University, Guilin 541004, China;
3. Department of Biotechnology, School of Biotechnology, Guilin Medical University, Guilin 541004, China
糖尿病肾病(diabetic nephropathy, DN)最终导致终末肾病,严重危害人类健康。研究[1]表明:通过核因子κBp65 (nucler factor kappa Bp65, NF-κBp65) 和Sirt1信号通路进行干预,对预防和治疗DN纤维化具有重大意义。烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferases, Nampt)除作为细胞合成烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的关键酶之外,还具有炎性因子作用。过度表达的Nampt能够通过c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和NF-κBp65通路促进单核细胞白细胞介素1(interleukin-1, IL-1) 和白细胞介素6(interleukin-6, IL-6) 的表达,从而加速单核细胞向巨噬细胞的转化[2]。Nampt还能够激活细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK-1/2)/NF-κB/诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)通路,最终介导血管炎症的发生,并通过多条炎性通路发挥作用[3-4]。波形蛋白(Vimentin, VIM)是间充质细胞的细胞骨架的中间丝构成,也是细胞来源于间充质的标志,常被认为是细胞获得了间质表型的特征性分子[5]。本课题组前期研究发现:在糖尿病肾脏纤维化过程中肾小球实质组织表达Vimentin增加。然而,Nampt作为启动炎症的主要分子,在严重糖尿病动物肾脏纤维化过程中是否参与诱导Vimentin表达鲜有报道。本研究通过高浓度葡萄糖诱导肾脏细胞内源性Nampt过度表达,探讨Nampt参与激活Vimentin表达的机制,为糖尿病肾小球炎性纤维化的预防和治疗提供新的科学依据。
1 材料与方法 1.1 细胞、实验动物、主要试剂和仪器大鼠肾小球系膜细胞HBZY-1购自中国医学科学院基础医学研究所。胰岛素基因突变的C57/LB6小鼠模型[6-7](美国密之根大学医学院糖尿病研究中心提供),雄性,体质量25~30 g,该动物作为自发DN实验组,以野生型C57/LB6小鼠作为对照组。2组动物各10只,均采取普通饲料喂养60 d后,实验组小鼠血糖水平达(34.24±7.92) mmol·L-1(严重糖尿病状态)、尿素氮(blood urea nitrogen, BUN)达(27.85±8.74) mmol·L-1及血肌酐(serum creatinine, SCr)达(23.58±4.68) mmol·L-1(肾脏功能明显受损状态)时处死,取出肾脏组织。含0.56 mmol·L-1葡萄糖的MEM培养液(美国Gibco公司);10%胎牛血清(美国Gemini公司);胰蛋白酶(工作液浓度0.25%)、青霉素(终浓度100 000 U·L-1)、链霉素(终浓度100 mg·L-1)(中国Solarbio公司);一抗:Nampt(美国Santa公司),抗Vimentin(美国Bioword公司),抗依赖于NAD+的组蛋白去乙酰化酶1(sirtuin type 1,Sirt1) 抗体和抗NF-κBp65(均为多抗)(英国Abcam公司),FK866(中国APExBIO公司);4′, 6-二脒基-2-苯基吲哚(DAPI)(中国捷世康公司);二抗(FITC和cy3荧光偶联标记的抗体,美国LIFE公司);TRIzol试剂盒(美国Invitrogen公司);烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)(美国Sigma公司)。GIS-1000图像分析系统(中国上海天能科技有限公司),激光共聚焦扫描显微镜(德国Zeiss公司),PCR扩增仪、凝胶成像系统、Mini-PROTEAN 3 CELL 165-3301电泳系统和小型垂直电泳转印系统(美国BIO-RAD公司)。
1.2 组织病理检测取小鼠肾组织石蜡包埋切片,常规HE染色,光镜下观察小鼠肾脏组织病理表现。
1.3 细胞株及分组将大鼠肾小球系膜细胞HBZY-1置于含5% CO2、37℃培养箱中适应性培养至对数生长期,用0.25%胰蛋白酶消化,收集细胞按每孔1×106个细胞移至直径35mm细胞培养皿中适应性培养24 h。将细胞随机分为4组:0.56 mmol·L-1低浓度葡萄糖(LG)对照组、200 mmol·L-1高浓度葡萄糖(HG)处理组、HG+10 μmol·L-1 FK866组和HG+1 mmol·L-1 NMN组。HG干预5 d,免疫荧光检测细胞Nampt、Vimentin、NF-κB65和Sirt1蛋白表达和定位。每组设3个复孔,继续培养24 h收集细胞进行RT-PCR检测。另将HG培养的细胞分为对照组和终浓度为1 mmol·L-1NMN组,应用免疫荧光法检测细胞中Nampt和Vimentin表达和定位,免疫印迹法检测Nampt和Vimentin表达。
1.4 免疫荧光检测蛋白表达和定位取小鼠肾脏组织4%多聚甲醛固定、石蜡包埋和切片,组织切片经脱蜡和酒精梯度脱水,枸橼酸微波修复后经10%山羊血清封闭1 h,用待检测蛋白一抗(Nampt和Vimentin抗体)孵育置于4℃冰箱过夜。再分别加入含有荧光的二抗,37℃避光孵育1 h,DAPI复染5 min后,PBS冲洗3次,于DAPI溶液中避光染色5 min,应用抗荧光淬灭剂进行封片后,免疫共聚焦显微镜放大64倍,检测肾小球系膜细胞中Nampt和Vimentin的表达和定位。取出载有培养的大鼠肾小球系膜细胞(HBZY-1) 的玻片,用待检测蛋白的一抗(Nampt、Vimentin、NF-κBp65和Sirt1抗体)进行孵育,放置4℃冰箱静置过夜,再分别加入含有荧光的二抗,于37℃避光孵育1 h,DAPI复染5 min后,抗荧光淬灭剂封片,应用免疫荧光显微镜放大20倍,分别检测细胞中Nampt、NF-κB和Sirt1表达和定位。各目的荧光蛋白的表达均采集10个不同的区域面积(0.36 mm×0.36 mm)的着色细胞进行计量,所得数据应用Image J软件进行分析,获得各自蛋白表达荧光强度的细胞相对面积。
1.5 RT-PCR法检测基因表达应用TRIzol试剂盒(按说明书操作)提取总RNA,进行RT-PCR测定。根据GenBank中大鼠Nampt、NF-κB和Vimentin的全基因序列分别设计引物。Nampt(109 bp)扩增序列引物,上游引物:5′-ATAGGGGCATCTGCTCATTT-3′,下游引物:5′-ACTGTGCTCTGCCGCTGGAA-3′;Vimentin(150 bp)扩增序列引物,上游引物:5′-ATGAAAGTGTGGCTGCCAAGAAC-3′,下游引物:5′-GTGACTGCACCTGTCTCCGGTA-3′;NF-κBp65(221 bp)扩增序列引物,上游引物:5′-GACCTGGCATCTGTGGACAAC-3′,下游引物:5′-TCCGCAATGGAGGAGAAGTCT-3′;β-actin(630 bp)扩增序列引物,上游引物:5′-GATGGTGGGTATGGGTCAGAAGGAC-3′, 下游引物:5′-GCTCATTGCCGATAGTGATGACCT-3′。引物由上海生工生物工程技术服务有限公司合成。PCR扩增条件:95℃、2 min, 94℃、50 s, 58℃、50 s, 72℃、30 s, 30个循环;72℃、10 min。反应中β-actin应用20个循环,退火温度为63℃。mRNA表达分析采用GIS-1000图像分析系统。PCR产物相对表达水平=靶基因相对灰度值/β-actin灰度值,蛋白相对表达水平=IA目标基因/IAβ肌动蛋白基因(IAβ-actin)(表达条带灰度值的相对比值)。
1.6 免疫印迹法检测蛋白表达水平取培养的肾小球系膜细胞HBZY-1加入细胞裂解液于Eppendorf离心管,超声波粉碎仪裂解蛋白,经4℃低温高速离心机12 000 r·min-1离心15 min取上清液;蛋白定量后进行SDS-PAGE电泳,电压120 V电泳、PVDF半干式转膜(电压150 V,60 min)和封闭,应用目的蛋白一抗孵育4℃过夜,于次日应用含有荧光的目的蛋白二抗孵育1 h,将PVDF膜置于凝胶成像系统中获取对应蛋白条带图片,并与β-actin条带进行对比获得各自蛋白的相对表达水平。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。Nampt、Vimentin、NF-κBp65和Sirt1mRNA和蛋白表达水平均以x ±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
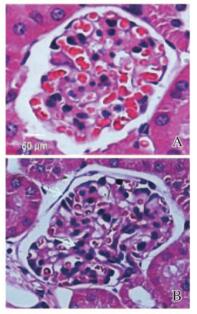
2 结果 2.1 糖尿病小鼠肾脏组织病理表现DN胰岛素基因突变的C57/LB6小鼠肾脏组织病理表现:肾小球明显萎缩,肾小管壁增厚,组织内有炎性细胞浸润。结合血糖和生化代谢指标,表明糖尿病小鼠已经进入DN的早期阶段。见图 1(插页一)。
|
| A:Control group; B:Diabetes group. 图 1 糖尿病肾病小鼠的肾小球形态变化(HE, ×200) Figure 1 Morphological changes of glomerulus of diabetic nephropathy mice(HE, ×200) |
|
|
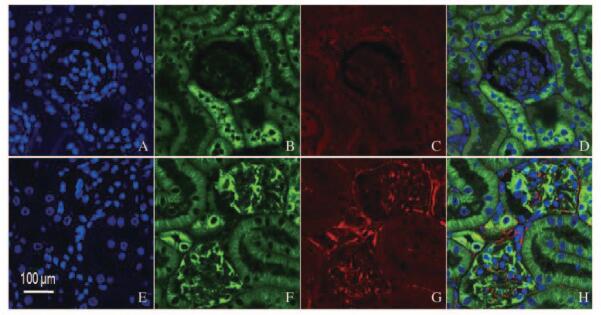
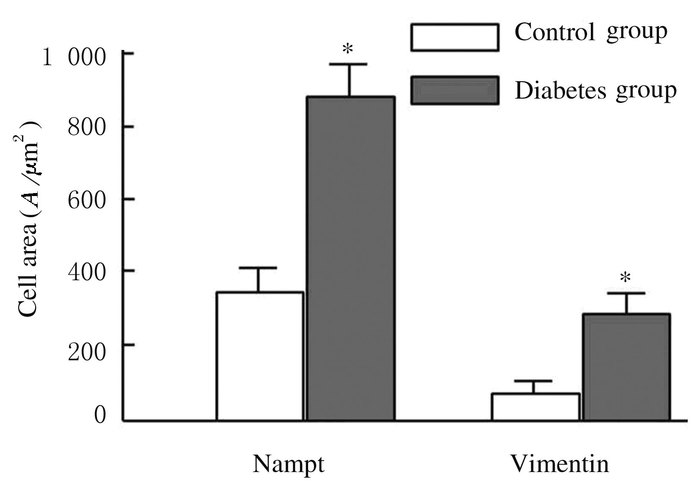
免疫共聚焦检测显示:小鼠肾组织中肾小管和肾小球系膜细胞质内均有明显Nampt过量表达;与对照组比较,肾小球系膜细胞中有大量Vimentin表达。糖尿病组小鼠肾小球细胞中Nampt和Vimentin相对表达水平分别为838.3±124.5和672.3±159.7,均高于相应对照组(389.4±40.5和364.2±122.9)(P<0.01)。见图 2(插页一)(图 2中白色条带长度为100 μm;绿色代表Nampt表达,红色代表Vimentin表达)和图 3。
|
| A-D:Control group;E-H:Diabetes groups;A,E:Nucleus;B,F:Nampt;C,G:Vimentin;D,H:Merge. 图 2 兔疫共聚焦小鼠肾小球系膜中Nampt和Vimentin表达(bar=100 μm) Figure 2 Expressions of Nampt and Vimentin in glomerular cells of mice detected by confocal immunofluorescence(bar=100 μm) |
|
|
|
| *P<0.01 compared with control group. 图 3 小鼠肾小球系膜细胞中Nampt和Vimentin水平 Figure 3 Expression levels of Nampt and Vimentin in glomerular cells of mice |
|
|
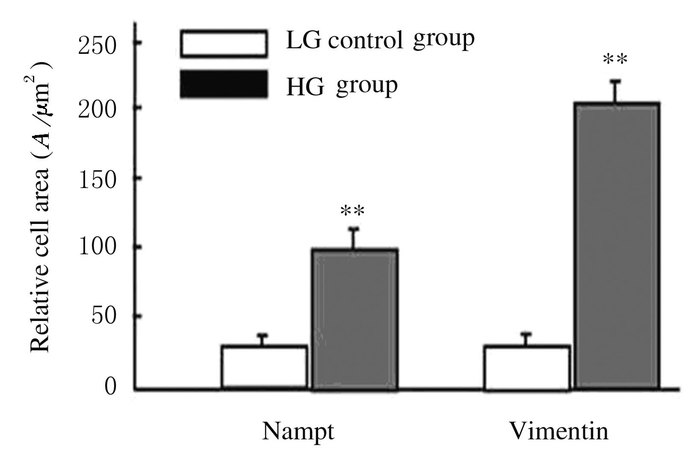
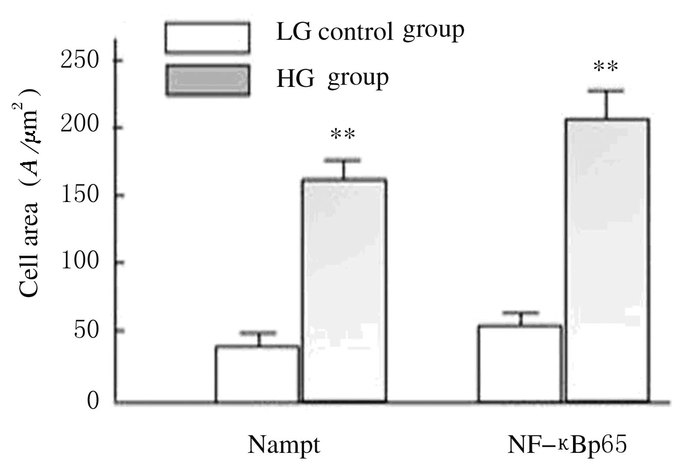
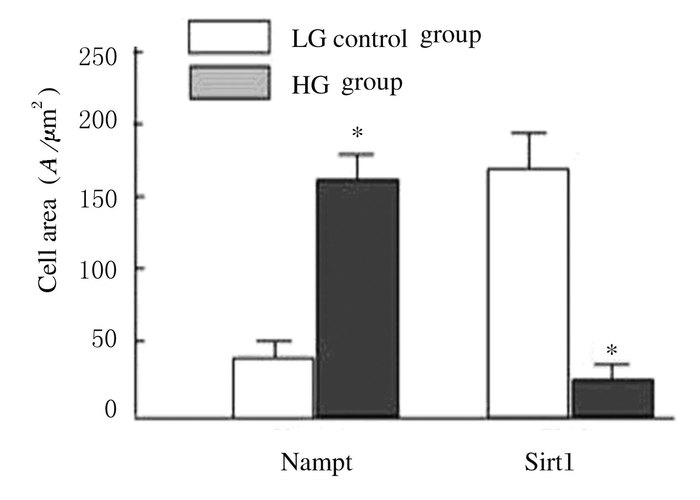
免疫荧光检测显示:HBZY-1系膜细胞在HG条件下,细胞内Nampt和Vimentin相对蛋白表达水平分别为102.5±23.2和203.7±38.9,均较各自对照组(32.8±9.5和42.5±12.6) 增加(P<0.01),见图 4(插页一)和图 5。在细胞过度表达内源性Nampt同时,NF-κBp65表达也明显增加(红色荧光),主要出现在细胞核部位,见图 6(插页二)。HG培养的HBZY-1细胞Nampt和NF-κBp65蛋白相对表达水平分别为166.2±25.7和218.6±26.9,均较对照组(46.6±15.3和63.8±21.6) 增加(P < 0.01),见图 7。HG培养的HBZY-1细胞Nampt表达增加,而Sirt1表达则减少,图 8(插页二),此时细胞内Nampt相对表达水平为(159.2±26.9), 较对照组(43.2±14.6) 明显增加(P < 0.01);而Sirt1相对表达水平(24.7±8.8) 较对照组(165.4±30.4) 明显减少(P<0.01)。见图 9。

|
| A-C:LG group;D-F:HG group;A,D:Nucleus;B,E:Nampt;C,F:Vimentin. 图 4 兔疫荧光检测HG培养HBZY-1细胞中Nampt和Vimentin的表达(bar=25 μm) Figure 4 Expressions of Nampt and Vimentin in HBZY-1 cells cultivated in HG detected by immunofluorescence(bar=25 μm) |
|
|
|
| *P< 0.01 vs control group. 图 5 HG培养HBZY-1细胞中Nampt和Vimentin的表达水平 Figure 5 Effect of HG on Nampt and Vimentin expression in HBZY-1 cells |
|
|
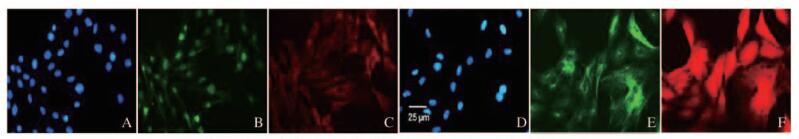
|
| A-C:Control;D-F:HG;A,D:Nucleus;B,E:Nampt;C,F:NF-κBp65 图 6 兔疫荧光检测HG培养HBZY-1细胞中Nampt和NF-κBp65表达(bar=25 μm) Figure 6 Expression of Nampt and NF-κBp65 in HBZY-1 cells cultivated in HG detected by immunofluorescence(bar=25 μm) |
|
|
|
| *P< 0.01 vs control group.. 图 7 HG培养HBZY-1细胞中Nampt和NF-κBp65表达水平 Figure 7 Expression levels of Nampt and NF-κBp65 in HBZY-1 cells cultivated by HG |
|
|
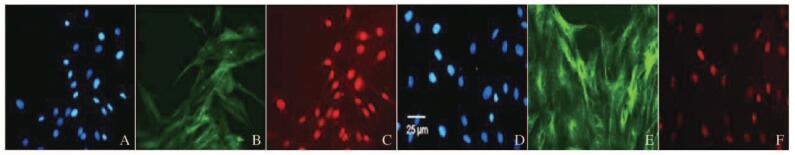
|
| A-C:Control;D-F:HG;A,D:Nucleus;B,E:Nampt;C,F:Sirt1. 图 8 兔疫荧光检测HG培养HBZY细胞中Nampt和Sirt1表达(bar=25 μm) Figure 8 Expression of Nampt and Sirt1 in HBZY cells cultivated in HG detected by immunofluorescence(bar=25 μm) |
|
|
|
| *P< 0.01 vs control group. 图 9 HG培养HBZY-1细胞Nampt和Sirt1表达水平 Figure 9 Expression levels of Nampt and Sirt1 in HBZY-1 cells cultivated in HG |
|
|
RT-PCR检测:NMN干预时NF-κBp65mRNA相对表达水平(0.66±0.52) 较对照组(1.17±0.32) 明显降低(P < 0.01),VimentinmRNA相对表达水平(0.34±0.11) 也较对照组(0.84±0.29) 明显降低(P<0.01)。见图 10。
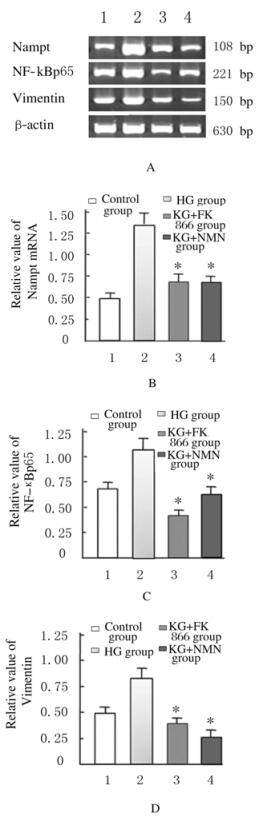
|
| *P<0.01 vs control group;A:Electrophoregram; B-D:Histogram.Lane 1:control group; Lane 2:HG group; Lane 3:HG+FK866 group; Lane 4:HG+NMN group. 图 10 各组HBZY-1细胞中Nampt、NF-κBp65和Vimentin mRNA相对表达水平 Figure 10 Relative expression levels of Nampt, NF-κBp65 and Vimentin mRNA in HBZY-1 cells in various groups |
|
|
免疫荧光检测显示:应用NMN对HG培养的肾小球系膜细胞进行干预,随着Nampt表达减少(HG+NMN组绿色荧光较对照组明显减少),Vimentin表达也明显减少(HG+NMN组红色荧光较对照组也明显减少)。见图 11(插页二)。
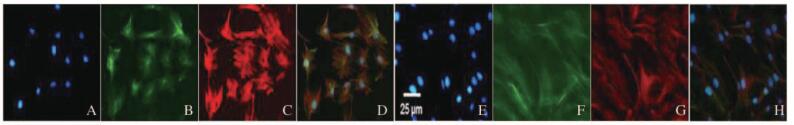
|
| A-D:HG Control;E-H:HG+NMN;A,E:Nucleus;B,F:Nampt;C,G:Vimentin;D,H:Merge. 图 11 NMN作用下肾小球系膜细胞HBZY-1中Nampt和Vimentin表达(bar=25 μm) Figure 11 Expression of Nampt and Vimentin in HBZY-1 cells after treated with NMN (bar=25 μm) |
|
|
免疫印迹实验检测结果:HG+NMN组细胞中Nampt和Vimentin蛋白相对表达水平(0.35±0.04) 和(0.42±0.05) 均较对照组(0.67±0.11) 和(0.62±0.08) 明显降低(P < 0.05和P<0.01)。见图 12。
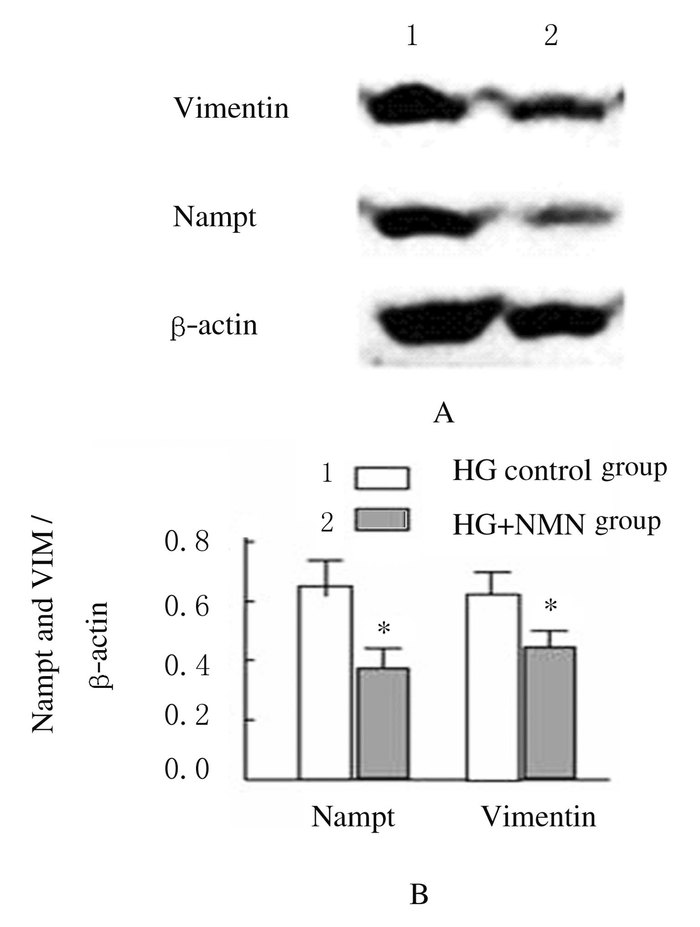
|
| 图 12 NMN作用下肾小球系膜细胞HBZY-1中Nampt和Vimentin的表达 Figure 12 Expressions of Nampt and VIM in HBZY-1 after treated with NMN |
|
|
糖尿病并发肾脏炎性-纤维化的机制迄今尚不清楚,严重危害人类健康[1]。因此揭示其发病机制和寻找治疗靶点成为预防和治疗的重点。Nampt作为烟酰胺转化为NMN的关键酶,能够通过依赖于Sirt1的作用(Nampt-NAD+-Sirt1信号途径),作用于多种底物,如组蛋白、P53肿瘤抑制因子、转录因子FOXO、过氧化物酶体增殖活化受体γ辅助活化因子(PGC-1α)和DNA损伤的关键调节子KU70等,参与调节糖异生、抑制糖酵解、增加胰岛素敏感性,在DNA损伤修复、细胞周期控制、抑制细胞凋亡、有机体的能量代谢、线粒体功能保护、炎症反应、抵抗氧化应激和延长细胞寿命等方面发挥重要作用[8-9]。有研究[10]表明:Nampt能够在纤维母细胞内激活NF-κB,诱导单核细胞的肿瘤坏死因子α(TNF-α)表达,这一发现支持Nampt可能作为前炎症因子和作为炎症靶分子治疗的证据。本课题组采用免疫荧光方法研究大鼠肾小球系膜细胞HBZY-1发现:应用高浓度葡萄糖对该细胞进行氧化应激冲击,细胞内Nampt、Vimentin和NF-κBp65均呈过度表达,而Sirt1表达却明显减少。为证实细胞内源性Nampt过度表达对Vimentin的调控作用,本研究将细胞分别应用10 μmol·L-1FK866和1 mmol·L-1 NMN进行处理,应用RT-PCR法检测结果显示:经上述2种物质处理后,细胞内源性NamptmRNA表达水平明显减少,NF-κBp65和Vimentin表达水平也明显减少。进一步的免疫荧光检测亦得到同样的结果,即应用NMN对HG培养的细胞进行干预后,随着Nampt表达减少,NF-κBp65和Vimentin也明显降低。免疫印迹结果也证实了相同的结果。上述实验结果表明:Nampt可能通过某种途径影响了Vimentin蛋白表达。
有研究[10]表明:Nampt能够通过依赖于Sirt1的作用构成Nampt-NAD+Sirt1途径,但过度表达的Nampt能够作为炎性因子进一步激活NF-κB信号,从而启动炎症信号发生炎症反应。在细胞内,NF-κB和Sirt1是2个相互拮抗的信号分子,Sirt1通过调节细胞氧化呼吸维持着细胞的生存,NF-κB在急性炎症时可刺激糖酵解能量通路参与前炎症反应,激活Sirt1抑制NF-κB信号,增强氧化代谢,并决定着炎症的走向,两者都是哺乳动物古老的涉及先天炎症和能量代谢相互协调的信号网络。同时Sirt1也能够通过激活腺苷酸活化蛋白激酶(AMPK)、过氧化物酶体增殖物活化受体α(PPARα)和PGC-1α,从而刺激氧化型能量产生,这些因素均可抑制NF-κB信号和消除炎症[12-13]。另一方面,NF-κB可通过抑制miR-34a、IFN-γ和活性氧类,使Sirt1活性下调。也有研究者[14]推测:在Sirt1基因的启动子上存在NF-κBp65的结合位点,活性氧(ROS)能够激活NF-κBp65,NF-κB复合物还能够结合miR34a的启动子,通过诱导miR34a表达从而抑制Sirt1表达,活性氧也可通过多种途径,直接使Sirt1的半胱氨酸残基发生氧化,导致Sirt1蛋白降解,从而达到抑制Sirt1的作用。
有研究[15]表明:Vimentin是构成间充质细胞的细胞骨架中间丝的主要成分,其表达与细胞表型有相关性,与细胞的形状、运动性和黏附功能有关,并且Vimentin与肾脏纤维化有密切关联。Lilienbaum等[16]研究证明:细胞骨架蛋白的中间丝Vimentin的5′端基因序列中含有NF-κBp65的结合位点,激活NF-κBp65可以导致Vimentin表达增加。由此本文作者推测:Nampt可能同时通过调节NF-κB和Sirt1的相互关系,从而间接影响细胞Vimentin的表达。本研究中调控Nampt诱导Vimentin基因表达,很可能是由于过度表达的Nampt作为炎性因子激活了转录因子NF-κB,从而导致Vimentin表达增加。
本研究的整体和离体实验结果显示:在自发性胰岛素基因缺陷的严重糖尿病小鼠和高浓度葡萄糖氧化应激状态下培养的大鼠肾小球系膜细胞HBZY-1中,过度表达的Nampt明显影响Vimentin表达,这种表达可能在肾小球炎性-纤维化过程发挥重要作用,这一结论验证了Matos等[17]的研究结论,即在肾纤维化初期时Vimentin表达明显增强[15]。本研究应用NMN干预实验证明:细胞内NMN作为Nampt的产物在体外应用时,能够通过负反馈作用抑制高浓度葡萄糖刺激下的Nampt过度表达,表明在糖尿病肾病的炎症-纤维化的发病过程中,NMN可能具有一定的预防和治疗作用。
| [1] | Miranda-Díaz AG, Pazarín-Villaseñor L, Yanowsky-Escatell FG, et al. Oxidative stress in diabetic nephropathy with early chronic kidney disease[J]. J Diabetes Res, 2016: 7047238. |
| [2] | Yun MR, Seo JM, Park HY. Visfatin contributes to the differentiation of monocytes into macrophages through the differential regulation of inflammatory cytokines in THP-1 cells[J]. Cell Signal, 2014, 26(4): 705–715. DOI:10.1016/j.cellsig.2013.12.010 |
| [3] | Luk T, Malam Z, Marshall JC. Pre-B cell colony-enhancing factor (PBEF)/visfatin:a novel mediator of innate immunity[J]. J Leukoc Biol, 2008, 83(4): 804–816. DOI:10.1189/jlb.0807581 |
| [4] | 曾令萍, 肖瑛, 张莹莹, 等. BMP-7对高糖环境下肾小管上皮细胞Id2和E2A蛋白表达的影响[J]. 中国病理生理杂志, 2016, 32(2): 321–326. |
| [5] | Hertig A, Anglicheau D, Verine J, et al. Early Epithelial phenotypic changes predict graft fibrosis[J]. J Am Soc Nephrol, 2008, 19(8): 1584–1591. DOI:10.1681/ASN.2007101160 |
| [6] | Liu M, Sun J, Cui J, et al. INS-gene mutations:from genetics and beta cell biology to clinical disease[J]. Mol Aspects Med, 2015, 42: 3–18. DOI:10.1016/j.mam.2014.12.001 |
| [7] | Brosius FC. Susceptible mice:identifying a diabetic nephropathy disease locus using a murine model[J]. Kidney Int, 2010, 78(5): 431–432. DOI:10.1038/ki.2010.199 |
| [8] | Benito-Martin A, Ucero AC, Izquierdo MC, et al. Endogenous NAMPT dampens chemokine expression and apoptotic responses in stressed tubular cells[J]. Biochim Biophys Acta, 2014, 1842(2): 293–303. DOI:10.1016/j.bbadis.2013.11.022 |
| [9] | Ramsey KM, Yoshino J, Brace CS, et al. Circadian clock feedback cycle through NAMPT-mediated NAD+biosynthesis[J]. Science, 2009, 324(5927): 651–654. DOI:10.1126/science.1171641 |
| [10] | Busso N, Karababa M, Nobile M, et al. Pharmacological inhibition of phosphoribosyltransferases transferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD[J]. PLoS One, 2008, 3(5): e2267. DOI:10.1371/journal.pone.0002267 |
| [11] | Salminen A, Huuskonen J, Ojala J, et al. Activation of innate immunity system during aging:NF-kB signaling is the molecular culprit of inflamm-aging[J]. Ageing Res Rev, 2008, 7(2): 83–105. DOI:10.1016/j.arr.2007.09.002 |
| [12] | Caito S, Rajendrasozhan S, Cook S, et al. SIRT1 is a redoxsensitive deacetylase that is post-translationally modified by oxidants and carbonyl stress[J]. FASEB J, 2010, 24(9): 3145–3159. DOI:10.1096/fj.09-151308 |
| [13] | Yang XD, Tajkhorshid E, Chen LF. Functional interplay between acetylation and methylation of the RelA subunit of NF-Kappa B[J]. Mol Cell Biol, 2010, 30(9): 2170–2180. DOI:10.1128/MCB.01343-09 |
| [14] | Kauppinen A, Suuronen T, Ojala J, et al. Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders[J]. Cell Signal, 2013, 25(10): 1939–1948. DOI:10.1016/j.cellsig.2013.06.007 |
| [15] | Galichon P, Hertig A. Epithelial to mesenchymal transition as a biomarker in renal fibrosis:are we ready for the bedside[J]. Fibrogenesis Tissue Repair, 2011, 4: 11. DOI:10.1186/1755-1536-4-11 |
| [16] | Lilienbaum A, Paulin D. Activation of the human vimentin gene by the tax human T-cell leukemia virus. Ⅰ. mechanisms of regulation by the NF-kappa B transcription factor[J]. J Biol Chem, 1993, 268(3): 2180–2188. |
| [17] | de Matos AC, Camara NO, Tonato EJ, et al. Vimentin expression and myofibroblast infiltration are early markers of renal dysfunction in kidney transplantation:an early stage of chronic allograft dysfunction[J]. Transplant Proc, 2010, 42(9): 3482–3488. DOI:10.1016/j.transproceed.2010.06.014 |
 2017, Vol. 43
2017, Vol. 43


