扩展功能
文章信息
- 邓子亮, 王森, 黎鹏, 解奎龙, 李淑贤, 周世雄, 贺晓舟, 陈东, 郭洪胜
- DENG Ziliang, WANG Sen, LI Peng, XIE Kuilong, LI Shuxian, ZHOU Shixiong, HE Xiaozhou, CHEN Dong, GUO Hongsheng
- 白细胞介素37对宫颈癌HeLa细胞顺铂化疗敏感性的增强作用
- Enhancement of IL-37 in chemosensitivity of cervical cancer HeLa cells to cisplatin
- 吉林大学学报(医学版), 2017, 43(05): 862-866
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 862-866
- 10.13481/j.1671-587x.20170502
-
文章历史
- 收稿日期: 2017-03-09
宫颈癌是严重影响女性健康的生殖系统肿瘤,2015年我国宫颈癌标化发病率为10.3/10万,标化死亡率为2.5/10万,45~59岁患者占46.21%[1-2]。顺铂(cisplatin, DDP)是宫颈癌化疗方案的基础,但宫颈癌细胞的化疗耐受性和DDP具有的肝、肾、眼、骨髓和消化道毒性限制了化疗效果。研究[3]显示:信号转导和转录激活因子3 (signal transducer and activator of transcription 3,STAT3) 下调可增强HeLa细胞对DDP的敏感性,促进细胞凋亡。新型抗炎因子IL-37可通过与IL-1R8和IL-18Rα组成的复合体抑制STAT3表达[4-5]。蒋娟等[6]研究显示:IL-37能抑制HeLa细胞增殖并促进其凋亡;Wang等[7]研究显示:IL-37通过抑制STAT3的表达,对HeLa细胞的增殖和侵袭能力有明显抑制作用。因此本文作者假设IL-37可能对HeLa细胞的化疗敏感性有增强作用,通过联合用药,可以达到增效减毒的效果,而相关的研究尚未见相关文献报道。本研究通过研究IL-37增强HeLa细胞对DDP的化疗敏感性,为开发能减少化疗中DDP的用量即可达到比较好的治疗效果,同时减轻DDP不良反应的新型化疗增敏剂提供理论和实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器HeLa细胞由广东医科大学组胚实验室保存。GIBCO PRMI1640培养基(货号21875158)、胎牛血清(货号10270-106) 和胰蛋白酶-EDTA消化液(货号30062) 购自美国Life Technologies公司,pIRES2-EGFP/IL-37质粒由本实验室合成保存[8],Trizol、氯仿、异丙醇和蛋白印迹试剂盒购自碧云天生物工程有限公司,逆转录试剂盒(货号DRR036A)试剂盒购于日本TaKaRa公司, 实时定量SYBR green master试剂(货号4913914001) 购自罗氏公司,Hilymax细胞转染试剂盒(货号H357) 和CCK-8试剂盒(货号CK04) 购自同仁化学研究所,GAPDH一抗(货号ab9484)、IL-37一抗(货号ab116282) 购自英国Abcam公司,兔二抗购自碧云天生物工程有限公司。PCR引物委托上海生工合成和测序。Western blotting电泳设备为美国Bio-Rad Laboratories公司生产,全自动酶标仪-DR200Bs为北京普天新桥技术有限公司生产,TCR0096实时荧光定量PCR仪购自Thermo Fisher Scientific Inc公司。
1.2 引物序列IL-37引物,上游序列:5′-GATCACAAAGTACTGGTCCTGG-3′,下游序列:5′-TCCTTTATCCTTGTCACAGTAG-3′;STAT3引物,上游序列:5′-TGTGCGTATGGGAACACCTA-3′,下游序列:5′-AGAAGGTCGTCTCCCCCTTA-3′;细胞周期蛋白D1(Cyclin D1) 引物,上游序列:5′-GTAGCAGCGAGCAGCAGAGT-3′,下游序列:5′-CGGTCGTTGAGGAGGTTGG -3′;GAPDH引物,上游序列:5′-TGACTTCAACAGCGACACCCA-3′,下游序列:5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.3 细胞培养HeLa细胞生长达80%密度时,除去培养基,加2 mL无菌PBS洗1次,用1 mL胰蛋白酶-EDTA消化液于37℃消化细胞2~3 min,加入1 mL生长培养基(10% FBS +100 U·mL-1青霉素+100 U·mL-1链霉素+90% PRMI 1640培养基)终止消化,轻轻吹下细胞,1 000 r·min-1离心5 min收集沉淀,2 mL培养基清洗1次,1:2或1:3传代后放入培养箱中培养,取生长良好处于对数生长期细胞用于实验。
1.4 细胞转染取对数生长期HeLa细胞,常规消化收集细胞,调整细胞浓度至1.5×105mL-1,每孔2 mL接种到6孔板(每孔含3.0×105个细胞)中,放入培养箱培养12 h。按Hilymax试剂盒说明书步骤溶解Hilymax试剂,在500 μL离心管中加入120 μL无血清DMEM培养基和12 μL Hilymax溶液,混匀后再加入3 μg质粒,轻轻混合均匀,室温静置15 min使质粒与Hilymax试剂充分结合,然后将混合好的体系加入到上述6孔板中,4 h后换液继续培养。空质粒转染组(NC)质粒为pIRES2-EGFP空载质粒,目的基因转染组(IL-37) 为pIRES2-EGFP/IL-37质粒。
1.5 IL-37蛋白表达检测采用Q-PCR和Western blotting法检测在转录和翻译水平目的基因表达水平的改变。① 基因转录水平检测:取转染pIRES2-EGFP空质粒(NC)和pIRES2-EGFP/IL-37质粒(IL-37) 后正常培养48 h的细胞,Trizol法提取总RNA,按照PrimeScript RT Master Mix (Perfect Real Time)试剂盒说明书步骤,每组取2.5 μg Total RNA,混合5×PrimeScript RT Master Mix 4 μL,RNase free ddH2O补足20 μL,轻轻混匀后37℃反转录反应15 min,85℃热处理5 s使反转录酶失活,迅速降温到4℃,然后将反转录好的cDNA保存到-20℃;混合2 μL cDNA、各10 μmol·L-1上下游引物和12.5 μL SYBR混合液,加ddH2O补足25 μL,轻轻混合均匀,反应条件:94℃预变性2 min,94℃变性30 s、55℃退火30 s、72℃延伸60 s、共40个循环,最后72℃延伸5 min。所有Q-PCR实验重复3次,结果取各基因相对GAPDH的表达水平。② 蛋白翻译水平检测:收集转染pIRES2-EGFP空质粒(NC)和pIRES2-EGFP/IL-37质粒(IL-37) 后37℃孵育48 h的细胞各1×106个,PBS洗涤2次,200 μL RIPA裂解液于4℃裂解30 min,12 000 g离心20 min后取100 μL上清,加入5×Loadding buffer 25 μL混匀后沸水煮10 min后用于Western blotting检测目的蛋白表达,条件如下:积层胶60 V、30 min,分离胶110 V、90 min;转膜250 mA,100 min,5%脱脂奶粉室温封闭1 h,一抗1:1000稀释后4℃孵育过夜,PBST洗3次,二抗1:1000稀释后室温孵育1 h,PBST洗3次,常规曝光显影。比较曝光后蛋白条带的颜色,蛋白表达水平越高对应条带的颜色越深。
1.6 细胞增殖活力检测收集转染pIRES2-EGFP质粒后37℃孵育10 h的细胞,调整细胞浓度至5×104mL-1,每孔100 μL接种到96孔板中,正常培养12 h后分别加入终浓度为0、5、10和15 mg·L-1DDP,分别于给药后24、48和72 h按照CCK8试剂盒说明书方法检测各组细胞活力,并计算各给药组相对于阴性对照组(DDP 0 mg·L-1)的细胞增殖抑制率, 增殖抑制率=(1-目标组细胞活力/对照组细胞活力)×100%。为比较IL-37与DDP联合给药的细胞抑制率,取转染pIRES2-EGFP质粒和pIRES2-EGFP/ IL-37质粒后37℃孵育10 h的细胞,调整细胞浓度为5×104 mL-1,每孔100 μL接种到96孔板中培养12 h,分别加入0和10 mg·L-1DDP,以pIRES2-EGFP质粒转染组作参照组,采用CCK8试剂盒检测细胞增殖抑制率。所有细胞活性检测实验重复3次。
1.7 STAT3和CyclinD1基因表达检测提取细胞基因组RNA,采用Q-PCR法检测STAT3和Cyclin D1基因的表达水平。
1.8 统计学分析采用GraphPad Prism 5.0分析软件作图并进行统计分析。基因转录水平相对表达水平、细胞活性和细胞抑制率以x ±s表示,样本均数比较两独立样本t检验,多组样本间均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 Q-PCR法和Western blotting法检测HeLa细胞IL-37mRNA和蛋白表达RT-PCR检测:与转染pIRES2-EGFP空质粒的NC组细胞比较,转染pIRES2-EGFP/IL-37质粒的IL-37组细胞IL-37 mRNA相对表达水平明显升高(P<0.01)(图 1A);Western blotting法检测IL-37蛋白表达水平,NC组几乎检测不到IL-37蛋白表达,而IL-37组IL-37蛋白条带非常明显(图 1B)。

|
| n=3,*P < 0.01.Lane 1:NC group; Lane 2:IL-37 group. 图 1 IL-37mRNA(A)和蛋白(B)在转染不同质粒宫颈癌HeLa细胞中的表达 Figure 1 Expressions of IL-37 mRNA (A) and protein(B) in cervical cancer HeLa cells transfected with different plasmids |
|
|
不加DDP刺激的宫颈癌细胞维持较高增殖活性,而DDP处理24 h后,HeLa细胞增殖活性明显降低,随时间延长,增殖活性抑制效果更加明显。DDP对宫颈癌HeLa细胞增殖活性的抑制作用存在剂量效应:处理24 h后,5、10和15 mg·L-1 DDP组的细胞增殖活力分别降低到对照组的78.90%、66.10%和44.29%(图 2)。
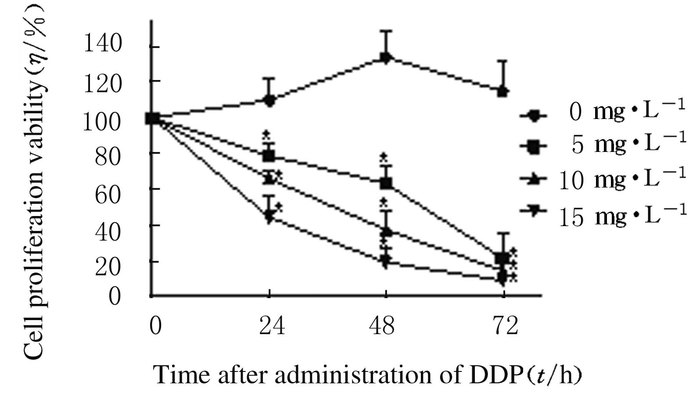
|
| n=3,*P < 0.05. 图 2 不同剂量DDP作用不同时间后宫颈癌HeLa细胞增殖抑制率 Figure 2 Inhibitory rates of proliferation of HeLa cells in cervical cancer Hela cells after treated with different doses of DDP for different time |
|
|
添加10 mg·L-1 DDP到质粒转染后的NC组和IL-37组的细胞,采用CCK8法检测细胞活力(图 3),结果显示:72 h后IL-37组的HeLa细胞较NC组减少了(36.0±3.8)%;而DDP与IL-37联合作用48 h时即可抑制80%宫颈癌HeLa细胞生长,优于DDP或IL-37单独处理组,DDP与IL-37联合作用72 h后对宫颈癌HeLa细胞抑制率达到(92.5±9.4)%。

|
| *P < 0.05compared with IL-37 and DDP+IL-37 group; △P < 0.05 compared with DDP and DDP+IL-37 group. 图 3 不同时间各组宫颈癌HeLa细胞增殖抑制率 Figure 3 Inhibiory rates of proliferation of cervical cancer HeLa cells at different time in various groups |
|
|
与NC组比较,IL-37组的STAT3基因和Cyclin D1基因表达水平分别下调了(37.5±11.2)%(P < 0.01) 和(31.8±4.0)%(P < 0.01)。见表 1。
3 讨论2013年,宫颈癌发病的世界人口标化率为14/10万,最新数据[1-2]显示:2015年我国女性宫颈癌的年龄分布为<30岁占1.52%、30~44岁为28.51%、45~59岁为46.21%、60~74岁为19.21%、75岁以上占4.55%,宫颈癌已成为严重威胁中国居民健康和社会发展的重要公共卫生问题,在影响女性生殖健康的疾病中, 宫颈癌发病率仅次于乳腺癌高居第2位。以手术、化疗和放疗为基础的单独或联合治疗方案是治疗宫颈癌主要方法,其中单独或联合采用化疗方法的比例达到49.8%[9]。DDP是宫颈癌化疗方案的基础,临床上DDP对宫颈癌的肿瘤抑制率达到63.9%[10],本研究结果也显示:高剂量DDP可抑制约85%HeLa细胞的生长。但DDP严重的肾、肝、耳、消化道和骨髓抑制等不良反应影响患者的治疗效果和生存质量,临床上常通过联合用药来达到降低DDP用药剂量和频次、增加细胞敏感性和减轻不良反应的目的。
| (n=3, x ±s, η/%) | ||
| Gene | Relative expression level | |
| STAT3 | Cyclin D1 | |
| NC | 100.0±16.1 | 100.0±7.2 |
| IL-37 | 37.5±11.2* | 31.8±4.0* |
| * P < 0.05 compared with NC group. | ||
本研究结果显示:DDP与IL-37联合作用72 h后,细胞抑制率达到(92.5±9.42)%,明显降低HeLa细胞对DDP的耐受性;联合作用48 h时即可抑制80%以上的肿瘤细胞生长,这与DDP单独刺激72 h或浓度提高到15 mg·L-1的效果相当。本研究表明:IL-37能改善宫颈癌细胞对DDP的耐受性,提高化疗效率,促进DDP更快地发挥作用;在IL-37存在的情况下,低剂量DDP即可快速发挥较好的肿瘤杀伤效果,这可明显降低DDP对化疗患者的严重不良反应。提示IL-37能显著降低DDP的给药剂量,提高其肿瘤抑制率,促进更快发挥药效,具有明显的减毒、增效、速效的功能。作为一种抗炎因子, IL-37与巨噬细胞、树突状细胞或外周血单核细胞表面的IL-1R8和IL-18Rα组成复合体[11-12],下调STAT3、PTEN和转录因子NF-κB活性[13],从而发挥抗炎效果,这可能也是IL-37增强DDP化疗效果的原因之一。
人乳头状肉瘤病毒(HPV)感染是宫颈癌发生的主要原因之一,慢性炎症在这个过程中起到重要作用,而SATA3能激活致癌性炎症,并且可以增强HeLa细胞的增殖和侵袭能力[14],IL-37能够通过抑制STAT3活性而降低宫颈癌细胞的增殖和侵袭,本研究也显示IL-37对HeLa细胞的活力有一定的抑制。陈晓等[15]研究显示:针对STAT3基因的shRNA真核表达载体有效地抑制宫颈癌HeLa细胞STAT3基因表达,增强其对化疗药物DDP的敏感性。Cyclin D1的过表达可促进肿瘤细胞的增殖,Cyclin D1缺乏则可阻止HPV E6/E7病毒诱导正常细胞向癌细胞转化[16-17],IL-37组的Cyclin D1表达下调说明IL-37也可能降低宫颈癌的发病风险。
综上所述,IL-37能抑制宫颈癌的增殖,且可增强DDP对宫颈癌细胞的杀伤效果,进而减少DDP给药剂量,降低其不良反应,这种效果可能与IL-37下调STAT3和Cyclin D1表达水平有关。
| [1] | 段纪俊, 严亚琼, 杨念念, 等. 中国恶性肿瘤发病与死亡的国际比较分析[J]. 中国医学前沿杂志:电子版, 2016, 8(7): 17–23. |
| [2] | Chen W, Zheng RD, Baade PD, et al. Cancer Statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2): 136–154. |
| [4] | Luo Y, Cai X, Liu S, et al. Suppression of antigen-specific adaptive immunity by IL-37 via induction of tolerogenic dendritic cells[J]. Proc Natl Acad Sci USA, 2014, 111(42): 15178–15183. DOI:10.1073/pnas.1416714111 |
| [5] | Ding VA, Zhu Z, Xiao H, et al. The role of IL-37 in cancer[J]. Med Oncol, 2016, 33(7): 68. DOI:10.1007/s12032-016-0782-4 |
| [6] | 蒋娟, 邹勇德, 蒋福平, 等. IL-37对宫颈癌HeLa细胞增殖和凋亡的影响[J]. 肿瘤药学, 2014, 4(4): 263–266. |
| [7] | Wang S, An W, Yao Y, et al. Interleukin 37 expression inhibits STAT3 to suppress the proliferation and invasion of human cervical cancer cells[J]. J Cancer, 2015, 6(10): 962–969. DOI:10.7150/jca.12266 |
| [8] | 陈荏槐, 胡新荣, 姚运红, 等. 新型抗炎因子IL-37真核表达载体pIRES2-EGFP/IL-37的构建及鉴定[J]. 广东医学院学报, 2014, 32(5): 607–609. |
| [9] | 孟祥凯, 郭毅, 唐艳君, 等. 治疗方案对宫颈癌患者生存质量影响的分析[J]. 中国妇幼保健, 2016, 31(12): 2432–2434. |
| [10] | 罗利民, 赵展, 贾勇士, 等. 顺铂与奈达铂同步放化疗对中晚期宫颈癌的实效性对照探究[J]. 中华全科医学, 2016, 14(3): 365–367. |
| [11] | Luo YC, Cai XG, Liu SC, et al. 171:IL-37 suppresses contact hypersensitivity by inducing tolerogenic dendritic cells[J]. Cytokine, 2013, 63(3): 283. |
| [12] | 丁利平, 黎丽, 刘冬舟, 等. IL-37对白塞病患者单核细胞分泌炎症因子的影响[J]. 深圳大学学报:理工版, 2016, 33(5): 447–451. |
| [13] | Nold-Petry CA, Lo CY, Rudloff I, et al. IL-37 requires the receptors IL-18R[alpha] and IL-1R8(SIGIRR) to carry out its multifaceted anti-inflammatory programupon innate signal transduction[J]. Nat Immunol, 2015, 16(4): 354–365. DOI:10.1038/ni.3103 |
| [14] | Zhou X, Ren Y, Liu A, et al. WP1066 sensitizes oral squamous cell carcinoma cells to cisplatin by targeting STAT3/miR-21 axis[J]. Sci Rep, 2014, 4: 7461. |
| [15] | 陈晓, 韩凌霄, 王玉萍, 等. STAT3基因表达对宫颈癌HeLa细胞顺铂敏感性的影响[J]. 武警医学院学报, 2010, 19(6): 433–436. |
| [16] | Scheel A, Lin GC, Mchugh JB, et al. Human papillomavirus infection and biomarkers in sinonasal inverted papillomas:clinical significance and molecular mechanisms[J]. Int Forum Allergy Rhinol, 2015, 5(8): 701–707. DOI:10.1002/alr.2015.5.issue-8 |
| [17] | 丁沐阳, 蒋文军, 张力, 等. EZH2抑制剂对宫颈癌HeLa细胞的抑制作用[J]. 西安交通大学学报:医学版, 2015, 36(5): 633–635. |
 2017, Vol. 43
2017, Vol. 43


