扩展功能
文章信息
- 毛西京, 王敏, 于挺敏, 姚刚
- MAO Xijing, WANG Min, YU Tingmin, YAO Gang
- 丁苯酞对血管性痴呆大鼠海马CA1区脑源性神经营养因子表达的影响
- Effect of 3-n-butylphthalide on brain-derived neurotrophic factor expression in hippocampal CA1 region of vascular dementia rats
- 吉林大学学报(医学版), 2017, 43(05): 857-861
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 857-861
- 10.13481/j.1671-587x.20170501
-
文章历史
- 收稿日期: 2016-12-24
丁苯酞(3-n-butylphthalide,NBP)是人工合成的消旋正丁基苯酞,临床研究[1]显示:NBP能够明显减轻急性缺血性脑卒中患者中枢神经功能缺损。随着对NBP研究的不断深入,目前发现NBP对血管性痴呆(vascular dementia,VD)也有较为明显的改善作用[2-3],但其作用机制尚缺乏深入的研究。神经营养因子在神经元的存亡、生长及分化过程中有着重要的作用,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是中枢神经系统中分布最广泛的神经营养因子,其不仅与神经元的生长及存活有关,而且可以调节突触传递和可塑性,与学习记忆功能有密切关联[4]。赵俊等[5]在制备VD大鼠模型2个月后开始灌胃给予NBP胶囊发现:VD大鼠海马区BDNF表达水平增加。在脑缺血发生的急性期开始给予NBP,VD大鼠海马区BDNF的表达随时间延续有何种变化,尚无相关研究。本研究在制备VD大鼠模型的基础上,应用NBP进行干预治疗,观察不同时间点VD模型大鼠海马CA1区BDNF表达变化,进而探讨NBP对VD的保护作用,为临床应用NBP治疗VD提供实验依据。
1 材料与方法 1.1 实验动物、药物及主要试剂健康SPF级Wistar大鼠(雌雄各半)80只,体质量200~220g,购于吉林大学基础医学院动物中心,动物合格证号:SCXK(吉)2003-001。NBP氯化钠注射液(石药集团恩必普药业有限公司,批准文号:国药准字H20100041),总RNA提取试剂盒(RNAiso Reagent)、反转录试剂盒RNA、E.coli DH5α菌株、pEASY-T1载体、限制性内切酶BamHⅠ和EcoRⅤ、实时定量PCR试剂盒SYBR Premix Ex TaqTM(大连TaKaRa公司),胶回收试剂盒、质粒小提试剂盒(美国Axygen Biosciences公司),大鼠抗BDNF多克隆抗体(北京博奥森生物公司)。
1.2 实验动物分组Wistar大鼠按随机区组法分为4组,每组20只。假手术组、NBP对照组(假手术+NBP注射剂)、VD组(VD模型组)、NBP处理组(VD模型+NBP注射剂);每组又分为4个亚组:术后1、2、4和8周组,每个亚组5只。
1.3 动物模型制备VD组和NBP处理组大鼠术前禁食禁水8 h,10%水合氯醛(0.3 mL·100 g-1)腹腔注射麻醉大鼠,仰卧位固定于操作台,常规消毒颈部手术区域,颈前正中纵形切口约1 cm、钝性逐层分离皮下软组织、颈前肌群,分离出气管侧后方的颈动脉鞘,进而分离颈总动脉与迷走神经,以1号丝线永久结扎颈总动脉,同法结扎另一侧颈总动脉。局部消毒后恢复组织层次并缝合皮肤。假手术组和NBP对照组大鼠除不结扎双侧颈总动脉外,其余操作与VD组和NBP处理组大鼠一致。术后大鼠另放于干净鼠笼饲养,自由取水及饲料。
1.4 药物干预NBP对照组和NBP处理组大鼠清醒后(术后1 d,可在笼中自由活动),给予NBP氯化钠注射液腹腔注射,剂量为5 mg·kg-1·d-1(药物剂量根据成人常规每日剂量进行换算),连续给药7 d。假手术组和VD组大鼠每次腹腔注射生理盐水(4 mL·d-1),连续给予7 d。
1.5 标本采集各组大鼠在术后各时间点(1、2、4和8周)行10%水合氯醛(0.3 mL·100 g-1)麻醉,每组取5只直接断头取脑,分离出一侧海马,-70℃保存,用于实时定量PCR检测;分离出另一侧海马,迅速置入10%甲醛固定48 h,PBS洗脱3次,80%~100%梯度酒精脱水,二甲苯透明后,石蜡包埋,制成厚度为4 μm的切片,用于免疫组织化学检测。
1.6 实时定量PCR检测RNAiso Reagent试剂提取海马总RNA,逆转录cDNA。BDNF引物,上游引物:5′-GGTCACAGTCCTGGAGAAAG-3′,下游引物:5′-GTCTATCCTTATGAACCGCC-3′,制备BDNF质粒标准品。SYBR GreenⅠ实时定量PCR 20 μL反应体系:SYBR Premix Ex TaqTM 10 μL,上下游引物各0.4 μL(10 μmol·L-1),ROX Reference Dye 0.4 μL,cDNA标本2.0 μL,dH2O 6.8 μL。将BDNF质粒标准品进行10倍系列稀释,同时进行PCR反应;反应条件:94℃预变性2 min,94℃变性30 s,53℃退火30 s,72℃延伸30 s,共40个循环,每个循环退火末期检测荧光信号。在反应条件中加入溶解曲线分析,分析模式:95℃、15 s, 60℃、20 s, 95℃、15 s。
1.7 免疫组织化学检测免疫组织化学检测采用SP法。每张切片于400倍镜下随机选取5个视野,利用Leica Qwin图像分析系统检测阳性表达水平,同时计算每个视野下的阳性细胞总数占所有细胞总数的比率,细胞表达平均水平计算采用视野灰度×阳性细胞比率(评分公式是∑pi, i代表细胞浆染色强度,p代表同一染色强度细胞所占计数细胞百分比),以5个视野的平均值表示。
1.8 统计学分析采用SPSS 13.0软件进行统计学处理。各组大鼠海马组织中BDNF mRNA和蛋白表达水平以x ±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠海马组织中BDNF mRNA表达水平① 不同时间点各组大鼠海马组织中BDNF mRNA表达水平比较:VD组和NBP处理组大鼠2、4和8周时海马BDNF mRNA表达水平明显高于假手术组(P<0.05);NBP处理组大鼠4和8周时海马BDNF mRNA表达水平明显高于VD组(P<0.05)。见表 1。② 不同组别大鼠各时间点海马组织中BDNF mRNA表达比较:NBP处理组大鼠4周时海马BDNF mRNA表达水平明显高于1周时(P<0.05),VD组大鼠各时间点海马BDNF mRNA表达水平比较差异无统计学意义(P>0.05)。见表 1。
| (n=5, x ±s,×104) | ||||
| Group | Expression level of BDNF mRNA | |||
| (week) 1 | 2 | 4 | 8 | |
| Sham operation | 1.22±0.38 | 1.20±0.20 | 1.51±0.26 | 1.33±0.18 |
| NBP control | 1.38±0.36 | 1.49±0.27 | 2.16±0.31 | 1.77±0.20 |
| VD | 2.12±0.32 | 3.04±0.35* | 3.15±0.41* | 2.87±0.45* |
| NBP treatment | 2.40±0.50 | 3.63±0.60* | 4.72±0.43*△ | 4.32±0.42*△ |
| * P<0.05 compared with sham operation group;△ P<0.05 compared with VD group. | ||||
BDNF蛋白阳性表达显示为黄棕色颗粒,主要定位于细胞浆。① 不同时间点各组大鼠海马CA1区BDNF蛋白表达水平比较:术后4周,VD组大鼠海马CA1区BDNF蛋白表达水平明显高于假手术组(P<0.05);术后2、4和8周,NBP处理组大鼠海马CA1区BDNF蛋白表达水平明显高于假手术组(P<0.05);术后8周时,NBP处理组大鼠海马CA1区BDNF蛋白表达水平明显高于VD组(P<0.05),NBP对照组大鼠海马CA1区BDNF蛋白表达水平明显高于假手术组(P<0.05)。② 不同组别大鼠各时间点海马CA1区BDNF蛋白表达水平比较:NBP处理组大鼠8周组海马CA1区BDNF蛋白表达水平明显高于1周组(P<0.05);NBP对照组大鼠4和8周组海马CA1区BDNF蛋白表达水平明显高于1周组(P<0.01)。见图 1(插页一)和表 2。
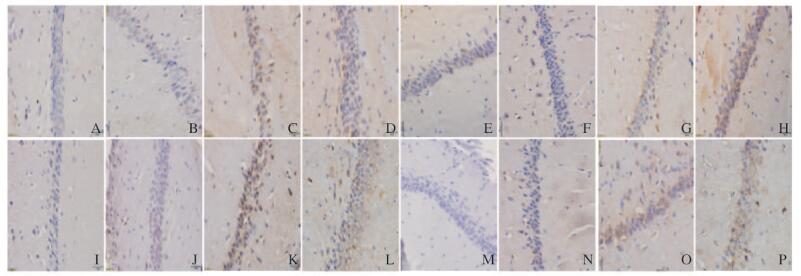
|
| A-D:1 week; E-H:2 weeks; I-L: 4 weeks; M-P:8 weeks. A,E,I,M: Sham operation group; B,F,J,N: NBP control group; C,G,K,O:VD group; D,H,L,P:NBP treatment group. 图 1 各组大鼠海马CA1区BDNF表达(免疫组织化学,×400) Figure 1 Expressions of BDNF in hippocampal CA1 region of rats in various groups(Immunohistochemistry, ×400) |
|
|
| (n=5, x ±s) | ||||
| Group | Expression level of BDNF | |||
| (week) 1 | 2 | 4 | 8 | |
| Sham operation | 59.28±3.88 | 51.62±7.85 | 53.74±7.22 | 56.66±6.48 |
| NBP contraol | 55.02±5.79 | 75.74±11.23 | 94.38±10.33 | 98.24±7.18* |
| VD | 88.54±9.05 | 96.60±13.94 | 105.08±11.23* | 92.54±8.40 |
| NBP treatment | 84.72±12.74 | 109.50±12.53* | 117.50±12.99* | 139.90±12.91*△ |
| * P<0.05 compared with sham operation group;△ P<0.05 compared with VD group. | ||||
永久性双侧颈总动脉结扎法制备VD大鼠模型是目前公认的VD造模方法[6-7],当双侧颈总动脉结扎后,并不会造成前脑组织的血供完全阻断,而是处于缺血状态,接近VD慢性脑灌注不足的发病机制,符合VD发病病理基础,与人类VD的发生具有最大程度的相似性[8-9],因此本研究VD大鼠模型采用永久性双侧颈总动脉结扎法制备。
BDNF作为神经营养因子家族的成员,广泛分布于中枢神经系统,特别是大脑皮质、海马和脊髓[10]。在胚胎生长发育时BDNF水平很高,发育成熟后BDNF维持在较低水平,发生脑缺血等损伤后,BDNF表达水平会发生很大变化,BDNF反应性表达增加是神经元对缺血缺氧等损伤的一种自身保护作用[11]。BDNF表达增加通过与神经元上的受体(TrkB或p75NTR)结合,维持神经元存活、减轻神经元损伤程度[12]。本研究结果显示:VD组大鼠海马组织中BDNFmRNA表达水平高于假手术组,VD组大鼠4周时BDNF蛋白表达水平明显高于假手术组,提示VD模型大鼠海马CA1区神经元在遭受缺血损伤后,BDNF反应性表达增加,对受损神经元起到一定的保护作用。
BDNF不仅与神经元的生长及存活有关,还可以刺激新的神经元及突触生长与分化,促进脑损伤后神经元修复,调节突触传递和可塑性,与认知和记忆密切关联[13-14]。突触可塑性有关的海马长时程增强(1ong-term potentiation,LTP)参与学习和记忆过程,研究[15]发现:BDNF可以通过TrkB/Akt/Girdin/Src信号通路,促使NMDA受体的NR2B亚单位磷酸化,进而激活NMDA受体参与LTP的形成。水迷宫测试实验[16-18]结果显示:脑损伤后的动物反应和记忆均较差,脑组织中BDNF水平也明显降低,脑内注射BDNF可以在一定程度上改善动物的学习和记忆能力。本研究结果显示:术后4和8周,NBP处理组大鼠海马BDNFmRNA表达水平明显高于VD组,术后8周时NBP处理组大鼠CA1区BDNF蛋白表达水平明显高于VD组,说明NBP可以促进VD大鼠海马CA1区BDNF的表达。
综上所述,本实验在制备VD大鼠的基础上,应用NBP给予干预治疗,观察不同时间点大鼠海马CA1区BDNF表达情况,结果表明:VD模型大鼠海马CA1区神经元在遭受缺血损伤后,BDNF反应性表达增加,而NBP则可以明显提高VD大鼠海马CA1区BDNF的表达水平,发挥神经保护作用。
| [1] | 朱以诚, 崔丽英, 高山, 等. 丁苯酞注射剂治疗急性脑梗死的多中心、随机、双盲双模拟、对照Ⅲ期临床试验[J]. 中华神经科杂志, 2014, 47(2): 113–118. |
| [2] | 邵小鹏, 桂树华, 胡玲玲. 丁苯酞治疗老年血管性痴呆的临床疗效及对精神心理量表的影响[J]. 中国老年学杂志, 2013, 33(22): 5601–5602. |
| [3] | 赵万红, 罗超, 龚应霞, 等. 消旋丁苯酞对慢性脑缺血大鼠认知功能的影响及其生化机制研究[J]. 中华老年医学杂志, 2014, 33(4): 412–415. |
| [4] | Santos AR, Mele M, Vaz SH, et al. Differential role of the proteasome in the early and late phases of BDNF-induced facilitation of LTP[J]. J Neurosci, 2015, 35(8): 3319–3329. DOI:10.1523/JNEUROSCI.4521-14.2015 |
| [5] | 赵俊, 李昕, 孙玉华. 丁苯酞对血管性痴呆大鼠脑组织BDNF表达的影响[J]. 中国老年学杂志, 2014, 34(12): 3395–3396. DOI:10.3969/j.issn.1005-9202.2014.12.085 |
| [6] | Cechetti F, Worm PV, Pereira LO, et al. The modified 2VO ischemia protocol causes cognitive impairment similar to that induced by the standard method, but with a better survival rate[J]. Braz J Med Biol Res, 2010, 43(12): 1178–1183. DOI:10.1590/S0100-879X2010007500124 |
| [7] | Jia H, Zhang XM, Zhang BA, et al. Dendritic morphology of neurons in medial prefrontal cortex and hippocampus in 2VO rats[J]. Neurol Sci, 2012, 33(5): 1063–1070. DOI:10.1007/s10072-011-0898-4 |
| [8] | Li Y, Zhang Z. Gastrodin improves cognitive dysfunction and decreases oxidative stress in vascular dementia rats induced by chronic ischemia[J]. Int J Clin Exp Pathol, 2015, 8(11): 14099–14109. |
| [9] | Li H, Liu Y, Lin LT, et al. Acupuncture reversed hippocampal mitochondrial dysfunction in vascular dementia rats[J]. Neurochem Int, 2016, 92(1): 35–42. |
| [10] | Chen A, Xiong LJ, Tong Y, et al. The neuroprotective roles of BDNF in hypoxic ischemic brain injury[J]. Biomed Rep, 2013, 1(2): 167–176. DOI:10.3892/br.2012.48 |
| [11] | 王昌铭, 向静, 彭昌鼎, 等. 脐血单个核细胞对血管性痴呆大鼠脑组织BDNF、NGF的影响[J]. 中华神经医学杂志, 2008, 7(4): 367–371. |
| [12] | Bothwell M. NGF, BDNF, NT3, and NT4[J]. Handb Exp Pharmacol, 2014, 220(1): 3–15. |
| [13] | Schäbitz WR, Steigleder T, Cooper-Kuhn CM, et al. Intravenous brain-derived neurotrophic factor enhances poststroke sensorimotor recovery and stimulates neurogenesis[J]. Stroke, 2007, 38(7): 2165–2172. DOI:10.1161/STROKEAHA.106.477331 |
| [14] | Andero R, Choi DC, Ressler KJ. BDNF-TrkB receptor regulation of distributed adult neural plasticity, memory formation, and psychiatric disorders[J]. Prog Mol Biol Transl Sci, 2014, 122(1): 169–192. |
| [15] | Nakai T, Nagai T, Tanaka M, et al. Girdin phosphorylation is crucial for synaptic plasticity and memory:a potential role in the interaction of BDNF/TrkB/Akt signaling with NMDA receptor[J]. J Neurosci, 2014, 34(45): 14995–15008. DOI:10.1523/JNEUROSCI.2228-14.2014 |
| [16] | Griesbach GS, Hovda DA, Molteni R, et al. Voluntary exercise following traumatic brain injury:brain-derived neurotrophic factor upregulation and recovery of function[J]. Neuroscience, 2004, 125(1): 129–139. DOI:10.1016/j.neuroscience.2004.01.030 |
| [17] | 弓园芳, 施梦丽, 张勤, 等. 血管性痴呆患者mTHFR基因多态性和血浆Hcy水平检测[J]. 郑州大学学报:医学版, 2016, 51(5): 647–650. |
| [18] | 崔渊博, 马姗姗, 姚宁, 等. 人脐带间充质干细胞移植对老年痴呆小鼠脑、肝组织中衰老相关基因表达的影响[J]. 郑州大学学报:医学版, 2015, 50(1): 25–29. |
 2017, Vol. 43
2017, Vol. 43


