扩展功能
文章信息
- 周宏, 刘进才, 谢佩含, 游咏, 罗光华, 杨娟, 卿伟鹏
- ZHOU Hong, LIU Jincai, XIE Peihan, YOU Yong, LUO Guanghua, YANG Juan, QING Weipeng
- 磁敏感序列分析和常规MRI检查对脑血管淀粉样变脑出血诊断价值比较
- Comparison of diagnostic values between magnetic susceptibility-weighted imaging and routine MRI in patients with cerebral amyloid angiopathy-related hemorrhage
- 吉林大学学报(医学版), 2017, 43(05): 1042-1046
- Journal of Jilin University (Medicine Edition), 2017, 43(05): 1042-1046
- 10.13481/j.1671-587x.20170535
-
文章历史
- 收稿日期: 2016-10-08
2. 南华大学附属第一医院神经内科, 湖南 衡阳 421001
2. Department of Neurotogy, First Affilated Hospitasl, University of South China, Hengyang 421001, China
淀粉样脑血管病(cerebral amyloid angiopathy,CAA)既往由于发病隐匿,临床诊断较为困难,然而近年来多种回顾性分析显示CAA临床病例并非罕见[1]。CAA患者临床表现多为多发性不同出血量的脑出血,因此也被称为脑血管淀粉样变脑出血(cerebral amyloid angiopathy-related hemorrhage,CAAH) [2]。由于CAAH无特异性出血部位,且出血病灶较小,病灶周围无明显水肿,常规MRI难以有效地检测诊断,因此寻找适宜CAAH的检测方法成为临床热点问题之一[3]。近年来磁敏感序列分析(susceptibility-weighted imaging, SWI)技术对中枢神经系统疾病微小病灶的鉴别诊断价值已得到临床认可并推广[4],然而目前SWI技术对CAAH诊断价值的临床报道尚不多见,因此本研究通过分析本院收治的CAAH患者临床资料,以此评估SWI在CAAH诊断中的临床价值,提高临床诊断水平。
1 资料与方法 1.1 病例选择选取2015年1月—2016年6月本科住院68例临床诊断怀疑CAAH的患者为研究对象,其中男性32例,女性36例,平均年龄为(57.8±8.6) 岁,患者家属或监护人均签订知情同意书,本研究经本院伦理委员会审核。纳入标准:① 所有患者均接受常规脑MRI平扫及SWI扫描;② 均接受神经外科手术治疗。排除标准:① 既往存在其他原因导致的脑出血;② 昏迷患者不能配合治疗的;③ 存在颅内占位、血液系统疾病和血管畸形等疾病;④ 存在其他严重多脏器功能损害。
1.2 CAAH诊断依据CAAH诊断均依据2001年波士顿诊断标准[5],主要内容为将CAA的诊断分为4级:① 明确的CAAH诊断。尸体解剖检查发现明确脑叶、皮质或皮质下出血和严重CAAH;② 高度可能的CAAH诊断。通过对血肿或皮质活检标本的病理组织学证实有出血和不同程度的血管淀粉样蛋白沉积,并且临床资料有明确脑出血的特征;③ 可能程度较高的CAAH诊断。缺乏病理学证据,但患者年龄大于60岁,且临床资料和MRI检查证实有多发性血肿;④ 可能程度可疑的CAAH诊断。缺乏病理学证据,年龄大于60岁,临床和MRI资料提示有单个脑叶、皮质或皮质下出血,或多发性出血有可能但不是确定性的病因。本研究对象均接受神经外科手术,且对血肿或皮质标本进行病理组织学检查,即本研究的CAAH诊断符合波士顿诊断标准第2级。
1.3 检查方法检查仪器为Philips公司的Achieva 3.0T超导核磁共振仪,头部8通道相控阵线圈,头部固定以防止产生运动伪影。首先予以常规MRI序列检查:主要包括自旋回波T1加权像(T1WI)、快速自旋回波T2加权像(T2WI)、体液衰减翻转回复序列(FLAIR);再予以SWI序列检查,主要参数为TR 40.5 ms、TE 26.0 ms、FOV 22 cm×22 cm,层厚2.0 mm、矩阵设定448×384。全套序列检查时间为(42.4±4.7) min。所有研究对象影像学检查数据导入MR Systems Achieva Release 2.6.3.6工作站,进行图像后处理。经过相位图的相位掩模、低通滤波和复数相乘等一系列后处理技术得到SWI图像。
1.4 图像分析评价本研究影像学图像由2名高年资MRI诊断主治医师和副主任医师独立进行观察及诊断,存在差异,则予以讨论达成一致。评估内容包括2个序列出血部位、病灶数目、出血灶形态和对病变显示情况,并将常规MRI图像与SWI图像的上述指标进行比较。应用李克特量表[6](Likert scale)对2个检查序列图像质量进行分级评分,具体标准共分为5级:① 1级为5分,非常清晰;② 2级为4分,清晰;③ 3级为3分,满意;④ 4级为2分,一般;⑤ 5级为1分,图形差。其中设定1~3级为图像质量合格。
1.5 统计学分析采用SPSS 23.0软件进行统计学分析。病灶检出率及病灶图像合格率以百分率表示,2种检查方法病灶检出率及病灶图像合格率比较应用χ2检验;采用Kappa一致性检验,分别评价常规MRI图像与SWI图像对CAAH评估情况一致性;应用多因素Logistic回归分析术前MRI的影像学特征与患者发生病灶出血的危险性,计算比值比(OR)。检验水准为α=0.05。
2 结果 2.1 2种检查序列检查结果68例临床诊断怀疑CAAH的患者经病理组织学检查确诊为CAAH为61例。其中常规MRI序列检出CAAH病灶53个,检出率为86.89% (53/61);检出脑皮层及皮层下白质多发出血47例,单脑叶单发出血6例,包括额叶3例、顶叶2例和枕叶1例。SWI序列检出CAAH出血病灶59个,检出率为96.72% (59/61),SWI序列显示出血灶数目明显多于常规MRI序列,2种影像学方法对CAAH病灶检出率比较差异有统计学意义(P < 0.05)。SWI序列不仅检出所有的常规MRI序列检出的病灶,而且对12例皮层下白质的微小出血灶具有较好检出效果,包括基底节出血7例,丘脑出血5例。
2.2 2种检查序列特征常规MRI检查的T1WI表现为以低、等信号为主的混杂信号,部分病灶内见点状、片状或环状短T1信号;T2W1表现以低、高信号为主的混杂信号。SWI序列表现为多发低信号区,边缘清楚;或呈现斑点状病灶。出血病灶形态多样,其中斑片状28例,圆形或椭圆形21例,不规则形18例,分叶状7例,其中14例患者均具有2种以上形态的血肿。见图 1。
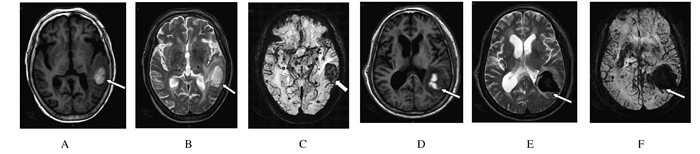
|
| A-C: One 64-year old male patient; D-F: One 59-year old female patient. A, D: TW1; B, E: TW2; C, F: DWI.Arrows indicated focus hemorrhage. 图 1 CAAH病灶出血MRI特征 Figure 1 Features of MRI of focus hemorrhage in patients with CAAH |
|
|
常规MRI检查对检出的53例CAAH患者中,病灶图像合格率为92.45%(49/53),而SWI序列检出的59例CAAH患者中,病灶图像合格率为94.92%(56/59),2种检查序列的病灶图像合格率比较差异无统计学意义(P>0.05)。见表 1。
| Method | 3 score | 4 score | 5 score | Qualified cases | Qualified rate |
| Routine MRI | 16 | 29 | 8 | 53 | 92.45%(49/53) |
| SWI | 9 | 34 | 16 | 59 | 94.92%(56/59) |
| χ2 | 3.534 | ||||
| P | 0.086 |
以SWI为标准,对比2种序列对61例经病理组织学检查确诊为CAAH患者显示病灶的符合情况。经Kappa检验,常规MRI检查与SWI序列检查2种序列对比灵敏度为100.00%,特异度为25.00%,符合率为90.16%,阳性预测值为89.83%,阴性预测值为100.00%,Kappa指数为0.366 6,证明对怀疑CAAH患者的检出情况SWI序列与MRI序列检出一致性较差。见表 2。
| Checking sequence | Routine MRI | ||
| Positive | Negative | ||
| SWI | Positive | 53 | 6 |
| Negative | 0 | 2 | |
以患者发生CAAH出血病灶为应变量,斑片状信号、圆形或椭圆形信号、不规则片状低信号区、分叶状低信号区、环状低信号区以及多发边缘低信号区为自变量进行回归分析,结果显示:斑片状信号及多发边缘清低信号区是CAAH患者发生病灶出血的独立预测因子(OR=3.895, P=0.025; OR=3.124, P=0.029)。见表 3。
| Parameter | Regression coefficient | Wald value | Standard error | Odds ratio (OR) | P |
| Patchy high signal | 1.360 | 12.291 | 0.064 | 3.895 | 0.025 |
| Circular or oval signal | 0.659 | 7.654 | 0.089 | 1.932 | 0.063 |
| Irregular patchy Low-signal region | 0.431 | 7.426 | 0.032 | 1.539 | 0.070 |
| Lobulated low-signal region | 0.562 | 6. 823 | 0.048 | 1.754 | 0.075 |
| Ring low-signal region | 0.213 | 5. 354 | 0.102 | 1.237 | 0.089 |
| Multiple clear edge low signal area | 1.140 | 7.587 | 0.085 | 3.124 | 0.029 |
目前研究[8]。目前CAAH诊断的“金标准”主要通过尸检病理诊断来确定,然而临床上达到此标准极为困难,因此目前主要根据波士顿诊断标准将CAAH的诊断效力进行分级,对于1、2级均有脑组织活检病理检查结果,因此可认为确诊。本研究纳入研究对象均是接受神经外科手术患者,因此CAAH诊断属于第2级,可认为是确诊。但临床上对于CAAH患者难均以外科治疗,并且外科手术本身也存在争议,因此术前明确诊断对于临床治疗方案确定具有很高指导作用。由于CAAH发病隐匿,临床特点是脑叶反复多发出血且出血病灶微小,常规MRI难以检测,既往CAAH多是发生明显脑内出血外科手术后病理检查确诊[9],因此CAAH的影像学诊断已成为临床工作中的难点[10]。
近年来SWI技术已广泛应用于脑血管病、脑肿瘤以及脑变性疾病等方面的临床诊断,因此有研究者提出应用SWI检查CAAH也能取得较好的临床效果[11-12]。SWI是一种新型磁共振对比度增强技术,其主要利用组织间的磁敏感性差异,在后期图像后处理中应用相位掩模技术产生图像显著对比,以此来有效显示微小的病灶,提高中枢神经系统疾病的鉴别诊断能力[13-14]。由于SWI序列具有较好显示脑组织内静脉血流、对血红蛋白代谢产物、铁质沉积以及对局部磁场差异性高度敏感等特点,因此急性脑出血病灶在SWI序列图像中表现为明显的信号丢失,出血形态显示好,辨识度非常高,且对于微小病灶诊断方面明显优于传统MRI序列[15-16]。研究[17]证实:SWI较常规MRI序列对颅内出血有着更高的检出率,认为其更能反映CAAH的多发性特点。但目前相关临床报道仍不充分,故本研究对SWI序列在CAAH的鉴别诊断临床价值进行评估。
本研究结果显示:常规MRI序列检出率达到86%,但是SWI显示出血灶数目明显多于常规MRI序列,即其对CAAH病灶敏感度更高。本研究中2种检查序列显示CAAH表现为急性、亚急性和慢性期血肿混合存在,在常规MRI主要为T1WI、T2WI和FLAIR上表现为低、等、高信号同时存在的混杂信号,这也验证CAAH具有反复发作以及容易复发的临床特征。而CAAH发病部位呈多发性分布,以脑叶皮质和皮质下白质为主,且其出血病灶形态特征为多样性,以斑片状、圆形或椭圆形为主。本研究结果证实:SWI序列和常规MRI序列对CAAH检查的图像质量均较好,合格率均大于90%,且无差异,表明本研究的系统误差控制较好,因图像质量导致的诊断偏差被排除。经Kappa检验显示:常规MRI检查与SWI序列检查2种序列的一致性较差,SWI序列优于常规MRI检查。进一步研究显示:患者出现斑片状信号及多发边缘清低信号区等影像学特征,应高度关注发生CAAH病灶出血的可能性。
综上所述,本研究证实CAAH患者的SWI序列影像学特征能对患者发生病灶出血提供较为可靠的预测价值,尤其是斑片状信号及多发边缘清低信号区被认为是较为特征性的征象。由于纳入本研究的样本量较小,且为单中心的临床回顾性研究,因此研究结果仍需要大样本、多中心的临床研究来进一步证实。
| [1] | Yamada M. Cerebral amyloid angiopathy:emerging concepts[J]. J Stroke, 2015, 17(1): 17–30. DOI:10.5853/jos.2015.17.1.17 |
| [2] | Renard D, Wacongne A, Le Floch A, et al. Vicinity of FLAIR hyperintensities and SWI microbleeds in cerebral amyloid angiopathy-related inflammation[J]. Eur Neurol, 2016, 75(5/6): 223–224. |
| [3] | Tolchin B, Fantaneanu T, Miller M, et al. Status epilepticus caused by cerebral amyloid angiopathy-related inflammation[J]. Epilepsy Behav Case Rep, 2016, 6: 19–22. DOI:10.1016/j.ebcr.2016.05.003 |
| [4] | Lauer A, van Veluw SJ, William CM, et al. Microbleeds on MRI are associated with microinfarcts on autopsy in cerebral amyloid angiopathy[J]. Neurology, 2016, 87(14): 1488–1492. DOI:10.1212/WNL.0000000000003184 |
| [5] | Knudsen KA, Rosand J, Karluk D, et al. Clinical diagnosis of cerebral amyloid angiopathy:validation of the Boston criteria[J]. Neurology, 2001, 56(4): 537–539. DOI:10.1212/WNL.56.4.537 |
| [6] | Costa DN, Lotan Y, Rofsky NM, et al. Assessment of prospectively assigned likert scores for targeted magnetic resonance imaging-transrectal ultrasound fusion biopsies in patients with suspected prostate cancer[J]. J Urol, 2016, 195(1): 80–87. DOI:10.1016/j.juro.2015.07.080 |
| [7] | 王会林, 杨虹, 张莉. 脑血管淀粉样变脑出血的临床与磁敏感序列分析[J]. 中国实用神经疾病杂志, 2016, 19(4): 63–65. |
| [8] | De Reuck J, Auger F, Durieux N, et al. The topography of cortical microbleeds in frontotemporal lobar degeneration:a post-mortem 7.0-tesla magnetic resonance study[J]. Folia Neuropathol, 2016, 54(2): 149–155. |
| [9] | Gasca-Salas C, García de Eulate R, Pastor P. The use of SWI-MRI to differentiate between seizures and transient ischemic attacks in a patient with cerebral amyloid angiopathy[J]. An Sist Sanit Navar, 2011, 34(2): 317–321. DOI:10.4321/S1137-66272011000200020 |
| [10] | De Reuck J, Cordonnier C, Deramecourt V, et al. Lobar intracerebral haematomas:Neuropathological and 7.0-tesla magnetic resonance imaging evaluation[J]. J Neurol Sci, 2016, 369: 121–125. DOI:10.1016/j.jns.2016.08.012 |
| [11] | Yates PA, Villemagne VL, Ellis KA, et al. Cerebral microbleeds:a review of clinical, genetic, and neuroimaging associations[J]. Front Neurol, 2014, 4: 205. |
| [12] | Charidimou A, Martinez-Ramirez S, Reijmer YD, et al. Total magnetic resonance imaging burden of small vessel disease in cerebral amyloid angiopathy:an imaging-pathologic study of concept validation[J]. JAMA Neurol, 2016, 73(8): 994–1001. DOI:10.1001/jamaneurol.2016.0832 |
| [13] | Beitzke M, Enzinger C, Wünsch G, et al. Contribution of convexal subarachnoid hemorrhage to disease progression in cerebral amyloid angiopathy[J]. Stroke, 2015, 46(6): 1533–1540. DOI:10.1161/STROKEAHA.115.008778 |
| [14] | Nonaka T, Yakushiji Y, Ide T, et al. Pre-critical MRI findings of an Alzheimer's disease patient with pathologically proven cerebral amyloid angiopathy related lobar hemorrhage[J]. Rinsho Shinkeigaku, 2016, 56(5): 338–343. DOI:10.5692/clinicalneurol.cn-000860 |
| [15] | Renard D, Thouvenot E. Evolution of subarachnoid hemorrhage extension in lobar hemorrhage in the early chronic phase and the impact on cerebral amyloid angiopathy criteria[J]. J Stroke Cerebrovasc Dis, 2016, 25(10): 2502–2505. DOI:10.1016/j.jstrokecerebrovasdis.2016.06.026 |
| [16] | Azmin S, Osman SS, Mukari S, et al. Cerebral amyloid angiopathy:an important differential diagnosis of stroke in the elderly[J]. Malays J Med Sci, 2015, 22(1): 74–78. |
| [17] | Charidimou A, Martinez-Ramirez S, Reijmer YD, et al. Total magnetic resonance imaging burden of small vessel disease in cerebral amyloid angiopathy:An imaging-pathologic study of concept validation[J]. JAMA Neurol, 2016, 73(8): 994–1001. DOI:10.1001/jamaneurol.2016.0832 |
 2017, Vol. 43
2017, Vol. 43


